胆囊癌较常见于女性,女性与男性之比约 3~4:1,90%以上患者诊断年龄在50岁或50岁以上[1]。 胆囊原发性癌临床少见,组织学分型中有腺癌、 腺鳞癌、鳞状细胞癌、未分化癌、小细胞癌及癌 肉瘤等。其中腺癌最为常见,胆囊腺癌可以出现 不同程度的鳞状上皮化生、根据鳞状上皮分化的 好坏分别诊断为腺棘皮瘤和腺鳞癌[2]。纯粹的鳞状 细胞癌是指肿瘤完全由恶性鳞状细胞组成,不伴 有任何腺样或黏液样成分分化,在胆囊恶性肿瘤 中非常罕见[3]。国外统计,胆囊原发性鳞状细胞癌 占胆囊恶性肿瘤的0~3.3% [4],国内偶有报道[5, 6, 7, 8, 9, 10, 11]。 笔者在临床中遇见一例,现报告如下。 1 病例资料
患者,女,60岁,因无明显诱因持续性右上 腹胀痛1周于2012年12月20日入院。向右肩背部 放射性、持续性疼痛,无恶心、呕吐、反酸、呼 吸困难等不适,无寒颤、发热等症状。体检:皮 肤及巩膜无黄染,腹部平坦,无腹壁静脉曲张, 右上腹压痛,无反跳痛。肝脾肋下未触及,未触 及胆囊,Mushy征阳性。腹部B超示:肝脏形态正 常,实质回声分布不均,肝内可见两个强光点回 声,后伴声尾。门静脉主干内径1.0 cm。胆囊大小 为7.0 cm×4.6 cm壁欠光滑,厚0.2 cm,囊内可见 1.9 cm×0.9 cm强光团回声,后伴声影,囊内另可 见6.1 cm×4.3 cm低回声团块充填,胆总管上段内 径0.5 cm。脾脏厚3.2 cm,长0.5 cm。CDFI:上述 低回声团块内可见血流信号。提示:肝内胆管结 石,胆囊结石,胆囊癌可疑。CT提示:胆囊癌。血 常规:红细胞计数3.33×109/L,血红蛋白103.0 g/L, 其余未见显著改变。癌胚抗原2.9 ng/ml、糖类抗原 CA-199 16.20 u/ml均在正常范围。肝功能正常。 术中所见:胆囊明显肿大与周围组织粘连,仔细 分离粘连组织,解剖胆囊三角,结扎胆囊管及胆 囊动脉,切除胆囊,分离胆囊与肝脏组织,胆囊 内新生物呈菜花样改变,填满胆囊,并可见多枚 结石。
病理检查:巨检:胆囊大小10 cm×7 cm×7 cm, 胆囊壁厚1.8 cm,胆囊体部黏膜面有一直径3.2 cm 肿块突入胆囊腔,几乎填满胆囊,表面呈菜花 样,切面灰白黄色,实性,质脆,肿块向下侵及 胆囊壁。肿块边胆囊腔内有1.9 cm×0.9 cm×0.9 cm 结石一枚。镜检:大部分胆囊黏膜上皮坏死、脱 落,菜花样肿块为伴有大量角化的鳞状细胞癌组 织,周边与胆囊腺上皮移行,见图 1A、1B。癌细 胞排列成巢状,可见角化殊,见图 1C,浸润性生 长,侵及胆囊肌层,见图 1D。癌细胞体积较大, 核深染,核仁明显,核分裂相易见,细胞间桥明 显。免疫组织化学结果:癌细胞CK5/6阳性,P63 阳性,CK8/18阴性。胆囊颈断端未见癌组织。
病理诊断:胆囊原发性角化型鳞状细胞癌, 侵及胆囊肌层。
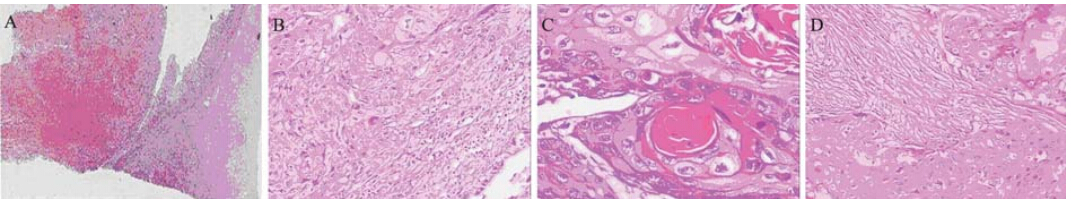 |
A:the tumor was showed as diffuse distension and irregular intraluminal polypoid masses in gallbladder (left part) (×20);B: the gallbladder epithelial was seen around squamous cell carcinoma( left part ) (×100);C: well formed central keratin pearls were seen in squamous cell carcinoma of gallbladder (×200);D: squamous cell carcinoma invaded muscular layer of gallbladder (×100) 图 1胆囊原发性角化型鳞状细胞癌组织形态学观察(HE染色) Figure 1Histological morphology of primary gallbladder keratinizing squamous cell carcinoma(HE staining) |
胆囊鳞状细胞癌早期临床症状无特异性,80% 的患者表现为右上腹疼痛[12],呈持续性或间歇性 钝痛或绞痛,部分患者疼痛可放射至右肩、背 部,术前诊断正确率低,易误诊为其他类型的胆 囊癌或结石性胆囊炎。国内报告的7例[5, 6, 7, 8, 9, 10, 11]中首诊 症状为右上腹痛7例(100%),CT表现胆囊占位 6例(86%)。胆囊鳞状细胞癌的病因尚未完全明 了,普遍认为胆囊炎及胆囊结石的长期刺激与其 发生有一定关系[7]。目前从大量流行病学及临床资 料分析,已证实胆囊癌发生的相关因素有:(1)>50 岁的女性胆囊炎患者;(2)胆囊结石病程>5年; (3)B型超声提示胆囊壁局限性增厚;(4)直径>2.0 cm胆固醇型结石;(5)合并有胆囊息肉样,尤其是 腺瘤样息肉;(6)胆囊造瘘、瓷器样胆囊和溃疡性结肠炎。
胆囊原发性鳞状细胞癌的组织学发生目前尚 不明确。徐文漭等[10]推测是由胆囊黏膜中的多潜 能性基底细胞演化而来。崔云龙等[11]认为正常的 胆囊黏膜是单层柱状上皮,因此胆囊鳞癌的出现 很可能是胆囊黏膜首先发生了鳞状化生,而后 又发生了癌变。本病例肿瘤完全由鳞状细胞癌组 成,与癌组织移行的为正常腺上皮,未见鳞化组 织,因此认同肿瘤的发生为由胆囊黏膜中的多潜 能性基底细胞演化而来。
胆囊原发性鳞状细胞癌的预后不佳,诊断后 平均存活时间为6月,大多数不超过5年,5年生 存率为5%[4]。这与本病早期不易诊断以及其生物 学行为有关。国内报告的7例[5, 6, 7, 8, 9, 10, 11]加上本例患者临 床上仅表现为右上腹痛、厌食等消化道症状,无 特异性,术前诊断正确率低,明确诊断时多属晚 期,手术切除率低,预后不良。故提高胆囊癌的 早期诊断率,增加根治性手术切除的机会尤为重 要[6]。术后长期存活者绝大多数属早期病例。目前 普遍主张对胆囊炎、胆石症患者早期手术。这样 对预防胆囊发生癌变有着重要的作用,也可达到 早期发现和早期治疗的目的。但大多数胆囊炎、 胆石症患者并不发生癌变,癌变的依然是极少 数,而且胆囊是一个相对重要的消化器官,因此 探索早期诊断方法仍是提高预后的重要环节[8]。本 病例术后随访半年去世。
| [1] | Mishra KP, Yadav AP, Shweta, et al. Ship-borne journey inducesTh1 cytokines level in antarctic summer expeditioners[J]. Immunol Invest,2010,39(7):770-9. |
| [2] | Kim C, Jay DC, Williams MA. Stability and function of secondaryTh1 memory cells are dependent on the nature of the secondary stimulus[J]. J Immunol,2012,189(5):2348-55. |
| [3] | Nevala WK, Vachon CM, Leontovich AA, et al. Evidence of systemic Th2-driven chronic inflammation in patients with metastatic melanoma[J]. Clin Cancer Res,2009,15(6):1931-9. |
| [4] | Dunham RM, Thapa M, Velazquez VM, et al. Hepatic stellate cells preferentially induce Foxp3+ regulatory T cells by production of retinoic acid[J]. J Immunol,2013,190(5):2009-16. |
| [5] | Savage PA, Malchow S, Leventhal DS. Basic principles of tumorassociated regulatory T cell biology[J]. Trends Immunol,2013,34 (1):33-40. |
| [6] | Geiger TL, Tauro S. Nature and nurture in Foxp3(+) regulatory T cell development, stability, and function[J]. Hum Immunol,2012, 73(3):232-9. |
| [7] | Yang XP, Ghoreschi K, Steward-Tharp SM, et al. Opposing regulation of the locus encoding IL-17 through direct, reciprocal actions of STAT3 and STAT5[J]. Nat Immunol,2011,12(3):247-54. |
| [8] | Bettelli E, Korn T, Oukka M,et al. Induction and effector functions of T(H)17 cells[J]. Nature,2008,453(7198):1051-7. |
| [9] | Liu Z, Fan H, Jiang S. CD4(+)T-cell subsets in transplantation[J]. Immunol Rev,2013,252(1):183-91. |
| [10] | Schmitt E, Bopp T. Amazing IL-9: revealing a new function for an “old” cytokine[J]. J Clin Invest,2012,122(11):3857-9. |
| [11] | Lu Y, Hong S, Li H, et al. Th9 cells promote antitumor immune responses in vivo[J]. J Clin Invest,2012,122(11):4160-71. |
| [12] | Ghayumi MA, Mojtahedi Z, Fattahi MJ. Th1 and th2 cytokine profiles in malignant pleural effusion[J]. Iran J Immunol,2011,8 (4):195-200. |
| [13] | Okamoto M, Hasegawa Y, Hara T, et al. T-helper type 1/T-helper type 2 balance in malignant pleural effusions compared to tuberculous pleural effusions[J]. Chest,2005,128(6):4030-5. |
| [14] | DeLong P, Carroll RG, Henry AC, et al. Regulatory T cells and cytokines in malignant pleural effusions secondary to mesothelioma and carcinoma[J]. Cancer Biol Ther,2005,4(3):342-6. |
| [15] | Yang WB, Ye ZJ, Xiang F, et al. Th17/Treg imbalance in malignant pleural effusion[J]. J Huazhong Univ Sci Technol[Med Sci],2013,33(1):27-32. |
| [16] | Qin XJ, Shi HZ, Liang QL, et al. CD4+CD25+ regulator T lymphocytes in tuberculous pleural effusion[J].Chin Med J(Engl), 2008,121(7):581-6. |
| [17] | Ye ZJ, Zhou Q, Gu YY, et al. Generation and differentiation of IL-17-producing CD4+T cells in malignant pleural effusion[J]. J Immunol,2010,185(10):6348-54. |
| [18] | Ye ZJ, Zhou Q, Zhang JC, et al. CD39+ regulatory T cells suppress generation and differentiation of Th17 cells in human malignant pleural effusion via a LAP-dependent mechanism[J].Respir Res,2011,12:77. |
| [19] | Ye ZJ, Zhou Q, Yin W, et al. Differentiation and immune regulation of IL-9-producing CD4+ T cells in malignant pleural effusion[J].Am J Respir Crit Care Med,2012,186(11):1168-79 |
 2014, Vol.41
2014, Vol.41


