近年来,有学者研究发现肿瘤相关蛋白 (tetraspanin 1,TSPAN1)在人胰腺癌组织中高表达, 提示TSPAN1的异常表达与胰腺癌的发生、发展 密切相关[1],但是,到目前为止,尚没有直接证 据支持这个观点,且胰腺癌组织中TSPAN1蛋白 表达的作用研究国内尚未见报道。为进一步研究 TSPAN1表达在胰腺癌中的作用,本实验首先检测 了TSPAN1的基因和蛋白在人胰腺癌组织与胰腺癌 细胞株中的表达,然后构建TSPAN1干扰RNA表达 载体,经病毒介导转染人高侵袭性的胰腺癌细胞 Bxpc-3,从肿瘤细胞中TSPAN1的表达以及细胞体 外生长增殖能力的变化评价TSPAN1干扰RNA抗胰 腺癌细胞增殖的作用。 1 资料与方法 1.1 资料
收集2009年2月—2011年10月期间在陕西渭南 市中心医院经手术治疗并均经病理证实的人胰腺 癌组织标本,共计12例,设为胰腺癌组;癌旁组 织取自距癌组织边缘0.5 cm区域,切缘经病理证 实未见癌细胞浸润,癌旁正常胰腺组织设为对照 组。12例胰腺癌患者,其中男7例,女5例,均为 第1次手术,平均年龄49岁(21~68岁),术前均未接 受任何放疗化疗等抗肿瘤治疗;TNM 分期(1997 年恶性肿瘤国际临床病期分类):Ⅰ期2例、Ⅱ期4 例、Ⅲ期3例、Ⅳ期3例。各组标本于切除后各取 120 mg,均分成两份,在液氮中冻存备用,分别 用于RT-PCR及免疫印迹分析。其中,TNM 分期为 Ⅳ期的切除标本每例多取一份用于免疫组织化学 检测。
人胰腺癌细胞株Bxpc-3购自上海细胞生物研 究所,细胞培养用DMEM (Dulbecco s' modified eagle medium)、新生牛血清和胰蛋白酶均为Gibco 公司产品;鼠抗人TSPAN1(B-9):sc-376551为 Santa Cruz公司产品,PV9000试剂盒购自北京中杉 金桥有限公司,DAB显色试剂盒购自迈新生物技 术公司,TRIZOL(Invitrogen)购于诺贝生物技术有 限公司,总RNA用反转录试剂盒(Fermentas)由上 海晶美公司提供;鼠抗人GAPDH多克隆抗体、兔 抗鼠IgG、蛋白裂解液、ECL化学发光显色液均购 于碧云天生物技术公司;辣根过氧化物酶(HRP)标 记的兔抗鼠IgG购自诺贝生物技术有限公司(Pierce Biotechnology,美国);干扰RNA购自上海吉凯基 因技术有限公司,慢病毒载体pSuper-retro购自上 海杰美基因技术有限公司。 1.2 方法 1.2.1 细胞培养
人胰腺癌细胞株Bxpc-3 培养选用含有10%新 生牛血清的DMEM,置37℃、100%湿度和5% CO2 培养箱内培养。待胰腺癌Bxpc-3细胞长满培养瓶 底部70%~80%时,消化传代,取对数生长期细胞 用于实验。 1.2.2 免疫印迹法检测胰腺癌中TSPAN1蛋白的表达
在培养第3天用蛋白裂解液0.25%的胰酶消化 Bxpc-3细胞,提取蛋白;收集自患者的胰腺癌及 癌旁组织解冻后置于裂解液中匀浆,常规提取蛋 白、SDS-PAGE凝胶电泳分离蛋白,并将蛋白电 转到NC上,一抗(TSPAN1,效价1:600),4℃孵育 过夜;兔抗鼠IgG(1:2 000)孵育,室温下振摇1 h, ECL试剂盒进行免疫显色,化学发光凝胶成像系 统中曝光,照相。洗脱蛋白,再次按以上步骤进 行检测(一抗为GAPDH,效价1:1 000;二抗为兔 抗鼠,IgG效价1:2 000)。Bio-Rad凝胶成像系统及 软件分析结果,将阳性条带的密度与GAPDH条带 密度的比值作为TSPAN1 蛋白的相对表达量。 1.2.3 免疫组织化学法检测胰腺癌中TSPAN1蛋白的表达
取手术切除的胰腺癌组织,30 μm 冰冻切片, 0.1 mol/L PBS 洗涤5 min × 3次;3%的过氧化氢室温避光孵育30 min,PBS液洗5 min× 3次;2 ml/L正 常羊血清封闭,37 ℃温箱湿盒内孵育20 min;用 滤纸吸干后,一抗1:400 TSPAN1孵育,4℃过夜。 用PBS代替一抗作阴性对照。0.1 mol/ L PBS 液洗5 min × 3次;PVI 37℃孵育30 min,加PV Ⅱ,37℃ 孵育30 min;DAB 室温下避光显色;苏木精对比 染色,常规脱水,透明,封片。电脑图像采图软 件获取免疫组织化学图像。 1.2.4 RT-PCR检测胰腺癌TSPAN1基因的表达
在第1、3天用0.25%的胰酶消化细胞, 提取RNA。胰腺癌及癌旁组织采用TRIZOL 提取RNA,取2μm总RNA用反转录试剂盒 (Fermentas)转录成cDNA,进行RT-PCR 反 应。扩增用到的引物序列,TSPAN1:上游 引物5'-TGGGCTGCTATGGTGCTA-3';下 游引物5'-TGCAGGTTTCATTGGCTGT-3'; 引物扩增片段为345bp;GAPDH:上游引物 5'-AGGCTGTGGGCAAGGTCA-3' ;下游引物5'-C GTCAAAGGTGGAGGAGTGG-3',引物扩增片段 为246 bp。PCR 反应条件为(1) TSPAN1:94℃ 预 热4 min,94℃55 s,56℃50 s,72℃90 s,30 个 循环,72℃10 min,4℃ 保存。(2) GAPDH:94℃ 预热3 min,94℃30 s,58℃30 s,72℃30 s,30 个 循环,72℃10 min,4℃ 保存。扩增产物用1%琼 脂糖凝胶电泳分析,溴化乙锭染色后,Bio-Rad凝 胶成像系统及Labworks软件进行检测和灰度强度 分析,将阳性条带的密度与GAPDH条带密度的比 值作为TSPAN1 mRNA 的相对表达量。 1.2.5 TSPAN1-siRNA的设计合成
根据Neuclpeptide中TSPAN1的编码序列, 按照RNA干扰序列设计原则,利用在线软件设 计(http://RNAiDesigner.invitrogen.com)并合成靶 向沉默TSPAN1的干扰RNA(siRNA)序列5'-CC TCAGCAGTTCCCTCTTT-3',5'-GCCTTGGT- GTACACCACAA-3',5'-GCCTGCCATCAAGAA AGAT-3',5'-CCT-GCCATCAAG- AAAGATT-3', 将选出的序列应用Blast在EST 数据库查询,确认 与其他基因无同源序列。将其克隆至慢病毒载体 pSuper-retro,构建编码TSPAN1 siRNA 的病毒载体 pSuper-retro-TSPAN1。 1.2.6 TSPAN1-siRNA的细胞转染
人胰腺癌细胞株Bxpc-3常规培养,待细胞长满 培养瓶瓶底70%时用2.5 g/L Trypsin-EDTA 消化细胞 传代。按照说明书方法将慢病毒载体转染BxPC-3 细胞。转染48 h后细胞按1∶4传代,将实验分为空 白对照、阴性对照、转染组共3组,其中空白对照 是未转染质粒的Bxpc-3;阴性对照是转染pSuperretro-GFP载体的BxPC-3,即为空载体组;转染组 为转染pSuper-retro-TSPAN1干扰载体的BxPC-3。转 染48 h 后观察细胞无明显异常后进行后续实验。 1.2.7 MTT (噻唑盐比色法) 检测细胞增殖
取1 000个细胞干扰48 h 后每孔加入20 μl MTT 溶液(5 g/L,即0.5% MTT),继续培养4 h。终止 培养,小心吸去孔内培养液,每孔加入150 μl DMSO,使结晶物充分溶解。在490 nm处测量各 孔的A 值,分别以转染时间、A 值为横、纵坐标, 绘制细胞生长曲线。 1.2.8 检测干扰后TSPAN1的表达
接种48 h 后,待细胞完全贴壁并呈指数生长 时,收集各组细胞行RT-PCR和Western blot检测 TSPAN1的表达,具体步骤如前述。 1.3 统计学方法
计量数据以均数±标准差表示,统计分析采用 SPSS13.0 软件来处理。组间比较采用方差分析, 以P< 0. 05表示差异有统计学意义。 2 结果 2.1 TSPAN1在手术标本及胰腺癌细胞株的表达
RT-PCR所得的TSPAN1的基因片段长度为345 bp,与预期目的片段分子质量的大小完全相等。 作为对照的胰腺癌旁组织中检测到少量TSPAN1的 RNA表达(0.31±0.01),而在胰腺癌组织及胰腺癌 细胞株TSPAN1 mRNA 的表达分别为(0.63±0.01)、 (0.58±0.09),高于对照组TSPAN1 mRNA的表达 (0.18±0.01),两组组间比较,差异有统计学意义 (P<0.01),扩增产物电泳结果,见图 1 。
 |
图 1TSPAN1基因在手术标本及胰腺癌细胞株的表达 Figure 1TSPAN1 gene expressions in human pancreatic cancer tissues and Bxpc-3 cells |
Western blot在各胰腺癌组中检测到TSPAN1蛋 白的表达,相对分子量为26 kD,对照组胰腺癌旁 组织中检测到TSPAN1的蛋白表达为(0.18±0.01), 而在胰腺癌组织及胰腺癌细胞株TSPAN1蛋白的表 达分别为(0.54±0.01)、(0.48±0.02),高于对照组中 TSPAN1的表达,两组组间比较,差异有统计学意 义(P<0.01),见图 2 。
 |
图 2 TSPAN1蛋白在手术标本及胰腺癌细胞株的表达 Figure 2 TSPAN1 protein levels in human pancreatic cancer tissues and Bxpc-3 cells |
免疫组织化学染色显示,在癌旁组织中可以 检测到少量的TSPAN1阳性染色细胞,见图 3 A,主 要在胰腺癌组织中表达,着色部位为细胞膜和细 胞质,胞核不着色,见图 3B。
 |
图 3 TSPAN1蛋白在癌旁组织及胰腺癌组织中的免疫组织化学染色( ×400) Figure 3 Immunohistochemistry positive stains of TSPAN1 in human pancreatic cancer adjacent tissues and pancreatic cancer tissues( ×400) |
转染后Bxpc-3 细胞在对数生长期(12~36h) 的 活力受到明显抑制,且在36~72 h之间转染细胞的 增殖仍然被抑制,见图 4。提示在转染后细胞增殖 能力减弱。
 |
图 4 干扰TSPAN1表达对细胞活力的影响 Figure 4Effects of TSPAN1-siRNA on Bxpc-3 cells |
TSPAN1-siRNA转染抑制胰腺癌细胞中 TSPAN1蛋白的表达转染48 h后,RT-PCR检测发现 TSPAN1基因在空白组、阴性对照组和转染组细胞 中均检测到目的条带,在空白组、对照组细胞的TSPAN1 mRNA表达量(0.84±0.11;0.79±0.12) 高于 转染组(0.41±0.03),差异有统计学意义(P=0. 016或 P=0. 0002) ,见图 5。
 |
图 5siRNA转染后TSPAN1基因在各组的表达 Figure 5 TSPAN1 gene expressions in human pancreatic cancer tissues and Bxpc-3 cells after administration with TSPAN1-siRNA |
Western blot检测TSPAN1蛋白表达,发现空白 组、阴性对照组和转染组细胞中均有相对分子质 量约26 kD的TSPAN1蛋白表达,但空白组、对照 组细胞的TSPAN1蛋白表达量较高(0.57±0.06;0.55 ±0.01),而在转染组细胞表达量较低(0.32±0.05), 差异有统计学意义(P=0.024或P=0.004),见图 6。上述结果表明,转染48 h后,转染组的胰腺癌细胞 中TSPAN1蛋白表达受到抑制。
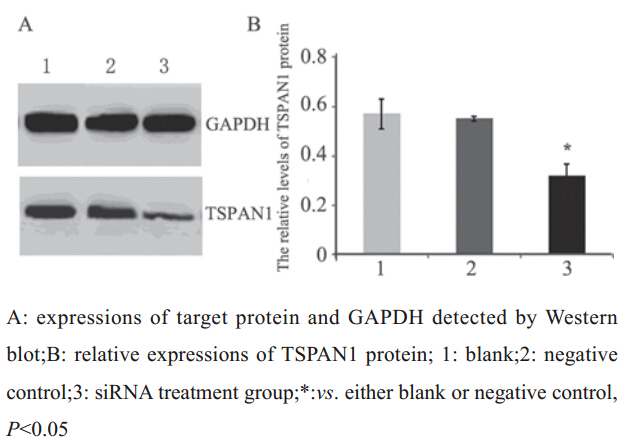 |
图 6 siRNA转染后TSPAN1蛋白在各组的表达 Figure 6 TSPAN1 protein expressions in human pancreatic cancer tissues and Bxpc-3 cells after treatment with TSPAN1-siRNA |
胰腺癌是常见的消化系统恶性肿瘤之一,其 恶性程度高、发病隐匿、病情进展快、预后极 差,近年来其发病率明显增高[2],但是,其远期疗 效和预后并未有突破性进展。明确其发病机制, 针对特定发病环节进行有效干预从而提高疗效已成为研究的热点。 近年来的研究发现,胰腺癌从蛋白质组学的 角度可被认为是一种蛋白质缺陷病,其发生过程 中有多种蛋白会发生异常变化,这种变化包括蛋 白表达量的增加或减少以及蛋白翻译后加工上的 改变[3];研究发现,与正常组织相比,胰腺癌组织 中存在多种表达异常的蛋白,其中就包括肿瘤相 关蛋白TSPAN1[1]。
TSPAN1是四跨膜蛋白超家族新成员,其在 多种肿瘤组织中存在过表达,可能通过转导细胞 分裂信号和引起细胞异向分化或去分化、引起癌 细胞增殖与血管生成等机制,参与癌变和侵袭 转移过程[2]。有实验研究表明与正常组织相比, TSPAN1在胰腺癌组织中呈现高水平的表达[1],但 是目前为止,未见TSPAN1在胰腺癌中具体作用 的相关文献报道。研究表明[4, 5]在宫颈癌及结直肠 癌、肝癌等多种肿瘤组织中均有TSPAN1的过表 达。钱铮等[6]研究发现胃癌组织中TSPAN1呈现高 表达,且与胃癌病理分级、临床分期及预后密切 相关,推测TSPAN1与癌细胞增殖有关。本研究 发现,在胰腺癌组织与胰腺癌细胞株Bxpc-3中均 检测到了高水平表达(包括基因及蛋白表达)的 TSPAN1,且免疫组织化学染色结果显示TSPAN1 定位于肿瘤细胞的细胞质内,提示TSPAN1的异常 表达可能在胰腺癌的发生发展中起到了一定的作 用。为了证实这一推论,接下来,我们通过RNA干 扰技术转染TSPAN1小干扰RNA(small interference RNA,siRNA)入胰腺癌Bxpc-3细胞中[7, 8, 9, 10],并观察 对其细胞恶性生物学行为的影响,结果发现,与 空载体组相比,有效干扰TSPAN1表达后,肿瘤 细胞的活力减弱,增殖能力减弱了。这些结果证 明,干扰TSPAN1的表达抑制了胰腺癌细胞的增 殖,提示沉默TSPAN1 确实能够降低肿瘤细胞恶性 生物学行为。细胞的异常增殖及分化是导致肿瘤 形成的重要原因。因此,我们推测TSPAN1作为细 胞表面蛋白可能通过连接分子内部或者与其他表 面蛋白相互作用,形成跨膜蛋白网络,参与转导 细胞分裂的信号、调控细胞增殖和分化、促进血 管的生成和细胞黏附移行等,从而参与了癌变和 侵袭转移过程。
综上,本研究结果表明TSPAN1在胰腺癌中 的异常过度表达可能与胰腺癌的发生发展相关, 而针对TSPAN1的siRNA能有效抑制体外胰腺癌细 胞中TSPAN1的表达,并抑制细胞增殖,因此, TSPAN1可望作为胰腺癌基因治疗的靶点,本研究 无疑为临床治疗胰腺癌提供了有价值的前期研究 基础,为胰腺癌的治疗开辟了新的途径。
| [1] | Real FX, Villa MR, Skoudy A, et al. Intermediate filaments as differentiation markers of exocrine pancreas. II. Expression of cytokeratins of complex and stratified epithelia in normal pancreas and in pancreas cancer[J]. Int J Cancer,1993,54(5):720-7. |
| [2] | Serru V, Dessen P, Boucheix C,et al. Sequence and expression of seven new tetraspans[J]. Biochim Biophys Acta,2000,1478(1):159-63. |
| [3] | Qu Y, Adam BL, Yasui Y,et al. Boosted decision tree analysis of surface-enhanced laser desorption/ionization mass spectral serum profiles discriminates prostate cancer from noncancer patients[J]. Clin Chem,2002,48(10):1835-43. |
| [4] | Wollscheid V, Kuhne-Heid R, Stein I. Identification of a new proliferation- associated protein NET-1/C4. 8 characteristic for a subset of high-grade cervical intraepithelial neoplasia and cervical carcinomas[J]. Int J Cancer,2002,99(6):771-5. |
| [5] | Chen L, Wang Z, Zhan X, et al. Association of NET-1 gene expression with human hepatocellular carcinoma[J]. Int J Surg Pathol,2007,15(4):346-53. |
| [6] | Qian Z, Cheng L, Wang GL,et al. Overexpression of NET-1 and Ki-67 and their significance in gastric carcinomas[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi,2008,24(3):305-8. [钱铮,陈莉, 王桂兰, 等. 胃癌NET-1、Ki-67表达及意义[J]. 临床与实验病理 学杂志,2008,24(3):305-8.] |
| [7] | Yuan W, Wu S, Guo J, et al. Silencing of TKTL1 by siRNA inhibits proliferation of human gastric cancer cells in vitro and in vivo[J]. Cancer Biol Ther,2010,9(9):710-6. |
| [8] | Yu FJ, Dong PH, Fan XF, et al.Down-regulation of angiotensin II by shRNA reduces collagen synthesis in hepatic stellate cells[J]. Int J Mol Med,2010,25(5):801-6. |
| [9] | Dong P, Yu F, Fan X, et al. Inhibition of ATIR by shRNA prevents collagen synthesis in hepatic stellate cells[J]. Mol Cell Biochem, 2010,344(1-4):195-202. |
| [10] | Zhang HF, Zhou GX. The usage of siRNA in pancreas cancer researches[J]. Jiao Tong Yi Xue,2007,21(4):374-6. [张海峰, 周国雄. siRNA技术在胰腺癌研究中的应用[J]. 交通医 学,2007,21(4):374-6.] |
 2014, Vol.41
2014, Vol.41

