2.河北医科大学第四医院放疗一病区;
3.承德市中心医院放化疗中心
2.Department of Radiation Oncology, The Fourth Hospital of Hebei Medical University;
3.Department of Chemoradiation Oncology, The Central Hospital of Chengde Cit
直肠癌是较为常见的恶性肿瘤,手术是直肠 癌的主要治疗手段。尽管外科技术不断进步,其 5年生存率仍徘徊于50%,治疗失败的原因主要为 局部复发和远处转移。多年来实践证明,局部晚 期直肠癌术后新辅助放化疗和辅助放化疗均是直 肠癌综合治疗的标准手段,以新辅助治疗模式为 最佳[1],但就国内治疗而言,辅助放化疗应用更 为常见。术后辅助放化疗的目的主要是提高生存 率、降低复发率。早期研究证实[2, 3, 4]与术后化疗相 比,术后辅助放化疗可降低局部复发率,但是否 能提高生存率结论尚不统一,不良反应亦较重。 目前关于直肠癌术后放化疗的经典研究方案在普 通放射治疗基础上进行的,而有关精确放疗技术 联合化疗在直肠癌术后的辅助治疗价值报道较为 少见。本研究回顾性分析226例直肠癌术后三维适 形/调强放疗联合化疗与单纯术后化疗对局部复发 率、总生存率(OS)和无病生存率(DFS)的影 响,并进行亚组分析,同时观察三维适形/调强放 疗技术进行盆腔预防性照射的不良反应。 1 资料与方法 1.1 临床资料
收集2006年6月—2010年12月于河北医科大学 第四医院行直肠癌根治术患者226例。术后放化 疗组110例、术后化疗组116例;年龄范围为22~84 岁,中位年龄58岁;直肠癌类型:腺癌218例、印 戒细胞癌4例、鳞癌2例、腺鳞癌1例、小细胞癌1 例;余临床资料,见表1。
|
|
表1 直肠癌术后放化疗与术后化疗病理临床资料比较 Table 1 Comparison of clinicopathologic data between postoperative chemoradiotherapy and chemotherapy in rectal cancer |
(1)手术治疗:所有患者均行根治性手术 治疗,其中腹、会阴联合直肠切除术(Miles术)74 例、经腹直肠切除吻合术(Dixon术)152例。(2) 放射治疗:射野靶区包括直肠癌术后瘤床、直肠 周围系膜、骶前、部分髂总、骶3水平以上髂内、 髂外血管、闭孔、坐骨直肠窝淋巴引流预防区。 采用三维适形放疗88例、调强放疗22例。剂量范 围45~54 Gy,中位剂量50 Gy。(3)化疗方案: 全组患者化疗周期数为2~8周期,中位4周期。191 例患者采用FOLFOX方案化疗、24例患者行LF方 案化疗、11例患者采用单药卡培他滨口服化疗。 1.3 不良反应评价标准
本研究不良反应的评价标准采用常用药物毒 性标准CTC3.0版。 1.4 随访
随访时间从手术当天开始,至2011年9月1日 截止,中位随访时间30月。总生存时间(overall survival,OS)定义为从手术之日起至死亡或 末次随访的时间;无病生存时间(disease free survival,DFS)定义为从手术当日起至肿瘤复 发、转移或因肿瘤因素而死亡的时间;局部区域 复发时间定义为手术当日至肿瘤在盆腔内复发和 (或)盆腔淋巴结转移的时间;远处转移时间定义为 手术当日至盆腔以外的脏器或淋巴结出现新病灶 的时间。 1.5 统计学方法
采用SPSS17.0统计软件进行分析,组间构成 比的比较采用χ2检验;患者局部复发率、OS及DFS 分析用Kaplan-Meier方法进行;组间差异用Log rank检验;以P<0.05为差异有统计学意义。 2 结果 2.1 全组治疗情况
全组患者1、2、3年局部复发率和远处转移 率分别为9.8%、20.7%、22.8%和15.2%、31.2% 39.4%。1、2、3年总生存率(OS)和无病生存率 (DFS)分别为94.4%、71.7%、61.5%和78.8%、 59.8%、53.1%。 2.2 不同辅助治疗方式对局部复发率、OS及DFS的影响
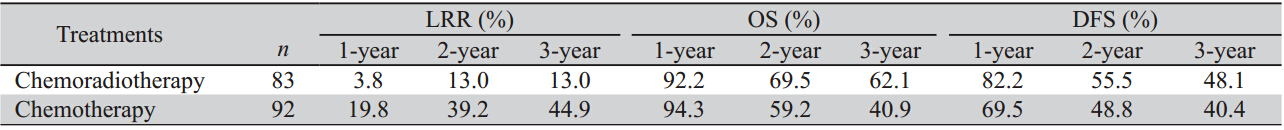
术后放化组1、2、3年局部复发率分别为 3.8%、10.5%、10.5%,明显低于术后化疗组 (15.5%、29.7%、33.2%)差异有统计学意义 (χ2=11.213,P=0.001)。术后放化组与术后化 疗组1、2、3年OS分别为94.2%、76%、70.7%和 95.6%、68.4%、53.5%,组间差异接近统计学意义 (χ2=3.579,P=0.059),术后放化组有延长OS的 趋势。1、2、3年DFS分别为81.9%、60%、54.1% 和76%、59.2%、52.3%,组间比较差异均无统计 学意义(χ2=0.263,P=0.608),见图 1。
 |
图 1不同辅助治疗方式的局部复发率、OS和DFS Figure 1 Local recurrence rate ,OS and DFS of different adjuvant treatment |
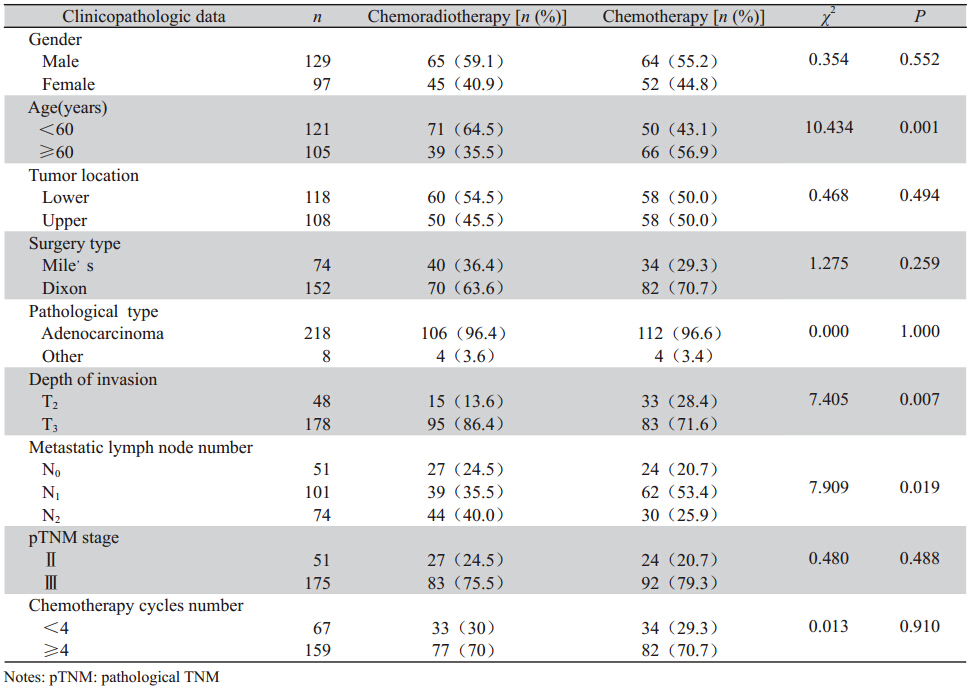
2.3.1 同步放化组和序贯放化组的局部复发率、OS、DFS比较
110例术后放化疗患者中,采用同步放化疗者 48例、序贯放化疗者62例。研究显示同步放化组和序贯放化组1、2、3年局部复发率、OS、DFS差异 均无统计学意义(χ2=0.000,P=0.992;χ2=1.596, P=0.207;χ2=0.230,P=0.631),见表2。
|
|
表2 同步放化组和序贯放化组的1、2、3年局部复发率、OS和DFS Table 21-,2-,3-year local recurrence rate,OS and DFS of concurrent chemoradiotherapy and sequential chemoradiotherapy |
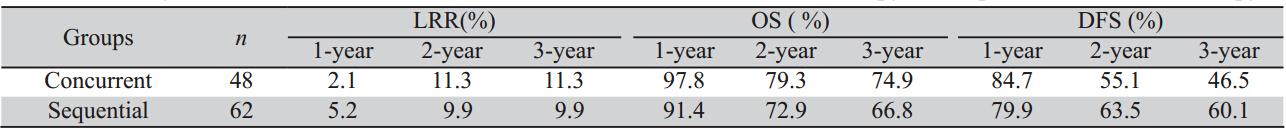
将术后放化组的手术与放疗间隔时间分为≤30 天(26例)、31~60天(36例)、>60天(48例)三组, 结果显示:不同时间间隔组1、2、3年局部复发率、 OS、DFS差异均无统计学意义(χ2=1.170,P=0.557; χ2=3.831,P=0.147;χ2=4.051,P=0.132),见表3。
|
|
表3 手术与放疗间隔的1、2、3年局部复发率、OS、DFS Table 31-,2-,3-year local recurrence rate,OS and DFS of Surgery and radiotherapy interval |
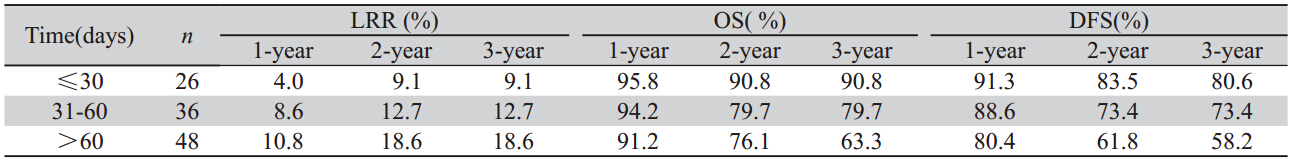
Ⅱ期患者共51例,其中术后放化组27例,仅 1例局部复发;术后化疗组24例,无局部复发病 例,故未对局部复发率进行统计学分析。研究显 示术后放化组和术后化疗组1、2、3年OS、DFS 差异均无统计学意义(χ2=0.058,P=0.810;χ2=3.356,P=0.067),见表4。
|
|
表4 Ⅱ期患者不同辅助治疗方式的OS及DFS Table 4OS and DFS of different adjuvant treatment on stage Ⅱpatients |
Ⅲ期患者术后放化组1、2、3年局部复发率分 别为3.8%、13%、13%,明显低于术后化疗组的 19.8%、39.2%、44.9%(χ2=13.230,P=0.000)。 术后放化组的1、2、3年OS高于术后化疗组,差 异有统计学意义(χ2=3.875,P=0.047)。术后 放化组1、2、3年DFS与术后化疗组差异不明显 (χ2=1.632,P=0.201),见图 2、表5。
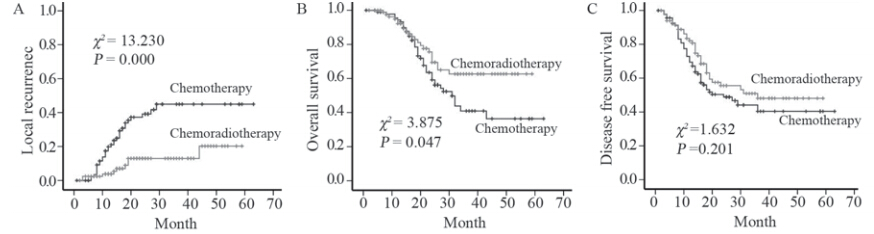 |
图 2Ⅲ期患者不同辅助治疗方式的局部复发率、OS和DFS Figure 2LRR,OS and DFS of different adjuvant treatment on stage Ⅲ patients |
|
|
表5 Ⅲ期患者不同辅助治疗方式的局部复发率、OS及DFS Table 5Local recurrence rate,OS and DFS of different adjuvant treatment on stage Ⅲpatients |
全组59.3%患者出现1~2级胃肠道不良反应, 46.9%患者出现1~2级血液学不良反应,无3级及 以上胃肠道及血液学不良反应发生。术后放化组 的胃肠道、血液学不良反应发生率分别为78.2% 和64.5%,明显高于术后化疗组(41.4%和30.2%) (χ2=31.683,P=0.000;χ2=26.786,P=0.000)。术后放化组中,20.9%患者出现放射性肠炎,1级占 11.8%、2级占9.1%;10%患者出现放射性膀胱炎,1 级占8.2%、2级占1.8%。无3级以上不良反应发生。 3 讨论
直肠癌的治疗以手术为主,术后放化疗较术 后化疗能进一步降低局部复发率,但是否使生存 获益仍无统一观点。NSABP R-02[4]报道694例直 肠癌术后辅助治疗疗效,发现术后放化组的5年 局部复发率为8%,明显低于术后化疗组的13% (P=0.02),但两组5年OS、DFS差异无统计学意 义(P=0.89,P=0.90)。周毅等[5]研究132例Duck's C期直肠癌患者,术后同步放化组的5年局控率及 OS分别为91.67%和47.44%,明显高于术后化疗组 的77.78%和29.63%。随着放射治疗技术的进展, Ⅱ、Ⅲ期患者采用三维适形或调强放疗等精确放 疗技术,与常规照射相比在提高局控率的同时是 否能进一步减少不良反应并提高生存状况,哪些 患者是辅助放化疗的最佳获益人群等较少有文献 报道。本组研究显示术后放化组1、2、3年局部复 发率分别为3.8%、10.5%、10.5%,明显低于术后 化疗组(15.5%、29.7%、33.2%)(χ2=11.213, P=0.001),充分显示出术后精确放疗联合化疗对 降低局部复发率的重要贡献,并已使Ⅲ期患者总 生存获益(P=0.047),术后放化疗是直肠癌综 合治疗的标准治疗方案之一,其价值是充分肯定 的。
术后同步放化疗可提高局控率及改善晚期患 者预后,但术后同步放化疗是否优于序贯放化 疗目前尚未达成共识。陆忠华等[6]报道Ⅱ、Ⅲ期 直肠癌根治术后放疗联合希罗达同步化疗的疗 效,术后同步放化组(32例)5年局部复发率为 6.25%,明显低于序贯放化组(31.25%,48例) (P=0.007),但两组5年生存率相似(62.5% vs. 54.2%,P=0.077)。陈光烈[7]报道68例同步放化疗 与序贯放化疗对Ⅱ、Ⅲ期直肠癌术后患者局控率 和生存率的影响,两组1、2、3年生存率及局控率 均无差别。本组研究亦未显示出同步放化疗与序 贯放化疗在局部复发率、OS和DFS之间的差异, 但研究病例数较少,其放化综合治疗以何种治疗 模式为最佳仍需期待更多的研究结果进一步证 实。
有关手术与放疗间隔时间有韩国Lee等[8]报 道,其中早放疗组(术后≤5周)局部复发率为 14.8%,低于晚放疗组(术后9~15周)为24.8%, 但对OS无影响。上述研究在随访10年以后,早放 疗组对局部控制率的优势逐渐减弱,10年后两组 在OS、DFS及局部复发率差异均无统计学意义[9]。 因此2010年直肠癌NCCN指南建议,对于术后放化 疗开始时间,总体原则是尽早开始。对于经腹会 阴联合切除术(APR)者,鉴于术后会阴部伤口 愈合较慢,可按以往2疗程化疗后开始放化疗;对 于行低位前切术(LAR)者,可参照韩国随机研 究在术后4周。本研究结果发现三组局部复发率及 OS、DFS差异虽无统计学意义,但总体30天内接 受放疗的患者局部复发率较低,OS及DFS数值较 高,差异无统计学意义,主要考虑与病例数较少、 随访时间尚短有关。
肿瘤患者的治疗强调个体化,T3N0M0的直肠 癌患者是否需辅助治疗及应行何种辅助治疗仍存 在争议。Gunderson等[10]综述了5项大型Ⅲ期临床 研究,Ⅱ期直肠癌术后放化疗与术后化疗生存率 无差异,5年局部复发率波动于9%~13%之间。刘 振洋等[11]报道257例Ⅱa直肠癌根治术后不同治疗 方法的疗效比较,术后放疗组和放化疗组1、3、5 年局部复发率显著低于单纯手术和术后化疗组, 但四组的生存率差异无统计学意义。本研究中术 后化疗与术后放化疗两种治疗方式对Ⅱa期患者OS 及DFS差异均无统计学意义,进一步分析发现本组 患者术后病理切缘均为阴性,无脉管受侵,属于 NCCN2010年关于直肠癌诊治标准中提出的具有良 好预后因素的患者,由于此类患者局部复发率低, 放疗的额外获益有限,可考虑采用术后化疗的辅助 治疗模式,术后辅助放化疗似乎获益不甚明显。
Huh等[12]研究比较Ⅲ期直肠癌术后放化疗与术 后化疗的疗效,两组5年局控率(92% vs. 86%)、 OS(63% vs. 68%)及DFS(55% vs. 57%)差异 均无统计学意义,但该研究中术后放化组肿瘤T分 期晚及周围神经受侵的患者高于术后化疗组,由 于患者入组基线条件不同,可能会对结果造成影 响。目前国外直肠癌关于术后辅助放化疗研究的 报道放疗均采用普通照射方式,放疗靶区涵盖率 低,而本研究中由于均行三维适形放疗或调强放 疗,精确放疗技术可使局控率的优势得到充分体 现,术后放化疗显著降低了局部复发率,在本研 究中显示出在一定程度上转化为对Ⅲ期直肠癌患 者总生存的提高。
直肠癌术后放化疗是综合治疗的标准手段之 一,但普通外照射联合化疗不良反应相对较大,一 般以放射性皮炎、胃肠道、膀胱炎及血液学不良反应为主,文献报道3级以上的不良反应发生率高达 10%~54%[13, 14, 15, 16, 17]。Bagatzounis等[16]报道直肠癌术后放 化疗26%患者出现3级以上腹泻,25%患者出现3级 以上白细胞下降。Baglan等[17]报道40例直肠癌术后 放化疗患者,发生1级放射性肠炎占37.5%、2级占 20%、3级占25%。本研究中20.9%患者出现放射性 肠炎,1级占11.8%、2级占9.1%;10%患者出现放 射性膀胱炎,1级占8.2%、2级占1.8%,发生概率和 程度明显低于国外文献报道,考虑国外早期临床研 究中多采用普通放疗,靶区范围较大,周围正常组 织保护差,不良反应较高所致。虽然本研究放化疗 组不良反应明显高于术后化疗组,但亦无3级以上 不良反应的出现,且放疗导致的放射性肠炎及放射 性膀胱炎的发生率也明显低于上述报道,说明三维 适形或调强放疗技术,不仅照射范围精确,靶区剂 量分布较常规放疗更加合理,对危及器官膀胱、小 肠等保护作用亦较好。
综上所述,本研究显示直肠癌术后有辅助放 化疗指征的Ⅲ期直肠癌患者,采用三维适形/调强 放疗等精确放疗技术联合化疗综合治疗后,在显 著提高局部疗效的同时,可提高生存率。放化联 合治疗组血液学及胃肠道不良反应高于术后单纯 化疗组,但患者耐受性较好。盆腔照射采用三维 适形或调强放疗技术较常规放疗能显著降低放射 性膀胱炎和放射性肠炎的发生率和发生程度。
| [1] | Sauer R, Becker H, Hohenberger W, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer[J]. N Engl J Med, 2004, 351:1731-40. |
| [2] | Thomas PR, Lindblad AS. Adjuvant postoperative radiotherapy and chemotherapy in rectal carcinoma: a review of the gastrointestinal tumor study group experience [J]. Radiother Oncol, 1988, 13(4):245-52. |
| [3] | Krook JE, Moertel CG, Gunderson LL, et al. Effective surgical adjuvant therapy for high-risk rectal carcinoma[J]. N Engl J Med, 1991, 324(11):709-15. |
| [4] | Wolmark N, Wieand HS, Hyams DM, et al. Randomized trial of postoperative adjuvant chemotherapy with or without radiotherapy for carcinoma of the rectum: national surgical adjuvant breast and bowel project protocol R-02[J]. J Natl Cancer Inst, 2000, 92(5):388-96. |
| [5] | Zhou Y,Wang FW,Zhang XP, et al. Effect of concurrent chemoradiotherapy and single chemotherapy in rectal cancer patients after Miles, operation[J]. Ai Zheng Jin Zhan Za Zhi, 2007, 5(5):489-91.[周毅,王凤玮,张锡朋,等.直肠癌Miles术后放化疗 同步与单纯化疗效果分析[J].癌症进展杂志,2007,5(5):489-91.] |
| [6] | Lu ZH, Wang JH, Xu XY, et al.Efficacy of postoperative concurrent radiotherapy and chemotherapy with xeloda for stage Ⅱ/Ⅲ rectal cancer[J]. Shi Jie Hua Ren Xiao Hua Za Zhi,2009,17(32): 3351-4.[陆忠华,王建华,许锡元,等.Ⅱ、Ⅲ期直肠癌根治术后放 疗同步希罗达化疗的疗效[J].世界华人消化杂志,2009,17(32): 3351-4.] |
| [7] | Chen GL. Affect of postoperative concurrent chemoradiotherapy versus sequential chemoradiotherapy to local control rate and survival rate in rectal cancer[J].Dang Dai Yi Xue, 2012, 18(2):265.[陈光烈. 同步放化疗与序贯放化疗对直肠癌术后患 者局部控制率和生存率的影响[J]. 当代医学, 2012, 18(2):265.] |
| [8] | Lee JH, Ahn JH, Bahng H, et al. Randomized trial of postoperative adjuvant therapy in stage Ⅱand Ⅲ rectal cancer to define the optimal sequence of chemotherapy and radiotherapy: a preliminary report[J]. J Clin Oncol, 2002, 20(7):1751-8. |
| [9] | Kim TW, Lee JH, Lee JH, et al. Randomized trial of postoperative adjuvant therapy in Stage Ⅱand Ⅲrectal cancer to define the optimal sequence of chemotherapy and radiotherapy: 10-year follow-up[J]. Int J Radiat Oncol Biol Phys, 2011, 81(4):1025-31. |
| [10] | Gunderson LL, Sargent DJ, Tepper JE, et al. Impact of T and N stage and treatment on survival and relapse in adjuvant rectal cancer: a Pooled analysis[J]. J Clin Oncol, 2004, 22(10):1785-96. |
| [11] | Liu ZY,Hu Y, Zhou HJ, et al. Comparison among different treatments in 257 cases of stage Ⅱa rectal cancer[J].Yi Xue Lin Chuang Yan Jiu, 2009, 26(7):1238-40.[刘振洋, 胡英, 周慧俊, 等. 257例Ⅱa期直肠癌根治术后不同治疗方法的疗效比较[J]. 医学 临床研究, 2009, 26(7):1238-40.] |
| [12] | Huh JW, Lim SW, Kim HR, et al. Effects of postoperative Adjuvant Radiotherapy on Recurrence and Survival in Stage Ⅲ Rectal Cancer[J]. J Gastrointst Surg, 2011, 15(6):963-70. |
| [13] | Hetna?M,Ma?ecki K,Korzeniowski S. Postoperative adjuvant chemoradiotherapy in patients with rectal cancer.Prognostic factors for locoregional control and survival[J]. Rep Pract Oncol Radiother, 2006,11(4): 175-82. |
| [14] | Chung YL, Jian JJ, Cheng SH, et al. Extended-field radiotherapy and high-dose-rate brachytherapy with concurrent and adjuvant cisplatin-based chemotherapy for locally advanced cervical cancer: a Phase I/II study[J]. Gynecol Oncol, 2005, 97 (1):126-35. |
| [15] | Martenson JA Jr, Willett CG, Sargent DJ, et al. Phase Ⅲstudy of adjuvant chemotherapy and Radiation therapy compared with chemotherapy alone in the surgical adjuvant treatment of colon cancer: results of intergroup protocol 0130[J]. J Clin Oncol, 2004, 22(16):3277-83. |
| [16] | Bagatzounis A, Willner J, Oppitz U, et al. The postoperative adjuvant radiation therapy and radiochemotherapy for UICC stage Ⅱand Ⅲrectal cancer.a retrospective analysis[J]. Strahlenther Onkol, 2000, 176(3): 112-7. |
| [17] | Baglan KL, Frazier RC, Yan D,et al. The dose-volume relationship of acute small bowel toxicity from concurrent 5-Fu based chemotherapy and radiation therapy for rectal cancer[J]. Int J Radiat Oncol Biol Phys, 2002, 52(1):176-83. |
 2014, Vol.41
2014, Vol.41