2.安徽医科大学第三附属医院胸心外科
2.Department of Cardiothoracic Surgery, The Third Affiliated Hospital of Anhui Medical University
中国是食管癌高发国家,手术仍是治疗食管 癌的主要治疗手段,但是局部晚期食管癌的单纯 手术预后不尽人意,5年生存率仅为20%左右,多 数患者在手术后的3年内出现局部复发或转移[1, 2]。 这促使医务人员在治疗中加入放、化疗以提高疗 效,为此2009年5月—2012年7月我们开展了新辅 助放化疗联合手术及单纯手术治疗局部晚期食管 癌的随机对照研究,现将结果汇报如下。 1 资料及方法 1.1 入组条件
(1) 胸段食管癌,初次治疗;(2)年龄≤70岁, ECOG评分<3 ;(3)按1997年UICC食管癌分期标 准分为ⅡA~Ⅲ期、无远处转移;(4) 无食管穿孔 及穿孔前征象;(5)血常规、肝肾功能检查正常或 者基本正常,无严重内科疾病;(6)患者本人及家 属知情同意。 1.2 一般资料
ⅡA~Ⅲ期食管癌患者80例,其中男64例, 女16例;年龄38~67岁,平均年龄(54.75±8.68) 岁,中位年龄55岁;PS评分0分27例、1分39例、 2分14例;全部病例均经病理证实,其中鳞状细胞 癌70例、腺癌10例;ⅡA期患者2例、ⅡB期患者 10例、Ⅲ期68例,见表1。
|
|
表1 新辅助放化疗联合手术组和单纯手术组患者一般资料比较 Table 1 General information of patients in neoadjuvant mCRT plus surgery group and surgery group |
放射源:6MV X线。靶区勾画:真空体膜固 定,增强CT模拟定位,Impac Mosaig1.6软件行治 疗计划设计。靶区勾画由1位住院医师及1位主任 医师共同勾画,根据食管钡餐造影及CT横断图像 勾画出GTV,GTV 包括可见肿瘤及纵隔转移淋巴 结;CTV包括GTV及其周围亚临床灶和高危的淋 巴引流区,上下两端外放2~3 cm,PTV为CTV 周 围外放0.5~1 cm。照射技术:采用三维适形放疗技 术,一般设3~5 个适形野,每次2. 0 Gy,5次/周, 总剂量40 Gy/20 fx。化疗方案和周期:采用PF方案 化疗,具体剂量为:DDP(顺铂)75 mg/ (m2·d) d1,5-Fu (氟尿嘧啶)500 mg/ (m2·d),d1~5持续 滴注,第1次化疗与第1次放疗同一天实施,每3周 为1个疗程,放疗期间共用2疗程,放疗结束后4周 行食管癌根治术。 1.4 不良反应评价标准
不良反应评价标准为NCI毒性分级标准3.0版[3] 。 1.5 统计学方法
所有数据用SPSS15. 0软件分析处理,计数资 料采用χ2检验、Fisher's精确检验,生存分析采用 Kaplan-Meier法,组间比较行Log rank检验。 2 结果 2. 1 治疗及随访
总共入组82人,新辅助放化疗联合手术组42 人,单纯手术组40人,其中新辅助放化疗组1人新 辅助放化疗后肿瘤完全退缩,临床评价CR,拒绝 再行手术治疗,予以退出试验。1例患者化疗后出 现Ⅵ度消化道反应,表现为剧烈呕吐,要求退出 试验,直接行手术治疗。实际80人完成试验及随 访,入组新辅助放化疗联合手术组患者按计划完 成同步放化疗,休息4周后行食管癌根治术,单纯 手术组均按计划完成食管癌根治手术。所有患者 均在治疗结束后每3月随访1次,2年后每半年随访 1次。随访复查食管钡餐、胸部增强CT、腹部超 声、血常规及血生化。其中有3例1年后没有按时 随访,故电话随访,记录患者主观症状及生存状 况,随访截至2012年10月1日,全组随访5.2~40.23 月,平均22.8月,中位23.5月。 2.2 新辅助放化疗不良反应
放射性食管炎1级9例、2级26例、3级5例;放 射性肺炎1级4例;血液学毒性1级7例、2级14例、 3级4例,无发热性粒细胞减少;1级恶心10例、2 级6例,无3级恶心;1级呕吐6例、2级4例,无3级 呕吐;1级腹泻3例、2级腹泻2例、无3级腹泻,所 有患者均能耐受新辅助放化疗的不良反应。 2.3 手术并发症
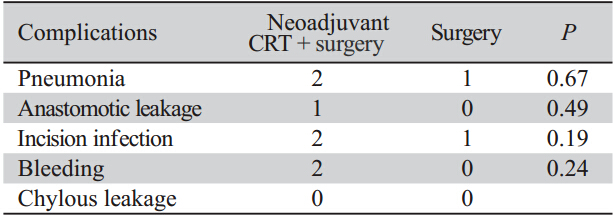
新辅助放化疗联合手术组术后并发症发生率 高于单纯手术组,但是两组之间差异无统计学意 义,见表2。新辅助放化疗联合手术组吻合口漏及 出血分别为1例和2例,而单纯手术组则未发生这2 项并发症,出现吻合口漏的患者于6月内死亡。肺炎及切口感染的发生率也较单纯手术组增加,两 组患者均未发生乳糜胸。
|
|
表2 新辅助放化疗联合手术组和单纯手术组术后并发症比较 Table 2 Postoperative complications in neoadjuvantCRT plus surgery group and surgery group |
新辅助放化疗联合手术R0(完整切除)切除 为38例(95%)、R1(镜下切缘见癌细胞)或R2 (肉眼切缘见癌细胞)切除为2例(5%);单纯手 术组R0切除为31例(82.5%)、R1或R2切除为9例 (17.5%)。新辅助放化疗联合手术可以提高局部 晚期食管癌的R0切除率,与单纯手术相比,差异有 统计学意义(P=0.048)。从治疗失败模式可以看 出,新辅助放化疗联合手术组可以明显降低局部复 发及远处转移,目前随访结果新辅助放化疗联合手 术组未见单纯局部复发,远处转移为9例,局部复 发伴有远处转移为4例。单纯手术组局部治疗失败 为4例,远处转移为14例,局部复发伴远处转移为6 例。新辅助放化疗联合手术降低术后复发,两组之 间差异有统计学意义(P=0.025),见表3。
|
|
表3 新辅助放化疗联合手术组和单纯手术组术后切缘及治疗失败模式比较[n(%)] Table 3 Surgical margin and failure modes of neoadjuvent CRT plus surgery group and surgery group[n(%)] |
1、2、3年生存率新辅助放化疗组联合手术分 别为87.5%、71.5%、53.7%,单放手术组的分别为 85%、46.4%、34.8%(χ2=5.176,P=0.023),两组的生存率曲线见图 1。
 |
图 1新辅助放化疗联合手术组和单纯手术组生存率比较 Figure 1 Survival rates of neoadjuvant CRT plus surgery group and surgery |
新辅助放化疗的理论基础为:(1)放化疗有 协同作用,治疗强度更大;(2)降低肿瘤分期, 提高R0切除率;(3)化疗药物能改变细胞周期分 布、直接作用于乏氧细胞,从而提高肿瘤的杀灭 效应;(4)早期、足量给予化疗,杀灭微小转移 灶,降低部分远处转移。新辅助放化疗后的肿瘤 细胞改变包括:肿瘤细胞空泡增加,细胞核有异 型性,但是无有丝分裂活动,肿瘤细胞多裂解, 成短线状或管状在纤维化间质里排列,有的甚至 看不见肿瘤细胞,达病理完全缓解。
2007年Lancet Oncology[4]的一篇荟萃分析包含 了129名患者10项随机对照研究,结果表明:新辅 助放化疗提高了局部晚期食管癌患者生存率,且 不增加手术死亡率,R0切除率增加,2年生存率 绝对获益为13%。2011年该杂志的另一篇荟萃分 析包含12个随机对照研究,患者总数为1 854名, 与单纯手术相比,联合新辅助放化疗,能够降低 22%的死亡风险,其中鳞状细胞癌降低20%,腺癌 降低25%[5]。本研究显示新辅助放化疗联合手术与 单纯手术组术后1、2、3年生存率分别为87.5%、 71.5%、53.7%和85%、46.4%、34.8%,局部复 发率及远处转移率较单纯手术组明显降低,这表 明新辅助放化疗联合手术治疗局部晚期食管癌能 够改善患者的生存率,虽然患者术后并发症有增 加趋势,但是与单纯手术组之间差异无统计学意 义。安丰山等[6]的研究也显示:新辅助放化疗联 合手术组和单纯手术治疗组根治性切除率分别为 85.4%和65.3%;局部区域复发率分别为34.8%和 58.7%,而手术后的并发症发生率两组无明显差异,新辅助放化疗后获得缓解的患者5年生存率最 高达56.5%,故新辅助放化疗能降低局部和区域复 发率,提高患者长期生存率;提高根治性手术切 除率,并不增加手术并发症。新辅助放化疗R0切 除率达95%,而单纯手术组R0切除率为82.5%, 新辅助放化疗联合手术提高了肿瘤切除率。两项 Meta分析显示新辅助放化疗可以增加pCR、R0 切除率,杀灭潜在的淋巴结转移,提高肿瘤局控 率,降低淋巴结复发率,最终将转化为总生存的 获益[7, 8]。
本研究把颈段食管癌排除在外,因为颈段食 管首选根治性同期放化疗,很少行手术治疗。Ⅰ期 食管癌单纯手术已经有很好的疗效,无需术前辅 助治疗,所以我们亦将这部分患者排除在外。最 新的研究也显示,新辅助放化疗并不能提高Ⅰ期 食管癌患者的生存率,而且有增加手术死亡率的可 能[9]。
虽然新辅助放化疗联合手术治疗局部食管癌 在多项Ⅱ期临床研究中显示出令人鼓舞的生存结 果,但是Ⅲ期临床研究的结果并不一致,基于多 项Meta分析显示综合治疗获得了生存优势,因此 新辅助放化疗联合手术仍是一个主流研究方向, 在以下几点可以做更多的研究:(1)最佳化疗 方案与最佳用药剂量均未明确,目前研究显示紫 杉醇、多西他赛、长春瑞滨等第三代化疗药物联 合顺铂可以进一步提高食管癌化疗效果,但是与 放疗联合应用在新辅助治疗中的作用尚不清楚, 需要进一步研究,目前国外也有研究探讨新辅助 放化疗联合靶向药物治疗可行性,国内目前尚无 此方面数据。(2)新辅助放化疗能够改善部分局 部晚期食管癌患者的预后,在治疗前预测治疗效 应,筛选出潜在获益人群,避免过度治疗。
| [1] | Campbell NP, Villaflor VM. Neoadjuvant treatment of esophageal cancer[J]. World J Gastroenterol,2010,16(30): 3793-803. |
| [2] | Ping YM, Zhang YD, Du XQ, et al.Experience in the treatment of esophageal and cardiac carcinoma in 20000 cases of esophageal cancer surgery[C]// China's first international conference and the Seventh National Conference on esophageal cancer. Zhengzhou: China academic journal (cd-rom version) electronic magazine, 2005: 167-71. [平育敏,张毓德,杜喜群,等. 食管癌和贲门 癌20000例外科治疗经验[C]//中国首届国际食管癌学术会议暨 第七届全国食管癌学术会议论文集. 郑州:中国学术期刊(光 盘版)电子杂志社,2005:167-71.] |
| [3] | Trotti A,Coleves AD,Setser A, et al. CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment[J]. Semin Radiat Oncol,2003,13(3):176-81. |
| [4] | Gebski V,Burmeister B, Smithers BM, et al. Survival benefits from neoadjuvant chemoradiotherapy or chemotherapy in oesophageal carcinoma: a meta-analysis[J]. Lancet Oncol,2007,8(3):226-34. |
| [5] | Sjoquist KM, Burmeister BH, Smithers BM, et al. Survival after neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal carcinoma: an updated meta-analysis[J]. Lancet Oncol, 2011,12(7):681-92. |
| [6] | An FS, Huang JQ, Xie YT, et al.A prospective study of combined chemoradiotherapy followed by surgery in the treatment of esophageal carcinoma[J]. Zhonghua Zhong Liu Za Zhi,2003,25(4):376-9. [安丰山, 黄金球, 谢映涛, 等. 食管 癌新辅助放化疗的前瞻性临床研究[J]. 中华肿瘤杂志, 2003,25(4):376-9.] |
| [7] | Urschel JD, Vasan H. A meta-analysis of randomized controlled trials that compared neoadjuvant chemoradiation and surgery to surgery alone for resectable esophageal cancer[J]. Am J Surg,2003,185(6):538-43. |
| [8] | Fiorica F, Di Bona D, Schepis F, et al.Preoperative chemoradiotherapy for oesophageal cancer: a systematic review and meta-analysis[J]. Gut,2004,53(7): 925-30. |
| [9] | Burmeister BH, Smithers BM, Val Gebski,et al. Surgery alone versus chemoradiotherapy followed by surgery for resectable cancer of the oesophagus: a randomised controlled phaseⅢtrial[J]. Lancet Oncol,2005,6(9):659-68. |
 2014, Vol.41
2014, Vol.41