2.南昌大学医学院病理教研室
2.Department of Pathology, Medical College of Nanchang University
原发性肝癌(hepatocellular carcinoma,HCC) 是常见的恶性肿瘤之一,其发病率仅次于肺癌, 约占国内全部癌症发病率的10%,且有逐年上升的 趋势[1]。原发性肝癌术后复发转移率居高不下,预 后不理想,5年生存率仅为20%~30%[2]。因此,研究HCC相关基因用以筛选理想的肿瘤标志物,探 讨HCC的发病机制并应用于肿瘤的临床治疗具有 重要的意义。
Formins蛋白家族的FMNL-2(formin-like 2)是细 胞骨架重塑的关键调控因子,在胃癌、乳腺癌及 结直肠癌等多种肿瘤组织中存在表达[3, 4],与肿瘤 的侵袭与转移密切相关。基质金属蛋白酶(matrix metalloproteinases,MMPS)能够降解细胞外基质 (extracellular cell matrix,ECM)中各种蛋白成分, 通过破坏组织学屏障而影响肿瘤细胞的侵袭和转 移。本研究采用免疫组织化学Maxvision TM法检测 FMNL-2及MMP-2(matrix metalloproteinase-2)在肝 癌及癌旁组织中的表达及相关性,初步探讨两种 基因在肝癌发病机制中的意义。 1 资料与方法 1.1 标本
收集南昌大学第二附属医院病理科2007年— 2011年肝癌石蜡标本100例,所有患者术前均未行 化疗或放疗。其中男74例,女26例,年龄17~76 岁,平均51.1岁;AFP阳性68例,阴性32例; HBsAg阳性70例,阴性30例;巨块型34例,结节 型66例;伴肝硬化30例;有淋巴转移26例。所有 标本均取癌及癌旁组织(距肿块边缘≥5 cm处肝 组织),HE切片染色及免疫组织化学染色分析高 分化21例,中分化39例,低分化40例。全部病例 均经病理证实为肝细胞肝癌。 1.2 材料
鼠抗人FMNL-2单克隆抗体(1:50)购自 Abnova公司,鼠抗人MMP-2(即用型)单克隆抗 体、免疫组织化学染色试剂盒均购于福州迈新生 物技术有限公司。 1.3 方法
采用免疫组织化学染色Maxvision TM法分别检 测100例肝癌及癌旁组织中FMNL-2和MMP-2的表 达,操作步骤按试剂盒说明进行,DAB显色,苏 木精对比染色。用PBS代替一抗作阴性对照,已知 阳性标本切片作阳性对照。 1.4 结果判定
FMNL-2和MMP-2蛋白免疫组织化学染色阳 性表达定位于细胞质,呈棕黄或棕褐色颗粒,多 为弥漫性分布。采用图文分析软件IPP6.0,400倍 光学显微镜下选取相同条件(光源、亮度色彩饱和 度、增益对比)的5个随机视野区进行拍摄。所得图 片采用累积吸光度(IOD)测试指标进行定量分析。 1.5 统计学方法
应用SPSS19.0统计软件包进行分析,各组 数据以(x±s)表示,数据分析采用t检验及Pearson Correlation相关性分析。所有检验均为双侧概率检 验,检验水准为α=0.05,以P<0.05为差异有统计 学意义。 2 结果 2.1 FMNL-2的表达
FMNL-2阳性表达定位于细胞质,呈棕色颗 粒分布,癌组内多为灶性及弥漫性;癌旁组以弥 漫性为主。FMNL-2在肝癌组织中呈高表达,IOD 为(90 748.36±46 276.91);在癌旁组织中呈低表 达,IOD为(39 075.46±24 763.12),两组间差异 有统计学意义(t=10.509,P<0.05),见图A1、 B1。FMNL-2在阴性对照组中无表达。
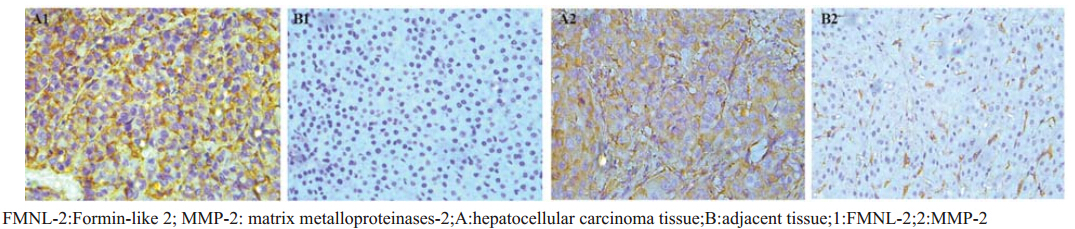 |
图 1 肝癌及癌旁组织中FMNL-2 和MMP-2的表达(MaxvisionTM ×400 ) Figure 1FMNL-2 and MMP-2 expression in hepatocellular carcinoma and adjacent tissues(MaxvisionTM ×400 ) |
MMP-2阳性表达为棕褐色或棕黄色,大多数 呈现弥漫性分布,定位于细胞质,少数细胞膜有 阳性表达。MMP-2在肝癌组织内高表达,IOD为 (87 969.46± 27 131.77);在癌旁组织低表达, IOD为(59 517.72±20 218.23)。两组间差异有统 计学意义(t=10.509,P<0.05),见图A2图A2、B2。 MMP-2在阴性对照组中无表达。 2.3 肝癌组中FMNL-2和MMP-2的表达相关性
经Pearson Correlation相关性分析,肝癌组织 中FMNL-2和MMP-2蛋白均为高表达,癌旁组织 中均为低表达,两者间具有正相关性(r=0.240, P=0.016),差异有统计学意义(P<0.05)。 2.4 FMNL-2及MMP-2蛋白表达与HCC临床病理
特征的关系 FMNL-2在是否伴肝硬化组中IOD值分别为 (47 471.96±40 273.54)和(72 123.41±45 517.93) (P<0.05);MMP-2在HBsAg阳性或阴性组中IOD 值分别为(77 668.34±27 682.79)和(64 585.83± 26 173.62)(P<0.05),在有无转移组中IOD值分 别为(63 854.73±21 730.42)和(77 218.05±28 930.01) (P<0.05);其他各组数据间差异无统计学意义 (P>0.05),见表1。
|
|
表1 肝癌患者临床病理特征与FMNL-2和MMP-2蛋白表达的关系 Table 1Relationship between FMNL-2/MMP-2 expressions and clinicopathological features of HCC patients |
肿瘤的发生及侵袭运动是以细胞的黏附、 运动及变形为基础的复杂过程,需要依赖一系 列细胞肌动蛋白骨架结构的改变。FMNL-2属于 Formins蛋白家族成员,在微丝的组装及重构过程中起关键调控作用,其高度保守的FH2功能域可促 进两个肌动蛋白单体聚合成二聚体,形成微丝成 核中心,启动微丝成核,并可维持细胞骨架中微 管的稳定性。而富含脯氨酸的FH1功能域可调控肌 动蛋白的成核活性,为不断延伸的微丝生长端提 供肌动蛋白单体,产生线性微丝[5, 6]。
近几年来FMNL-2参与肿瘤发生、发展的报道 越来越多,各类研究显示FMNL-2在肿瘤细胞的侵 袭力方面有着重要作用,可以调节肌动蛋白骨架 的重构从而参与细胞运动、变形及胞质分裂等活 动,可能是肿瘤细胞向周边浸润和远处转移的重 要调控基因。Pang等[2]通过生物信息学分析显示 FMNL-2基因定位于人类染色体2q23.3,是一类肿 瘤相关基因,通过Rho GTPase相关信号通路参与 肿瘤细胞极性控制及侵袭迁移等运动。Kitzing等[7] 研究证实FMNL-2作为Rho C的特殊效应器,具有 促肌动蛋白成核的特征性FH2功能域,可通过调节 Rho GTPase来控制肌动蛋白骨架的重组,从而调 控细胞形态及侵袭运动。各项研究显示FMNL-2在 一些正常组织及胚胎组织中阳性表达,同时在乳 腺癌、胃癌、结肠癌等肿瘤组织中也存在高表达。 李余发等[8]研究显示FMNL-2蛋白在高转移的结直 肠癌细胞系中相对高表达,FMNL2可能通过RasMEK-MAPK和PI3K-AKT两条信号通路促进大肠癌 发生EMT,从而经EMT促进大肠癌的细胞转移。
国内关于FMNL-2在肝癌的发生及发展机制方 面的研究极少,本研究采用免疫组织化学法初步 检测FMNL-2在肝癌及癌旁组织的表达情况及差 异,发现肝癌组织中存在FMNL-2的高表达,其 IOD平均值达到90 748.36,与癌旁组织的IOD平均 值39 075.46相比,差异有统计学意义。本实验主 要采用图文分析软件IPP6.0在相同条件下检测免疫组织化学结果,与人工计数方法相比,具有更好 的重复性,并可定性定量的客观分析。因此,免 疫组织化学法检测目的基因FMNL-2的蛋白表达是 否可作为临床诊断肝癌的参考指标,值得进一步探 讨。
细胞的迁移不仅是依靠细胞肌动蛋白骨架的 重构,基底膜的降解也是促使肿瘤细胞侵袭和转 移的关键环节。基质金属蛋白酶MMP-2是降解 细胞外基质及基底膜的关键酶,在肿瘤细胞的发 展过程中起重要作用。Yamamoto等[9]研究显示原 发性肝癌中MMP-2的高表达与门静脉浸润、肝内 转移及术后复发相关,表明MMP-2在肝癌组织的 浸润转移中发挥重要作用。Yan g等[10]发现肝癌组 织中MMP-2可降解ECM及基底膜的关键成分,破 坏组织结构,重塑ECM,促进肿瘤的生长及新生 血管的形成,同周边组织侵袭和远处转移密切相 关。
本研究显示肝癌组织中有MMP-2的高表达, 在癌旁组织内阳性表达较低,差异具有统计学意 义。HBsAg阳性的肝癌患者,其癌与癌旁组表达 差异明显,提示HBsAg指标阳性的患者比HBsAg 阴性的患者更有可能导致肝癌的发生。MMP-2 在有转移的肝癌组织中阳性表达明显高于无转移 组,显示MMP-2与肝癌细胞的侵袭转移有着密切 关系,MMP-2是否可作为临床诊断肝癌转移的参 考指标尚待验证。
本研究还发现FMNL-2和MMP-2蛋白表达具有 相关性,在FMNL-2高表达的肝癌组织中,MMP-2 也呈现过表达的现象。Liang等[11]研究显示在结直 肠癌中,FMNL-2的信使RNA即MicroRNA-137表 达水平的提高和FMNL-2表达水平的降低会抑制信 号通路Akt和MAPK的磷酸化,降低MMP-2的表 达,导致结直肠癌细胞侵袭性下降。肝癌组织内 FMNL-2与MMP-2的相关作用机制尚无报道,两者 表达水平的差异是否存在拮抗或协同作用、如何影 响肝癌细胞的发生发展机制,尚待进一步研究。
| [1] | Jemal A, Bray F, Center MM,et al.Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90. |
| [2] | Pang RW, Joh JW, Johnson PJ,et al.Biology of hepatocellular carcinoma[J]. Ann Surg Oncol,2008,15(4):962-71. |
| [3] | Zhu XL, Liang L,Ding YQ.The expression and clinical significance of formlin-like 2 in colorectal carcinoma[J]. Zhongguo Zong He Lin Chuang,2008,24(5):401-4. [朱曦龄,梁莉,丁彦青. FMNL2 在结直肠癌组织中的表达及其临床意义[J].中国综合临床, 2008,24(5):401-4.] |
| [4] | Katoh M, Katoh M. Identification and characterization of human FMNL1, FMNL2 and FMNL3 genes in silico[J].Int J Oncol,2003, 22(5):1161-8. |
| [5] | Courtemanche N, Pollard TD. Determinants of formin homology 1 (FH1) domain function in actin filament elongation by formins[J]. J Biol Chem,2012,287(10):7812-20. |
| [6] | Paul AS, Pollard TD. The role of the FH1 domain and profilin in formin-mediated actin-filament elongation and nucleation[J]. Curr Biol,2008,18(1):9-19. |
| [7] | Kitzing TM, Wang Y, Pertz O, et al.Formin-like 2 drives amoeboid invasive cell motility downstream of RhoC[J]. Oncogene,2010,29 (16):2441-8. |
| [8] | Li YF, Xiao FM, Liang L,et al.Bioinformatic Analysis of the Gene FMNL2 in Clorectal Cancer Metastasis[J]. Zhongguo Zhong Liu Lin Chuang,2011,38(7):361-6.[李余发,肖法嫚,梁莉,等.大 肠癌转移相关基因FMNL2的生物信息学分析[J].中国肿瘤临 床,2011,38(7):361-6.] |
| [9] | Yamamoto H,Itoh F, Adachi Y,et al.Relation of enhanced secretion of active matrix metalloproteinases with tumor spread in human hepatocellular carcinoma[J].Gastroenterology,1997,112(4):1290-6. |
| [10] | Yang C, Zeisberg M, Lively J C, et al.Integrin α1β1 and α2β1 are the key regulators of hepatocarcinoma cell invasion across the fibrotic matrix microenvironment[J]. Cancer Res, 2003, 63(23): 8312-7. |
| [11] | Liang L,Li X,Zhang X,et al.MicroRNA-137, an HMGA1 target, suppresses colorectal cancer cell invasion and metastasis in mice by directly targeting FMNL2[J].Gastroenterology,2013,144(3): 624-35. |
 2014, Vol.41
2014, Vol.41