肺癌是目前最常见的恶性肿瘤,死亡率位居各 类恶性肿瘤之首,五年生存率约15% [ 1 ]。约80%为非 小细胞肺癌(non-small cell lung cancer,NSCLC), 大部分发现时已为晚期,靶向治疗已经成为晚期 肺癌主要治疗手段。2004年Lynch等[ 2 ]报道吉非替 尼对EGFR突变的肺癌治疗有效。EGFR 突变的进 展期NSCLC患者接受表皮生长因子受体酪氨酸激 酶抑制剂(EGFR-TKI)治疗可明显获益。EGFR 突变状态是酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)治疗的先决条件,NSCLC患者监测 EGFR突变已经列入NCCN指南Ⅰ级推荐级别[ 3 ]。 但晚期肺癌患者很难获得组织标本,能否利用肿 瘤患者外周血进行EGFR突变检测,从而用于TKI 靶向药物治疗及疗效预测已经成为研究热点。近 年来,已经有多项关于外周血与组织EGFR突变检 测比较的研究,显示外周血EGFR突变检测有较好 的敏感度和特异性,与肿瘤组织具有很好的一致 性。我们通过Meta分析综合评价外周血检测EGFR 突变的研究结果,对其诊断效能做出客观、准确 的评价,以期为临床诊断、治疗提供依据。 1 资料与方法 1.1 资料来源
检索PubMed、Medline、EMBASE、ISI Web of Knowledge等英文数据库及中国期刊网、万方 数据库。文献检索时间截止2013年3月。英文检索 词为lung cancer、epidermal growth factor receptor mutations、serum、plasma、blood、tissue。中文检索词为肺癌、表皮生长因子受体突变、血清、血 浆、血、组织,并检索所附参考文献以及相关文 献综述,以补充相关文献中所引用的研究。 1.2 纳入与排除标准 1.2.1 纳入标准
(1)研究类型:关于检测配对的 肺癌患者血清与肿瘤组织表皮生长因子受体突变 的诊断性研究;(2)研究对象包括NSCLC以及其他 肺部恶性肿瘤,均经组织学或细胞学确诊;(3)诊 断试验方法:已发表的与直接测序法一致性高的 检测方法;(4)原始数据文献资料完整可提取四格 表。 1.2.2 排除标准
(1) 对于样本人群相同而发表的 文献多于1篇的研究只保留其中质量最好的研究, 剔除其余研究。(2)单纯进行外周血或非配对肺癌 标本EGFR检测的文献。 1.3 文献的质量评价
文献的质量分级主要参照诊断试验质量评价 标准[ 4 ],QUADAS每个项目按“是”、“否”、“不清 楚”3个标准进行评价。由两名评价者独立评价, 对评价不一致者经讨论决定。 1.4 数据提取
由两位评价者独立地按纳入、排除标准筛选 文献并对纳入文献的数据进行提取,若有分歧通 过讨论或第三方解决。提取资料包括研究作者、 国家、发表时间、肺癌分期、原始四格表数据、 检测方法。 1.5 统计学方法
通过采用Meta Disc 1.4软件[ 5 ]进行统计学分 析。首先对纳入文献进行异质性检验,若P>0.05 则无异质性,选用固定效应模式。若P≤0.05 则存在异质性,选用随机效应模型。按照相应 的效应模型合并各研究的敏感度(SEN)、特 异性(SPE)、阳性似然比(PLR)、阴性似然比 (NLR)、诊断优势比(DOR)及其95%可信区间 (confidence interval,CI)。绘制综合受试者工作特征 曲线(summary receiver operating characteristic curve, SROC)曲线[ 6 ] ,并计算曲线下面积(area under the curve,AUC),AUC越接近1,表示诊断试验的准确 性越高。采用逐一排除的方法进行敏感度分析。 2 结果 2.1 纳入研究基本特征
最初检索到英文文献40篇,中文文献65篇。 符合纳入标准的共9篇[ 7, 8, 9, 10, 11, 12, 13, 14, 15 ],其中英文文献6篇、中 文文献3篇,共计555名研究对象,包括小细胞肺 癌2例,肉瘤样癌1例,其余均为NSCLC;6项研究 在中国、2项研究在日本、1项在美国。各研究基 本特征见表1。
|
|
表1 纳入研究文献的基本特征 Table 1 Basic characteristics of the included studies |
纳入研究的6篇文献符合QUADAS条目中12条 标准,3篇文献符合13条标准。虽然纳入研究文献 采用检验金标准的方法有多种,但是这些方法均 有相关文献报道,与直接测序法有很高一致性。 3篇文献[ 13, 14, 15 ]标本间隔时间短,其中2篇[ 13, 15 ]小于1 周。6篇文献[ 7, 8, 9, 10, 11, 12 ]未说明组织与血液标本检测间隔 时间。 2.3 Meta分析结果 2.3.1 异质性分析
Spearman 相关系数为0.186, P=0.63,提示无阈值效应。DOR的Cochran-Q值为 12.26,P=0.14,提示无非阈值效应。因此纳入文 献无异质性,选用固定效应模型分析,见图1。
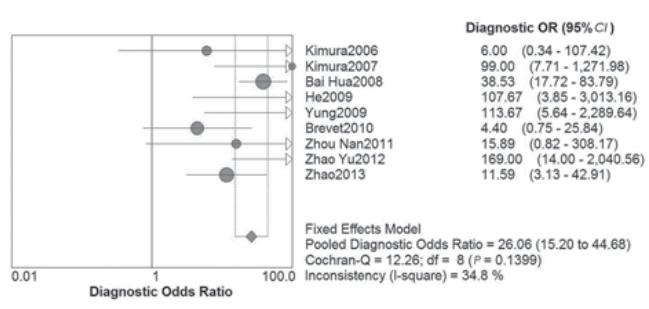 |
图1 检测血清EGFR突变诊断比值比森林图 Figure 1 Forest plots of diagnostic odds ratio of the detection of EGFR mutation in plasma |
外周血EGFR突变的受 试者SROC曲线,见图2,AUC为0.94。9个研 究合并敏感度为0.65(0.58~0.71),合并特异 性为0.92(0.89~0.95),见图3。合并阳性似然 比为8.29(5.73~12.02),合并阴性似然比为0.37(0.21~0.64),见图4。
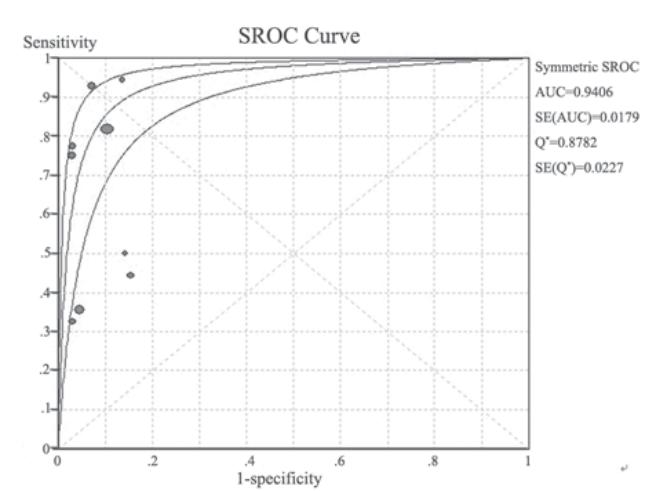 |
图2 检测外周血EGFR突变的受试者工作特征曲线 Figure 2 SROC curves of the detection of EGFR mutation in plasma |
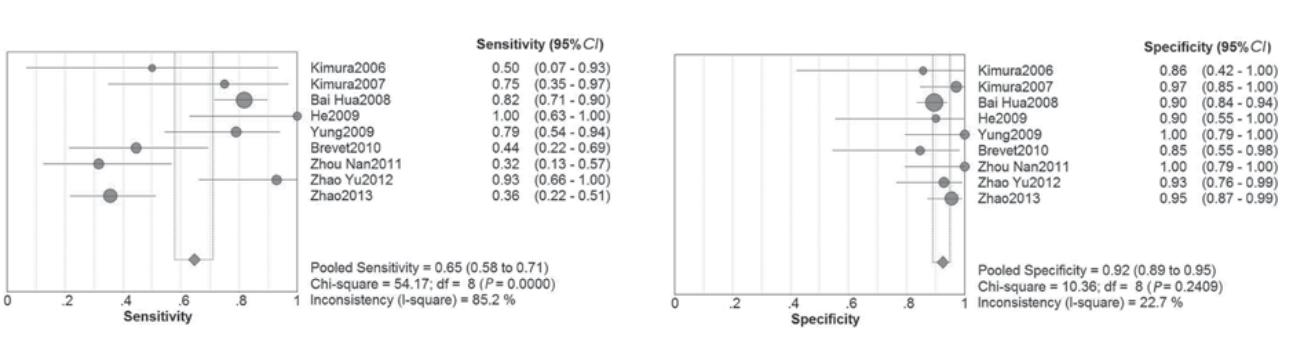 |
图3 检测血清EGFR突变敏感度和特异性森林图 Figure 3 Forest plots of sensitivity and specificity of the detection of EGFR mutation in plasma |
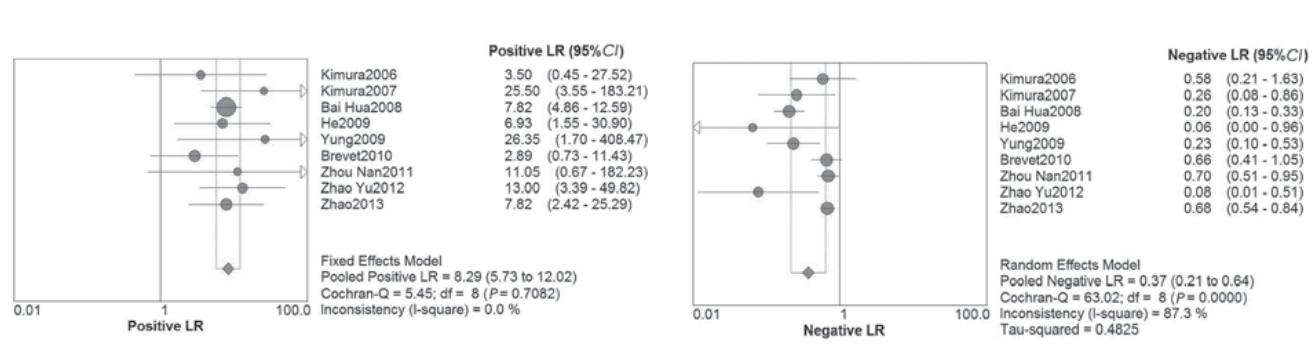 |
图4 检测血清EGFR突变阳性似然比和阴性似然比森林图 Figure 4 Forest plots of positive LR and negative LR of the detection of EGFR mutation in plasma |
将每个研究逐一排除后进行 敏感度分析显示合并敏感度和特异性未见明显改 变,这说明纳入文献的稳定性好。 3 讨论 对EGFR突变的进展期NSCLC患者使用EGFRTKI已经成为指南推荐的一线治疗方案。检测 EGFR突变状态是应用EGFR-TKI治疗的首要条 件。目前,NSCLC患者检测EGFR突变的金标准 是针对肿瘤组织的直接测序法。虽然该法可靠 性高,但有对标本要求高、操作繁琐、敏感度 不高等缺点,难以在临床大规模应用[ 16 ]。其他 方法如突变体富集(mutant-enriched)PCR [ 17 ] , 探针扩增阻滞突变系统(amplification refractory mutation system,ARMS)[ 8 ] ,微数字(microfluidics digital )PCR [ 11 ]、高分辨率溶解曲线分析技术 (high resolution melting analysis,HRM)[ 14 ]高效 液相色谱法(denaturing high-performance liquid chromatograph,DHPLC)[ 9 ],这些方法敏感度和 特异性都非常高,而且敏感度远远大于测序法, 对于针吸、活检的组织以及血清、胸腔积液等都 有很大的应用前景。
对于晚期NSCLC患者来说,组织标本往往难 以获得,检测血清DNA的方法可能是一种解决办 法。肿瘤患者血液中存在大量游离DNA,高于健 康人10倍,游离DNA主要来自凋亡坏死的癌细胞, 其遗传特性与原发肿瘤相同。因此通过检测血清DNA来判断NSCLC患者EGFR突变状态是可行的 [ 18 ]。
本研究结果显示,9个研究的合并敏感度为 0.65,合并特异性为0.92,提示其平均漏诊率 35%,误诊率为8%。提示检测血清EGFR特异性 高,误诊率低,可以作为肯定性诊断试验指导临 床应用TKI类药物。在我们纳入的所有文献中检测 肺癌外周血EGFR突变的敏感度32%~100%,差异 有统计学意义,原因可能为:(1)不同的研究中心 所选用的研究方法不同。(2)所研究的肺癌分期不 同,而晚期的肺癌肿瘤负荷更大,释放至外周血 的肿瘤细胞游离DNA可能更为丰富,检出EGFR突 变概率增大,外周血敏感度要高于早期肺癌[ 19 ]。 (3)纳入肺癌病理类型不同,如腺癌突变率要高于 鳞癌等。即便如此,肺癌患者血清与肿瘤组织的 EGFR突变具有较高的一致性,外周血检测EGFR 突变还是有很大的意义。
SROC曲线下面积AUC是衡量某一诊断方法 准确性的指标,AUC越接近1,说明诊断效果越 好。AUC面积>0.9时有较高的准确性。本研究 AUC=0.94,提示外周血检测EGFR突变的精度是 94%,表明其诊断效能较高,提示外外周血诊断 肺癌EGFR突变具有较高的准确性,其诊断效能较 高。
本研究尽可能全面的收集文献,制定严格的 纳入与排除标准,以减少选择偏倚对研究可靠性 和真实性的影响。虽然文献中所采用的检测EGFR 突变的方法敏感度和特异度都很好,但是也存在 一定不足,可能会造成金标准的参考偏倚。
综上所述,本研究表明检测外周血EGFR突变 来判断肺癌EGFR突变状态是一种可行的办法, 但是尚需更大样本和高质量的临床试验进一步论 证。
| [1] | Jemal A,Siegel R,Ward E,et al. Cancer statistics,2009[J]. CA Cancer J Clin,2009,59(4):225-49. |
| [2] | Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J]. N Engl J Med,2004, 350(21):2129-39. |
| [3] | National Comprehensive Cancer Network. NCCN guidelines: non-small cell lung cancer Version 3 [EB/OL]. 2011-08-30.http:// www.nccn.com. |
| [4] | Whiting P, Rutjes AW, Reitsma JB, et al. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews[J]. Zhongguo Xun Zheng Yi Xue Za Zhi, 2007,7(4):296-306. [Whiting P, Rutjes AW, Reitsma JB,等.QUADAS的制定:用于系统评价中评价诊断性研究质量的工具[J].中国循证医学杂志,2007,7(4):296-306.] |
| [5] | Zhang TS, Zhong WZ. Meta-DiSc software in Meta-Analysis of diagnostic test[J]. Xun Zhen Yi Xue, 2008,8(2):97-100,108.[张天 嵩,钟文昭. Meta-Disc软件在诊断试验Meta分析中的应用[J].循证医学,2008,8(2):97-100,108.] |
| [6] | Liu GJ, Wu TX. Summary ROC curve-diagnostic test method of Meta-analysis[J]. Zhongguo Xun Zheng Yi Xue Za Zhi,2003,3(1): 41-4.[刘关键,吴泰相.诊断性试验的Meta分析-SROC曲线法介 绍[J].中国循证医学杂志, 2003,3(1): 41-4. ] |
| [7] | Kimura H, Kasahara K, Kawaishi M, et al. Detection of epidermal growth factor receptor mutations in serum as a predictor of the response to gefitinib in patients with non-small-cell lung cancer [J]. Clin Cancer Res,2006,12(13): 3915-21. |
| [8] | Kimura H, Suminoe M, Kasahara K, et al. Evaluation of epidermal growth factor receptor mutation status in serum DNA as a predictor of response to gefitinib (IRESSA)[J]. Br J Cancer, 2007,97(6):778-84. |
| [9] | Bai H,Zhao J,Wang SH,et al. The detection by denaturing high performance liquid chromatography of epidermal growth factor receptor mutation in tissue and peripheral blood from patients with advanced non-small cell lung cancer[J]. Zhonghua Jie He He Hu Xi Za Zhi,2008,31(12):891-6.[白桦,赵军,王书航,等.变性高效液 相色谱法检测非小细胞肺癌患者外周血及肿瘤组织表皮生长 因子受体突变[J].中华结核和呼吸杂志,2008,31(12):891-6.] |
| [10] | He C, Liu M, Zhou C, et al. Detection of epidermal growth factor receptor mutations in plasma by mutant-enriched PCR assay for prediction of the response to gefitinib in patients with non-smallcell lung cancer[J]. Int J Cancer,2009,125(10): 2393-9. |
| [11] | Yung TK, Chan KC, Mok TS, et al. Single-molecule detection of epidermal growth factor receptor mutations in plasma by microfluidics digital PCR in non-small cell lung cancer patients[J]. Clin Cancer Res,2009,15(6): 2076-84. |
| [12] | Brevet M, Johnson ML, Azzoli CG, et al. Detection of EGFR mutations in plasma DNA from lung cancer patients by mass spectrometry genotyping is predictive of tumor EGFR status and response to EGFR inhibitors[J]. Lung Cancer, 2011,73(1): 96-102. |
| [13] | Zhou N,Li LY,Zheng Z,et al. Detection of epidermal growth factor receptor gene mutations in tumor and matched serum in lung cancer patients by Scorpions amplification refractory mutation system[J]. Ai Zheng Jin Zhan,2011,9(1):19-26.[周南, 李龙芸,郑直,等.蝎形探针扩增阻滞突变系统检测肺癌患者 血清与肿瘤组织中表皮生长因子受体基因突变[J]. 癌症进展,2011,9(1):19-26.] |
| [14] | Zhao Y,DouYL,Guo HQ,et al. Detect serum circulating EGFR mutation with qPCR-HRM method[J]. Ai Zheng Jin Zhan,2012,10(1):10-2. [赵宇, 窦亚玲,郭惠琴,等.qPCR-HRM法检 测NSCLC血清循环EGFR突变[J].癌症进展,2012,10(1):10-2 .] |
| [15] | Zhao X, Han RB, Zhao J, et al. Comparison of epidermal growth factor receptor mutation statuses in tissue and plasma in stage IIV non-small cell lung cancer patients[J]. Respiration,2013,85(2): 119-25. |
| [16] | Fan X, Furnari FB, Cavenee WK, et al. Non-isotopic silver-stained SSCP is more sensitive than automated direct sequencing for the detection of PTEN mutations in a mixture of DNA extracted from normal and tumor cells[J]. Int J Oncol,2001,18(5):1023-6. |
| [17] | Asano H, Toyooka S, Tokumo M, et al. Detection of EGFR gene mutation in lung cancer by mutant-enriched polymerase chain reaction assay[J]. Clin Cancer Res,2006,12(1): 43-8. |
| [18] | Zhao Y. Advanced of detecting nucleic acids in Peripheral blood from patients with lung cancer as a new method[J]. Ai Zheng Jin Zhan,2011,9(4):404-7. [赵宇.循环中的核酸作为肺癌检查新手 段的研究进展[J].癌症进展,2011,9(4):404-7.] |
| [19] | Rosell R, Moran T, Queralt C, et a1. Screening for epidermal growth factor receptor mutations in lung cancer[J]. N Engl J Med,2009,361(10):958-67. |
 2014, Vol.41
2014, Vol.41



