肺癌的危险因素有很多,包括吸烟、大气污染、职业因素、遗传等。其中吸烟是促进肺癌发生的重要因素之一[ 1 ],由于香烟中含有大量对人体有害成分包 括尼古丁、焦油、苯、氨、一氧化碳、氰化物等,因此 吸烟能够促进支气管上皮细胞恶变,增加肺癌的发生率[ 2 ]。虽然吸烟是肺癌发生的其中一个因素,但肿瘤的发生发展影响因素很多,许多肺癌患者并无吸烟习惯。用于治疗肺癌的化疗药物有很多,明确肺癌基因表达异常与化疗药物之间的相关性,对阐明化疗药物的作用机制有着重要意义。因此本文主要通过对肺癌 表达谱数据进行分析,筛选吸烟相关及非吸烟相关肺癌的差异表达基因,对这些差异表达基因通过相关 化疗药物数据库进行富集分析,筛选出与肺癌可能相 关的化疗药物,进一步通过分析化疗药物所对应的异 常表达基因所参与的信号调控网络,明确这些化疗药 物在肺癌治疗中可能的作用机制。 1 资料和方法 1.1 资料
选取来源于NCBI的GEO[ 3 ]表达谱数据库的 表达谱数据GSE31210进行差异表达基因的筛选。 GSE31210表达谱数据包含正常肺组织表达谱数据20 例,肺癌组织表达谱数据226例,根据患者吸烟情况 的不同,将表达谱数据分为有吸烟习惯的病例数据 和无吸烟习惯的病例数据。其中有吸烟习惯患者正 常肺组织数据12例,肺癌组织数据111例。无吸烟习 惯患者正常肺组织数据8例,肺癌组织数据115例。 1.2 方法
由于吸烟这种因素对肺癌的影响较大,因此, 将表达谱分为吸烟组和非吸烟组,分别筛选两组 的差异表达基因。两组的筛选方法一致,均使用统 计学方法对正常肺与肺癌组织数据使用Benjamini Hochberg法进行差异表达基因的筛选。筛选过程 中调整P值小于0.01。选择变化倍数大于两倍的基 因,对吸烟组和非吸烟组筛选出的差异表达基因 取交集,然后对筛选出的差异表达基因进行相关 化疗药物富集分析,分析与差异表达基因相关的 化疗药物,选择其中较为重要的化疗药物对应的 差异表达基因进行蛋白相互作用网络调控分析, 分析这些化疗药物与肺癌基因异常表达的相关性 及这些化疗药物对肺癌的可能作用机制。 2 结果 2.1 差异表达基因筛选结果
经过统计学筛选,数据GSE31210中吸烟组表 达上调的差异表达探针有1 580个,下调的差异表 达探针有2 634个。非吸烟组表达上调的差异表达 探针有802个,下调的差异表达探针有1 368个。从 差异表达基因探针的数目可以看出,吸烟状态下 肺癌组织异常表达基因的数目多于非吸烟状态下 的肺癌组织。将上述筛选出上下调的差异表达探 针分别取交集,得到表达上调的交集基因探针有 556个,对应着397个基因。下调的差异表达基因 探针有1 204个,对应着741个基因。 2.2 差异表达基因相关化疗药物筛选结果
对肺癌组织中表达上调的差异基因通过WebGestalt[ 4 ]工具进行相关化疗药物的富集分析。根 据富集分析结果,得到与肺癌表达异常基因相关的 化疗药物,其中部分化疗药物为非肿瘤相关治疗药 物,部分为肿瘤相关治疗药物,分别为紫杉醇、米托 蒽醌、丝裂霉素、顺铂、多西他赛、表柔比星等,见 表1。紫杉醇和顺铂为化疗的常用药物,在肺癌的治疗中有着重要应用 [ 5, 6 ],其中紫杉醇能够抑制微管的 解聚,保持微管蛋白的稳定,抑制细胞有丝分裂,促 进细胞凋亡 [ 7 ]。还能够使肿瘤细胞的细胞周期停滞于G2/M期[ 8 ],因此紫杉醇主要影响肿瘤细胞的细胞周 期,抑制肿瘤细胞的增殖。从肺癌的上调差异表达基 因的药物富集结果中可以发现,与紫杉醇相关的10个 基因与细胞周期密切相关,所以紫杉醇在肺癌治疗 过程中可能是通过此10个基因发挥细胞周期阻滞的 作用。而米托蒽醌[ 9 ],丝裂霉素[ 10 ],多西他赛[ 11, 12 ],表阿霉素[ 13 ]均有较多的临床试验与肺癌化疗相关。
|
|
表1 肺癌组织中上调差异表达基因相关药物富集结果 Table 1 Enrichment results of drugs which related to up-regulated aberrantly expressed genes in lung cancer tissue |
富集结果中能够用于肿瘤治疗的药物包括紫杉 醇、米托蒽醌、丝裂霉素、顺铂、多西他赛、表柔比 星。这些药物均对应着部分在肺癌组织中表达上调 的基因。对这些基因进行交集筛选可以得到六种化 疗药物中,五种药物共同对应基因为TOP2A,四种药 物共同对应基因为MAD2L1、BIRC5。因此TOP2A, MAD2L1,BIRC5在化疗药物对肺癌的治疗过程中可 能发挥着重要作用。为了明确这三个基因间的调控 机制,使用Visant工具对上述三个基因进行网络调控 分析。首先分析三个基因对应蛋白的相互作用蛋白, 分别得到三个基因对应蛋白的直接作用蛋白,然后 再展开各自的相互作用蛋白,分别得到三个基因对应 蛋白的间接作用蛋白,蛋白与蛋白相互作用形成复杂网络,然后计算三个蛋白间的最短回路,提取回路中 的蛋白节点,构建三个蛋白间的相互调控网络。由于 UBC蛋白为泛素蛋白C,其相互作用蛋白很广泛,因此 在网络中去掉。最终得到TOP2A,MAD2L1,BIRC5间 的相互调控关系,见图1。从图中可以看出,MAD2L1 通过调控P53基因影响其下游基因RB1、PRKDC、 H2AFX、XPO1,而这四个基因又能直接作用TOP2A 和BIRC5。其中P53基因还可直接调控TOP2A,进一步 说明了TOP2A在此信号传递过程中的重要作用。
 |
图1 TOP2A,MAD2L1,BIRC5间相互作用网络调控关系图 Figure 1 Network regulation diagram of the interaction among TOP2A,MAD2L1 and BIRC5 |
为了明确TOP2A,MAD2L1,BIRC5与肺癌 患者生存期的相关性,由于表达谱数据GSE31210具 有肺癌患者生存时间数据,因此可用此表达谱数据 对上述三个基因进行生存分析。为了更好的分组, 226例肺癌组织表达谱数据选择180例进行生存分 析。分别将上述三个基因的表达值从小到大进行排 序并分为低,中,高三组,每组包含60例病例,三组 之间是递增关系。使用Kaplan-Meier生存分析的方法 分析三组之间的生存率,得出生存曲线,见图2。结果 TOP2A(P=0.0035)、MAD2L1(P=0.0056)、BIRC5 (P=0.0015)均 与 患 者 生 存 期明 显 相 关 。从三组曲线关 系可以看出,基因表达越高,患者生存率越低。说明这 些基因与肺癌的发生发展密切相关。
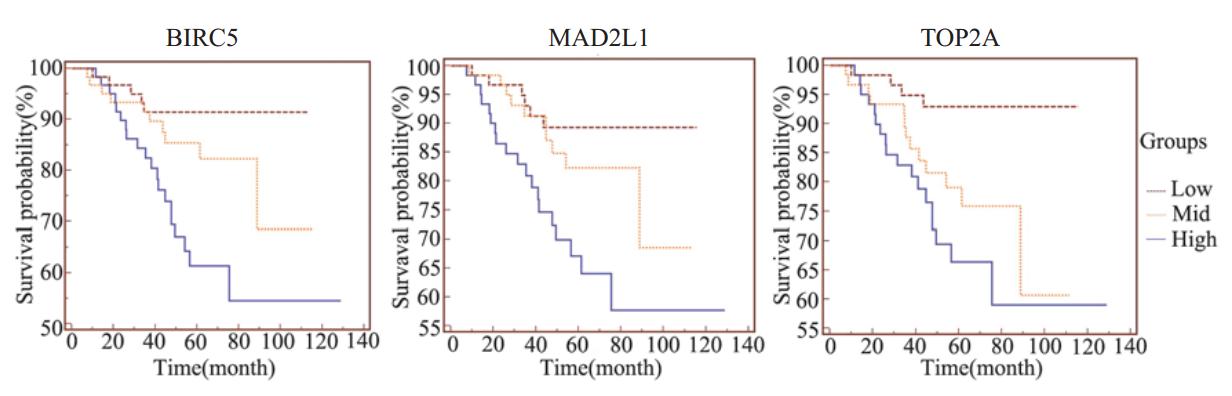 |
图2 TOP2A、MAD2L1和BIRC5的表达与肺癌患者生存关系分析 Figure 2 Relationship between the survival of lung cancer patients and the expression of TOP2A, MAD2L1 and BIRC5 respectively |
在肺癌组织中,表达上调的差异表达基因对 肺癌的发生发展有着重要意义,要阐明抗肿瘤的 化疗药物在肺癌治疗过程中的作用机制,需要分 析这类异常表达基因与常用化疗药物的相关性。 WebGestalt工具能够基于PharmGKB数据库[ 14 ]对基 因与药物的关系进行注释以及归类。本研究通过对 肺癌差异表达基因关联的化疗药物进行分析,进 一步明确了肺癌中上调的差异基因与肺癌的相关 性。其中化疗药物紫杉醇能够促进微管蛋白的稳 定进而抑制细胞的有丝分裂,顺铂则可通过抑制 DNA的合成抑制肿瘤细胞的增殖[ 15 ],促进凋亡。 由于肺癌中上调的基因多与肿瘤细胞周期以及有 丝分裂相关,因此化疗药物所对应的基因同样与 肿瘤细胞周期以及有丝分裂相关。由于TOP2A, MAD2L1,BIRC5这三个基因在六种肺癌相关化疗 药物中所对应的基因重复较多,说明这三个基因 在化疗药物对肺癌的治疗过程中起着重要作用。 已有报道TOP2A [ 16 ],MAD2L1 [ 17 ],BIRC5 [ 18 ]与肺癌患者 生存期相关,与此次分析结果一致,而此次分析结果 中三组曲线相互之间均有较为明显的差异,进一步说 明了这三个基因与患者生存期有着紧密联系。
TOP2A基因主要编码拓扑异构酶,由于DNA 是双螺旋结构,因此其在DNA的复制以及转录 过程中都起着重要作用,所以此基因与细胞增殖 密切相关。而此基因在肺癌组织中表达增高, 且能够提高化疗药物的敏感度[ 19, 20 ],进一步说明 了其在化疗作用中的地位。MAD2L1为纺锤体组装检查点的关键部分,纺锤体组装检查点能够在 有丝分裂过程中调控纺锤体微管附着染色体的 着丝粒,其表达与卵巢浆液性肿瘤的化疗抵抗 相关[ 21 ],因此其表达与肿瘤的化疗敏感度相关。 BIRC5即Survivin,其在肿瘤中的相关研究较多。 本研究筛选了三个与肺癌化疗药物较为相关的基 因,由于这些基因与肿瘤细胞增殖相关,因此与 肿瘤的关系已有较多的研究,从网络调控结果看 来,MAD2L1能通过P53基因间接调控TOP2A和 BIRC5,说明MAD2L1在肺癌的化疗过程中可能更 为重要。化疗是肿瘤治疗中重要的治疗手段,而 现有的化疗药物特异性不高,不良反应较大,化 疗强度往往与肿瘤患者耐受程度相关,极大地影 响着肿瘤的治疗。因此提高化疗药物的敏感度, 寻找在化疗过程中对化疗效果起着重要影响的关 键基因,对肿瘤的治疗有着积极的意义。本研究 探讨了肺癌中表达上调的差异基因与化疗药物之 间的关系,进一步阐明了化疗药物对肺癌细胞的 可能作用机制,对进一步开发出抑制肺癌的新型 药物有着一定的指导意义。
| [1] | Handler S. Lung cancer and smoking[J]. CA Cancer J Clin,1991,41(6):371. |
| [2] | Lubin J H, Caporaso N, Wichmann H E, et al. Cigarette smoking and lung cancer: modeling effect modification of total exposure and intensity[J]. Epidemiology,2007,18(5):639-48. |
| [3] | Barrett T, Troup DB, Wilhite SE, et al. NCBI GEO: mining tens of millions of expression profiles--database and tools update[J]. Nucleic Acids Res,2007,35(Database issue):D760-5. |
| [4] | Zhang B, Kirov S, Snoddy J. WebGestalt: an integrated system for exploring gene sets in various biological contexts[J]. Nucleic Acids Res,2005,33(Web Server issue):W741-8. |
| [5] | von Pawel J, Wagner H, Niederle N, et al.Phase II study of paclitaxel and cisplatin in patients with non-small cell lung cancer[J]. Semin Oncol,1996,23(6 Suppl 16):47-50. |
| [6] | Dimitroulis J, Rapti A, Stathopoulos GP, et al. Comparison of cisplatin-paclitaxel combination versus cisplatin-etoposide in patients with small-cell lung cancer: a Phase III study[J]. Oncol Rep,2008,20(4):879-84. |
| [7] | Xiao H, Verdier-Pinard P, Fernandez-Fuentes N, et al. Insights into the mechanism of microtubule stabilization by Taxol[J]. Proc Natl Acad Sci U S A,2006,103(27):10166-73. |
| [8] | Ling X, Bernacki RJ, Brattain MG, et al. Induction of survivin expression by taxol (paclitaxel) is an early event, which is independent of taxol-mediated G2/M arrest[J]. J Biol Chem,2004,279 (15):15196-203. |
| [9] | Feun LG, Savaraj N, Solomon J, et al. Phase II trial of mitoxantrone and cisplatin in advanced non-small-cell lung cancer[J]. Am J Clin Oncol,1996,19(2):190-2. |
| [10] | Sculier JP, Ghisdal L, Berghmans T, et al. The role of mitomycin in the treatment of non-small cell lung cancer: a systematic review with meta-analysis of the literature[J]. Br J Cancer,2001,84(9):1150-5. |
| [11] | Radhakrishnan A, Bitran JD, Milton DT, et al. Docetaxel and oxaliplatin as first-line therapy for advanced non-small cell lung cancer: a phase II trial[J]. J Chemother,2009,21(4):439-44. |
| [12] | Park SH, Hong J, Kim YS, et al.Phase II trial of weekly docetaxel and gemcitabine for previously untreated, advanced non-small cell lung cancer[J]. Lung Cancer,2008,62(1):72-7. |
| [13] | Kretzschmar A, Drings P. Epirubicin weekly in combination chemotherapy with cyclophosphamide and vincristine in untreated small cell lung cancer: a phase II trial[J]. Onkologie,1990,13(2):141-2. |
| [14] | Thorn CF, Klein TE, Altman RB. Pharmacogenomics and bioinformatics: PharmGKB[J]. Pharmacogenomics,2010,11(4):501-5. |
| [15] | Metcalfe SA, Cain K, Hill BT. Possible mechanism for differences in sensitivity to cis-platinum in human prostate tumor cell lines[J]. Cancer Lett,1986,31(2):163-9. |
| [16] | Perumal D, Singh S, Yoder S J, et al. A novel five gene signature derived from stem-like side population cells predicts overall and recurrence-free survival in NSCLC[J]. PLoS One,2012,7(8):e43589. |
| [17] | Kato T, Daigo Y, Aragaki M, et al. Overexpression of MAD2 predicts clinical outcome in primary lung cancer patients[J]. Lung Cancer, 2011,74(1):124-31. |
| [18] | Lu B, Gonzalez A, Massion PP, et al.Nuclear survivin as a biomarker for non-small-cell lung cancer[J]. Br J Cancer,2004,91(3):537-40. |
| [19] | Arivazhagan A, Kumar DM, Sagar V,et al. Higher topoisomerase 2 alpha gene transcript levels predict better prognosis in GBM patients receiving temozolomide chemotherapy: identification of temozolomide as a TOP2A inhibitor[J]. J Neurooncol,2012,107(2):289 -97. |
| [20] | Konecny GE, Pauletti G, Untch M, et al. Association between HER2, TOP2A, and response to anthracycline-based preoperative chemotherapy in high-risk primary breast cancer[J]. Breast Cancer Res Treat,2010,120(2):481-9. |
| [21] | Nakano Y, Sumi T, Teramae M, et al.Expression of the mitotic-arrest deficiency 2 is associated with chemotherapy resistance in ovarian serous adenocarcinoma[J]. Oncol Rep,2012,28(4):1200-4. |
 2014, Vol.41
2014, Vol.41



