至2009年美国FDA批准了全球第一个细胞免 疫治疗产品以来,细胞免疫治疗肿瘤的有效性逐 渐被认可,并广泛应用于临床。有研究[ 1 ]指出把 癌症的免疫治疗作为2013年人们注重的六大科 技任务之一。临床上,对于早期及ECOG(eastern cooperative oncology group,ECOG)评分小于2的患 者,治疗上可以选择手术及放化疗为主和(或)联合 免疫治疗。但对于预计生存期小于3月、ECOG大 于3的晚期患者,缺乏有效的治疗方法,常以姑息 对症为主,患者生活质量差,生存期短。单纯细 胞免疫治疗是否有助于改善这一现状,目前报道 甚少。我科对于该类患者试用树突状细胞(dendritic cell,DC)-细胞因子诱导杀伤细胞(cytokine-induced killer,CIK)即DC-CIK疗法取得了较理想疗效,现报 道如下。 1 资料和方法 1.1 研究对象
自2012年7月—2012年12月,13例恶性肿瘤 晚期患者在首都医科大学附属北京世纪坛医院肿瘤内科进行了DC-CIK免疫治疗,其中男10例, 女3例,年龄39~83岁,ECOG评分3~4分,其中 肺癌5例、胆管癌2例、前列腺癌1例、食管癌1 例、淋巴瘤1例、胰腺癌1例、卵巢癌1例、胃癌1 例。所有患者均为预计生存期小于3月的Ⅳ期患者 (生存期的预测主要根据中国预后量表—Chinese Prognostic Scale,ChPS)[ 2, 3 ]。患者一般资料及治疗 情况见表1。所有患者在DC-CIK治疗前3月及DCCIK治疗后均未接受放化疗。患者及其法定代理 人知情并同意接受该治疗。随访时间均大于6月, OS大于6月的患者至随访结束时仍然存活。
|
|
表1 患者一般情况及治疗情况 Table 1 Clinical data of patients Patient’s No. Age(years) Gender |
T细胞亚群检测采用流式细胞仪。a~f六管中 分别加标有荧光的抗体10 μl,加50 μl血液样本, 振荡,室温避光放置15 min后加BD溶血素400 μl, 室温避光放置8 min后加入2 ml PBS液,室温1500 r/min离心5 min,弃液留底部细胞加入400 μlPBS 液,振荡后上机检测。 1.4 DC-CIK细胞悬液的制备
G-CSF刺激造血后外周血白细胞>10×109/L、 淋巴+单核>15%后,分两天采集外周血单个核细 胞200~250 ml。取采集物25~50 ml(剩余的-80℃ 分袋冻存备用)用0.9%氯化钠溶液1:1稀释,缓慢 加入淋巴细胞分层液表面上,无菌封盖,400 g, 30 min,轻轻吸细胞层,用0.9%氯化钠溶液1 500 r/min,离心5 min,洗三次。细胞计数后,按5 × 106/ml 的细胞浓度分3瓶培养,每瓶加入完全培养液(含 2.5%自体血浆的1640培养液)60~80 ml,放入5% 的CO237℃培养箱中培养2~4 h后。悬浮细胞进行 CIK培养,贴壁细胞进行DC培养。然后将细胞悬 液送细菌培养。
CIK培养:合并细胞悬液并移入完全培养液 (含自体血浆的AIM-V),1L AIM-V培养液中 加入各种细胞因子[干扰素-γ1 ml(即全部加到1L AIM-V中),IL-2 1 200 μl,CD3单抗5~10 μl并首 次加1支肝素],放入5% CO2培养箱中培养。 DC培养:贴壁细胞加入DC培养液和各种 细胞因子[TNF-α(30 μl/30 ml),IL-4(60 μl/30 ml),GM-CSF(60 μl/30 ml)]放入5% CO2培养箱 中培养。隔日镜下观察,根据细胞数量及培养液 颜色,补充完全培养液和细胞因子(含2.5%自体 血浆AIM-V加补IL-2终浓度1 μl/ml)。回收细胞 数量大于1×1010,0.9%氯化钠溶液低速离心,洗三 次。用适量含有12.5%血浆蛋白的0.9%氯化钠溶 液重悬细胞,回输患者。 1.5 免疫治疗方案及随访
所有患者接受DC-CIK免疫治疗,在外周血单 状核细胞分离后7~10天进行细胞回输,最低细胞 数量大于1×1010,隔日1次,每周期3次。每周期间 隔1~2月。外周血干细胞动员前及每周期回输后2 月行外周血T细胞亚群检测。所有患者随访至2013 年3月。 1.6 统计学方法
所有数据均以平均值±标准差表示,配对t检 验,采用SPSS 19.0软件包分析,以P<0.05为差异 有统计学意义。 2 结果 2.1 DC和CIK的免疫表型
DC表达CD83、MHC-I、MHC-II、CD80、 CD86(B7-2),CIK表达CD3、CD56。 2.2 治疗前后T细胞亚群的变化
对比治疗前及最后一个周期免疫治疗后2月 的T细胞亚群变化发现,CD3+、CD3+CD4+、 CD3+CD8+、D3+CD16+CD56+、CD8+CD28+ 百分比有明显上升,CD3-CD16+CD56+、 CD4+CD25+、CD8+CD28-百分比有明显下降,但 只有CD3+和CD8+CD28-的变化P值小于0.05,差 异有统计学意义,见表2。
|
|
表2 治疗前和最后1周期免疫治疗2月后外周血T淋巴细胞亚群分析统计结果 Table 2 Peripheral blood T lymphocytes subsets proportions before and after the last treatment |
除2例患者治疗前后ECOG评分无改善外,13 例患者中7例ECOG评分降低1分,4例降低2分。 13例患者中仅2例OS小于3月,分别为2.6和2.3 月,有7例患者在随访结束时仍然存活,OS大于6 月,远远超过预计的3月,见表3。
|
|
表3 DC-CIK治疗前后生活质量及生存期的变化 Table 3 Diversification of ECOG and OS before and after DC-CIK treatment |
下图为编号7的患者贾某,DC-CIK治疗前后 胸部CT的对比,左肺占位明显缩小,见图1。
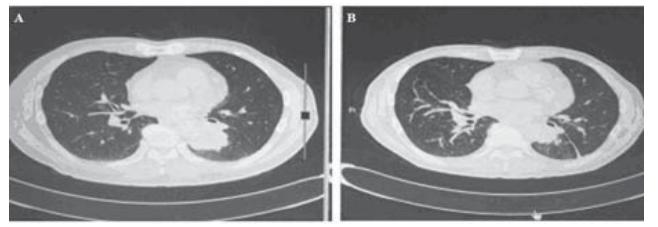 |
A:before treatment;B:after treatment
图1 疗效显著患者治疗前后胸部CT的对比
Figure 1 Chest CT of a typical patient before and after
treatment |
除1例患者(编号5)出现体温为37.9度的低 热外,其余患者均未出现明显不良反应。 3 讨论
DC细胞是机体重要的抗原递呈细胞,在介导 免疫细胞的抗肿瘤活性中起着重要的作用。CIK细 胞是非组织相容性复合物(MHC)和非T细胞受 体(TCR)限制性的免疫活性细胞[ 4 ],既具有T细胞 的抗肿瘤活性又具有NK细胞的非MHC限制性抗 肿瘤作用,抗肿瘤谱广。相对于单独培养的CIK细 胞,DC-CIK的抗肿瘤活性明显增强,增殖速度快 并且凋亡速度慢,CD3+CD56+细胞比例更高[ 5, 6 ], 并且对多药耐药的肿瘤细胞的疗效更好[ 7 ]。
已有多篇文献报道术后联合DC-CIK、化疗 联合DC-CIK的有效性和安全性[ 8, 9 ],但对于预计 生存期小于3月、ECOG评分大于3的晚期患者, DC-CIK治疗报道甚少。晚期肿瘤患者多伴有免 疫缺陷[ 10, 11, 12 ],严重的免疫抑制可能是肿瘤迅速恶 化的原因之一。我们的治疗经验表明,选择DCCIK治疗的晚期患者,在OS延长的同时,ECOG也 有不同程度的改善,并且没有明显的不良反应。 说明对于晚期患者来说,DC-CIK治疗是可选的、 有效的、安全的治疗手段。
肿瘤的发生、发展及预后和机体的免疫功能 尤其是T细胞的免疫功能密切相关[ 13 ] ,T细胞亚群 的构成比能够客观的反映出机体免疫系统对肿瘤 的反应状态。研究表明,许多肿瘤患者存在T淋巴 细胞亚群失衡[ 14, 15 ]。CD3+细胞为总T淋巴细胞,代 表机体总的肿瘤免疫反应状态。我们的研究结果 表明,DC-CIK治疗后,CD3+T细胞的百分比明显 高于治疗前(P<0.05),说明治疗前后患者的机 体对肿瘤的免疫反应状态有所改善。CD8+CD28-即抑制性T细胞(Ts细胞),该细胞通过细胞间直 接接触的特异性免疫抑制及分泌可溶性免疫抑制 因子的非特异性免疫抑制的双重机制抑制机体免 疫功能[ 16 ]。有学者认为,当外周血中CD8+CD28-比例明显增高时意味着肿瘤有恶化或复发的风 险,故CD8+CD28-可作为肿瘤患者预后判断的指 标[ 17 ]。我们的研究结果表明,DC-CIK治疗前后的 晚期肿瘤患者,Ts细胞明显下降(P<0.05),说 明晚期肿瘤患者的免疫抑制状态在治疗后得到一 定改善。本研究目前病例数尚少,随着治疗患者 数目的增加,将有望得到更有说服力的数据。
总之,我们的研究结果表明,对于预计生存 期小于3月的晚期肿瘤患者,尽管DC-CIK治疗难 以获得CR或PR这样的疗效,但可以有效纠正患者 的免疫抑制状态,并由此使患者的生活质量明显 改善,OS显著延长。
| [1] | Cho A. Breakthrough of the year. The discovery of the Higgs boson[J]. Science,2012,338(6114):1524-5. |
| [2] | Lingjun Z, Jing C, Jian L,et al.Prediction of survival time in advanced cancer: a prognostic scale for Chinese patients[J]. J Pain Symptom Manage,2009,38(4):578-86. |
| [3] | Liu Y, Yu SY. Survival prediction of patients with advanced cancer[J]. Zhong Liu,2011,31(2):165-8.[刘勇,于世英.晚期癌症 患者生存期的预测[J].肿瘤,2011,31(2): 165-8.] |
| [4] | Schmidt-Wolf IG, Lefterova P, Mehta BA,et al.Phenotypic characterization and identification of effector cells involved in tumor cell recognition o f cytokine -induced killer cells[J]. Exp Hematol,1993,21(13):1673-9. |
| [5] | Yang L, Ren B, Li H,et al.Enhanced antitumor effects of DCactivated CIKs to chemotherapy treatment in a single cohort of advanced non-small-cell lung cancer patients[J]. Cancer Immunol Immunother.2013,62(1):65-73. |
| [6] | Wang QJ, Wang H, Pan K, et al.Comparative study on anti-tumor immune response of aut- ologous cytokine-induced killer (CIK) cells, dendritic cells-CIK (DC -CIK), and semi-allogeneic DC -CIK[J]. Chin J Cancer,2010,29(7):641 -8. |
| [7] | Li SJ, Zhang LS, Chai Y,et al. Killing activity of co-cultured cytokine-induced killer cells and dendritic against multi-drug resistant tumor cells line[J]. Zhonghua Zhong Liu Za Zhi, 2007,29(10):733-6. [李世俊,张连生,柴晔,等.树突状细胞与 细胞因子诱导的杀伤细胞共培养对多药耐药肿瘤细胞系的杀 伤活性[J]. 中华肿瘤杂志,2007,29(10):733-7.] |
| [8] | Ren J,Di L,Song G,et al.Selections of appropriate regimen of highdose chemotherapy combined with adoptive cellular therapy with dendritic and cytokine-induced killer cells improved progressionfree and overall survival in patients with metastatic breast cancer: reargument of such contentious therapeutic preferences[J]. Clin Transl Oncol,2013,15(10):780-8. |
| [9] | Zhan HL, Gao X, Pu XY,et al.A randomized controlled trial of postoperative tumor lysate-pulsed dendritic cells and cytokineinduced killer cells immunotherapy in patients with localized and locally advanced renal cell carcinoma[J].Chin Med J (Engl),2012, 125(21):3771-7. |
| [10] | Tiwari M. From tumor immunology to cancer immunotherapy: miles to go[J]. J Cancer Res Ther,2010,6(4):427-31. |
| [11] | Duray A, Demoulin S, Hubert P, et al. Immune suppression in head and neck cancers: a review[J]. Clin Dev Immunol,2010,2010: 701657. |
| [12] | Kim R, Emi M, Tanabe K,et al. Tumor-driven evolution of immunosuppressive networks during malignant progression[J]. Cancer Res,2006,66(11):5527-36. |
| [13] | Kuss I, Hathaway B, Ferris RL,et al. Decreased absolute counts of T lymphocyte subsets and their relation to disease in squamous cell carcinoma of the head and neck[J]. Clin Cancer Res,2004,10(11):3755-62. |
| [14] | Decensi A, Costa A. Recent advances in cancer chemoprevention, with emphasis on breast and colorectal cancer[J]. Eur J Cancer, 2000,36(6):694-709. |
| [15] | Lissoni P,Brivio F,Ferrante R,et al. Circulating immature and mature dendritic cells in relation to lymphocyte subsets in patients with gastrointestinal tract cancer[J]. Int J Biol Markers,2000,15(1):22-5. |
| [16] | Li YS,Wang L,Chen XL.Research progress of regulatory CD8+CD28-T cells in biological features and related diseases[J]. Mian Yi Xue Za Zhi,2012,28(8):722-5. [李雅舒,王莉,陈晓玲. CD8+CD28-调节性T细胞的生物学特性及其与疾病的相关性 研究进展[J]. 免疫学杂志,2012,28(8):722-5.]< |
| [17] | Zou W.Immunosuppressive networks in the tumour environment and their therapeutic relevance[J]. Nat Rev Cancer,2005,5(4):263-74. |
 2014, Vol.41
2014, Vol.41





