2.中国人民解放军第二军医大学中 医系中药方剂学教研室,
3.药学院药用植物学教研室;
4.上 海市第七人民医院中心实验室
2.Department of Chinese Materia Medica and Science of Prescriptions,Faculty of Traditional Chinese Medicine, Second Military Medical University,
3.Department of Pharmaceutical Botany, School of Pharmacy;
4.Department of Central Laboratory, Shanghai Seventh People’s Hospital
马齿苋科植物马齿苋(Portulaca oleracea L), 广泛分布全球温带和热带地区,为药食两用植 物,其地上部分为中药马齿苋来源,具有清热解 毒、凉血消肿之功效,临床可用于防治大肠癌、 腹泻、痢疾、尿路感染等多种疾病。马齿苋所含 化学成分包括黄酮类、萜类、香豆素类、生物碱 类、挥发油类和多糖等,其粗提物或有效部位具有 抗肿瘤、保肝、抗菌、抗缺氧、抗氧化、抗病毒、 心律失常、调血脂、降血糖等多种药理作用[ 1 ]。李 玉萍等[ 2 ]通过体外筛选发现,马齿苋总生物碱明 显抑制HeLa细胞增殖,体内试验则显著抑制荷 瘤(S180)小鼠瘤体重量。然而,到目前为止并 没有任何关于马齿苋单体化合物抗宫颈癌的体内 外研究报道,这对进一步深入阐明马齿苋确切的 抗癌作用机制和新药研发具有重要意义。我们先前对马齿苋药材的质量等进行了研究[ 3 ],并从中 分离得到一个新的脑苷脂类化合物马齿苋脑苷A (portulacerebroside A,PCA)。本研究旨在探讨 PCA对宫颈癌HeLa细胞是否具有诱导凋亡和抑制 其侵袭转移的作用,以初步评价其临床应用价值。 1 材料与方法 1.1 实验材料
HeLa细胞(南京凯基生物科技发展有限公司), 磷酸缓冲液(PBS,Hyclone,美国),胎牛血清 (FBS,Hyclone,美国),DMEM细胞培养液、 二甲基亚砜(DMSO)、四甲基噻唑盐(MTT)和 0.25%胰酶(Trypsin)(Sigma,美国),链霉素、 青霉素双抗液(碧云天生物研究所,中国)。 1.2 马齿苋脑苷A的制备
马齿苋脑苷A参照文献方法制备[ 3 ],纯度 98.1%。实验前用DMSO溶解(终浓度<0.5%), 再用培养液稀释至所需浓度。 1.3 细胞培养
HeLa细胞在含体积分数10%胎牛血清,1% 链霉素、青霉素双抗液的DMEM细胞培养液中 37℃、5%的CO2和饱和湿度条件下传代培养,每2 天换培养液1次,细胞生长成片,相互融合铺满瓶 底约80%时进行传代。 1.4 细胞活力
取对数生长期HeLa细胞,0.25%不含EDTA胰 酶消化,加入新鲜培养液吹打,调整细胞浓度2×104/ml,100 μl/孔接种于96孔板中,在5%CO2、 37℃的细胞培养箱内培养12 h,至细胞铺满板底 80%时弃去培养液,加入含不同浓度PCA的培养 液,每个浓度做6个复孔,分别于12 h和24 h两个 不同时间点进行MTT活性检测。每个时间点检测 前再加入0.5%的MTT液20 微升/孔,继续培养4 h 后弃上清液,加入150 μl的DMSO,振荡10 min。 在570 nm检测波长下,自动酶联免疫分析仪测定 吸光度值(OD)。 1.5 凋亡率检测
将HeLa细胞以1×106个/ml的浓度分别接种于 6孔板中,每孔2 ml。DMEM培养液培养12 h后, 加入不同浓度的PCA继续培养12 h。0.25%胰酶消 化,吸弃胰酶,加入培养液终止,用1 ml枪头轻轻 吹打,至细胞成悬浮状。将细胞悬浮液转移至离 心管中,以2 000 r/min离心5 min,弃培养液。PBS 缓冲液洗涤1~2次,2 000 r/min收集细胞,500 μl Binding Buffer 悬浮细胞,加入5 μl Annexin V-FITC 混匀,再加入5 μl Propidium Iodide混匀,室温避光 反应10 min。使用流式细胞仪(FACSCalibur,Becton Dickson,美国)检测细胞凋亡率。 1.6 细胞迁移实验
采用划痕试验法观察PCA对细胞迁移能力的 影响。将HeLa细胞以1×106个/ml接种于6孔板,每 孔2 ml。待细胞覆盖率达到95%时,用10 μl无菌 枪头在孔中央划十字交叉线,PBS洗3次。改用含 不同浓度的PCA培养液(含0.5%胎牛血清)培养 12 h。弃去培养液,PBS清洗,4%多聚甲醛固定15 min,倒置显微镜(CKX41,Olympus,日本)下 观察十字交叉中心附近,随机选5个视野记录细胞 数,以空白组为对照,计算迁移百分比。 1.7 细胞黏附实验
将基质胶(Sigma,美国)30 μl加入96孔培养板 中,干燥1 h后,37℃的PBS液小心冲洗2次,每孔 加入含1%胎牛血清的PBS 100 μl,培养箱中孵育1 h,再以PBS液200 μl冲洗两次。将经不同浓度PCA 预处理12 h的HeLa细胞用无血清DMEM培养液制 成5×105个/ml细胞悬液,加入96孔培养板中,每 孔100 μl,培养箱中孵育0.5、1、1.5 h。培养结束 后,缓慢吸出培养液,PBS小心冲洗未黏附的细胞 2次,加入含2%胎牛血清的DMEM培养液200 μl, MTT法测定OD值。试验同时设含10%胎牛血清培 养的空白对照,以各无血清组OD值/含血清空白组 OD值计算黏附百分率。 1.8 细胞侵袭试验
细胞体外侵袭试验采用Transwell小室进行。 将HeLa细胞用不同浓度PCA预处理12 h,胰酶消化 后配制成5×105个/ml的单细胞悬液,加入侵袭小室 上层,每孔100 μl,下方小室放置500 μl含20%FBS 的DMEM培养液,37℃下孵育8 h后,取出小室, 用湿润棉签擦去底部的基质胶和细胞,甲醛固定 10 min,常规HE染色后于200倍光学显微镜下计数 膜背面侵袭的细胞数,计数中间和四周5个视野, 计算平均数。 1.9 统计学方法
采用SPSS15.0统计学软件进行数据分析,数 据以x±s表示。多组间比较采用方差分析和两组之 间t检验。P<0.05为差异有统计学意义。 2 结果 2.1 对细胞活力的影响
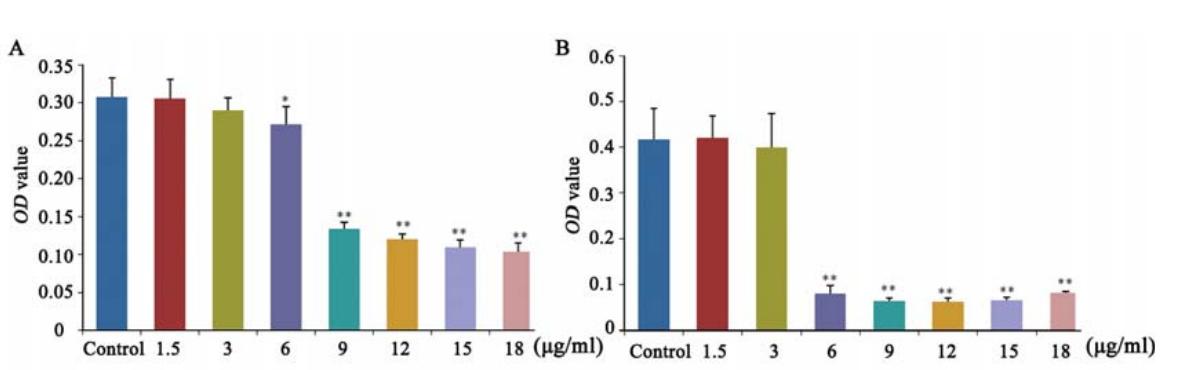
本实验考察了7个不同给药浓度(1.5、3、6、 9、12、15和18 μg/ml)和2个不同时间点(12 h和24 h)PCA对HeLa细胞活力的影响。给药浓度等 于或高于6 μg/ml时,细胞活力被显著抑制,且随 给药时间的延长抑制作用愈加明显,与空白组比 较差异有统计学意义(P<0.05或0.01),见图1。
 |
*:P<0.05 vs.control group, **:P<0.01 vs. control group
图1 马齿苋脑苷A作用12 h(A)和24 h(B)后对HeLa细胞活力的影响
Figure 1 Effects of PCA on viability of HeLa cells after treatment for 12 h(A) and 24 h(B) |
流式细胞仪凋亡检测结果显示,正常空白组 凋亡率为仅8.2%(右上限+右下限)。但给予PCA (6、9、12 μg/ml)处理12 h后,HeLa细胞凋亡率 显著升高,3个浓度组分别为20.63%、51.27%和 67.32%,且呈剂量依赖关系,见图2。
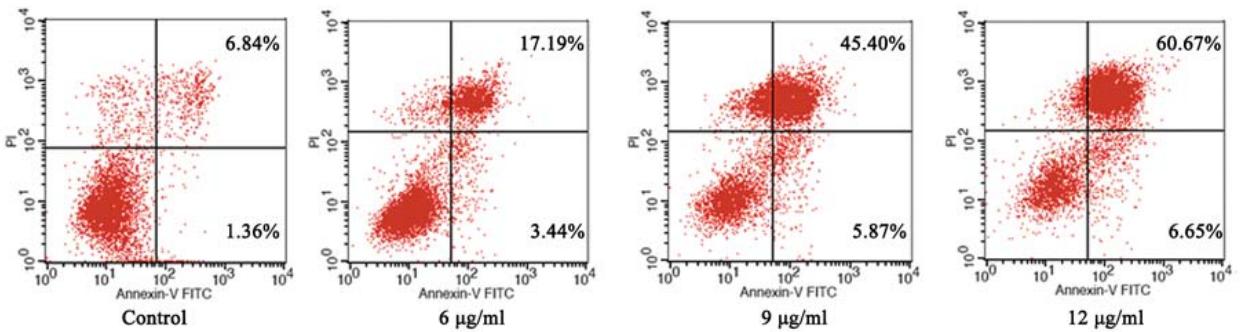 |
图2 马齿苋脑苷A作用12 h后对HeLa细胞凋亡率的影响 Figure 2 Effects of PCA on apoptosis of HeLa cells after treatment for 12 h |
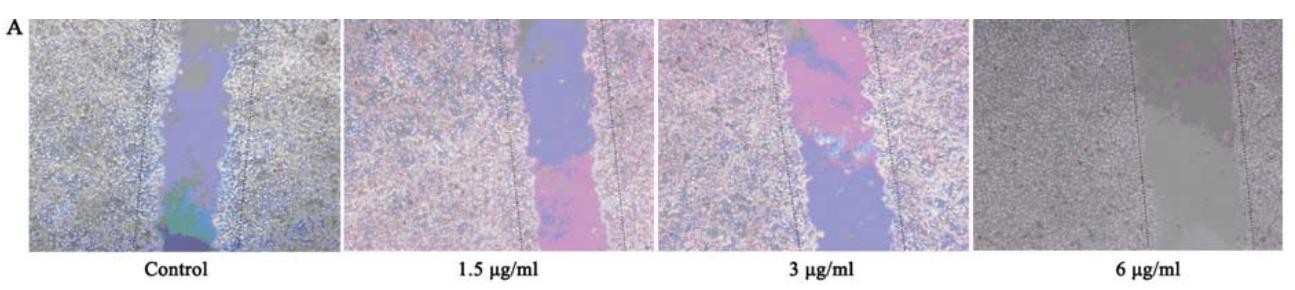
划痕实验结果显示,经PCA处理12 h后HeLa细 胞迁移能力显著降低,与空白组比较,细胞迁移数 量显著减少,迁移百分率显著降低,差异有统计学 意义(P均<0.01),且呈剂量依赖性,见图3。
 |
**:P<0.01 vs.control group
图3 马齿苋脑苷A作用12 h后对HeLa细胞迁移的影响
Figure 3 Effects of PCA on migration of HeLa cells after treatment
for 12 h |
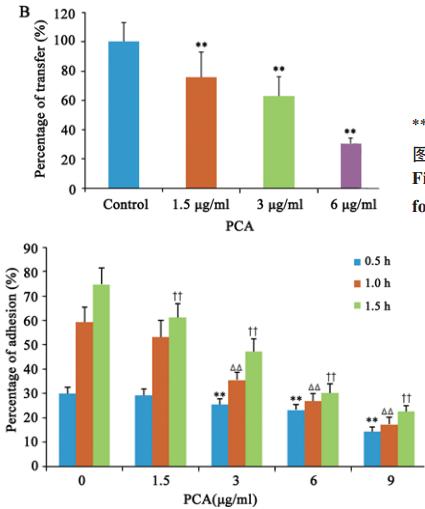
实验考察了PCA4个剂量作用12 h后在0.5、1、 1.5 h对HeLa细胞黏附率的影响,见图4。结果发现, 除1.5 μg/ml剂量0.5 h和1 h外,其余各组在3个时间 点均显著降低细胞黏附百分率(与空白组比较,P 均<0.01),提示其明显的抑制细胞黏附能力。
 |
**, ΔΔ, ††: P<0.01 vs.corresponding control groups
图4 马齿苋脑苷A作用不同时间后对HeLa细胞黏附百分
率的影响
Figure 4Effects of PCA on adhesion rate of HeLa cells
after treatment for different time |
细胞在一定时间内穿过基质胶的数量可反映 其侵袭能力。本实验结果显示不同浓度PCA预 处理12 h后,HeLa细胞穿过基质胶的数目显著 降低,与空白组比较差异有统计学意义(P均< 0.01),见图5。
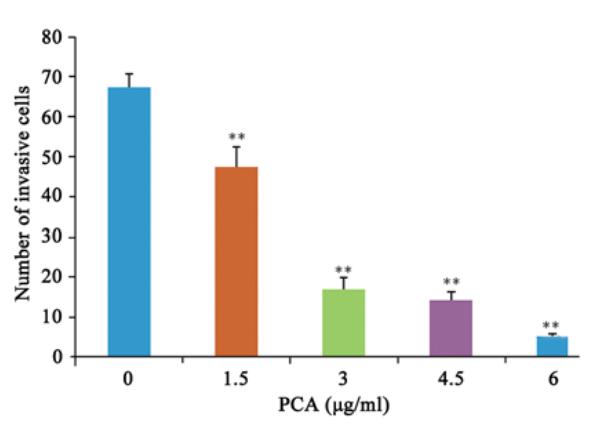 |
**: P<0.01 vs.control group
图5 马齿苋脑苷A作用12 h后对HeLa细胞穿膜细胞数的影
响
Figure 5 Effects of PCA on invasion number of HeLa cells
after treatment for 12 h |
癌症引起人体死亡不仅涉及肿瘤细胞恶性增 殖,更与其侵袭转移密切相关,理想的治疗药物 应既能抑制肿瘤细胞增殖,又能阻止其侵袭和转 移。已有一些中药单体成分被报道同时具有这两 方面的作用,如50~600 μM浓度的白藜芦醇可抑制 宫颈癌细胞(SiHa、HeLa和C33A)增殖和诱导凋 亡[ 4 ],250~1 000 μM浓度则减少Transwell侵袭试验 中HeLa细胞小室底膜穿过数[ 5 ]。10、20、40 μM浓 度的三氧化二砷(As2O3)可通过增加活性氧和降 低线粒体膜电位诱导宫颈癌细胞(HeLa)凋亡 [ 6 ], 5 μM浓度抑制宫颈癌细胞(HeLa,SiHa,Caski)的黏 附、侵袭和迁移[ 7 ]。然而,同时具有这两方面作用 的中药单体化合物并不多,而且这些化合物不是使用剂量较大就是对人体具有剧烈的毒性,难以 进一步在临床推广应用。
马齿苋苷A为我们首次从中药马齿苋中分离 得到脑苷脂类的新化合物,经采用经典的体外实 验方法,包括MTT法、流式细胞凋亡检测、划痕 试验、Transwell法和黏附试验等实验证实,PCA 较低剂量即能显著诱导HeLa细胞凋亡,明显抑制 其侵袭和转移,提示其良好的抗宫颈癌作用。然 而,PCA诱导宫颈癌HeLa细胞凋亡和抑制其侵袭 转移的分子作用机制尚需进一步研究。
| [1] | Xie SY,Pang MF, Sun Y,et al. Recent progress on chemical constituents of Portulaca oleracea L. and their pharmacological effects [J]. Xian Dai Yao Wu Yu Lin Chuang,2011,26(3):212-5. [解思友,逢美芳,孙艳,等.马齿苋的化学成分与药理作用最新研究进展[J].现代药物与临床,2011,26(3):212-5.] |
| [2] | Li YP, Zeng XW, Ye J, et al. Screening antitumor effect of active constituents from portulaca oleracea L.in vitro and in vivo[J]. Shizhen Guo Yi Guo Yao, 2009,20(11):2726-7. [李玉萍,曾宪伟, 叶军,等. 马齿苋活性成分体内外抗癌作用的初步筛选[J].时珍 国医国药,2009,20(11):2726-7.] |
| [3] | Xin HL, Hou YH, Li M, et al. α-Linolenic acid and linoleic acid in extract of portulaca oleracea L. determined by high-performance liquid chromatography[J].Zhong Xi Yi Jie He Xue Bao,2008, 6(11): 1174-7.[辛海量, 侯银环, 李敏, 等. 高效液相色谱法测定 马齿苋提取物中α-亚麻酸和亚油酸的含量[J]. 中西医结合学报, 2008, 6(11): 1174-7.] |
| [4] | Shen X, Lv SL, Zhang J, et al. Effects of Res on proliferation and apoptosis of human cervical carcinoma cell lines C33A, SiHa and HeLa[J]. J Med Coll PLA, 2009, 24(3): 148-54. |
| [5] | Dong DG,Guo EM,Zhang Y,et al. Effects of resveratrol on the expressions of matrix metalloprteinase and tissue inhibitors of metalloproteinase in cervical cancer HeLa cells [J]. Zhonghua Zhong Liu Fang Zhi Za Zhi,2007,14(7):489-93. [董德刚, 郭恩绵, 张瑶,等. 白藜芦醇对宫颈癌HeLa细胞基质金属蛋白酶及其组 织抑制剂的影响[J].中华肿瘤防治杂志,2007,14(7):489-93.] |
| [6] | Woo SH, Park IC, Park MJ, et al. Arsenic trioxide induces apoptosis through a reactive oxygen species-dependent pathway and loss of mitochondrial membrane potential in HeLa cells[J]. Int J Oncol, 2002, 21(1): 57-63. |
| [7] | Yu J, Qian H, Li Y, et al. Arsenic trioxide (As2O3) reduces the invasive and metastatic properties of cervical cancer cells in vitro and in vivo[J]. Gynecol Oncol, 2007, 106(2): 400-6. |
 2014, Vol.41
2014, Vol.41



