2.中南大学湘雅医学院检验系;
3.中南大学湘雅医院 肿瘤科
2. Inspection Department, Xiangya School of Medicine, Central South University;
3. Department of Oncology, Xiangya Hospital, Central South University
原发性肝细胞癌( hepatocellular carcinoma, HCC) 是最常见的恶性肿瘤之一。研究表明乙型肝 炎病毒(hepatitis B virus,HBV)X基因(HBx)编码的 X蛋白与HCC的发生、发展密切相关[ 1 ]。HBx具有 多种生物学功能,如参与病毒的复制、反式激活多种病毒和细胞基因、通过影响正常细胞周期干扰 DNA的修复及调节肝细胞增殖、分化和凋亡等, 但具体的致癌机制尚未明确[ 2 ]。p53蛋白可通过其 下游转录产物p21影响细胞的凋亡与周期,认为与 多种肿瘤的发病密切相关。本研究首先建立稳定 转染X基因及空载体的HepG2细胞株,分别记为 HepG2X及HepG2X0,其次通过HBx与p53-p21途径 的作用关系来验证其对肝癌细胞癌变机制的影响。 1 材料与方法 1. 1 实验材料
细胞株及真核载体:肝癌HepG2细胞株购自湘 雅医学院细胞中心;真核表达载体PCDNA3.1(+)- X由本实验室构建[ 3 ];小牛血清RPMI1640培养液购 自Gibco公司;Lipofectamine2000和G418均购自武 汉晶美生物工程有限公司;HBx单克隆抗体购自 Abcam公司;辣根酶标记羊抗鼠IgG、鼠抗人P53 单抗购自北京中杉金桥生物公司;Anti-β-actin购 自北京BIOS公司;Trizol 试剂购自上海生工;RTPCR试剂盒购自Ferments公司;p21引物由上海生 工合成;流式细胞检测送北京鼎国生物公司检测。 1.2 实验方法 1.2.1 细胞培养
人肝癌细胞株HepG2细胞培养 于含10%小牛血清的DMEM100 ml培养瓶中。内 含青霉素100 u/ml、链霉素100 mg/L。待细胞生 长呈单层铺满瓶底时,用0.25%的胰蛋白酶(含 0.02%EDTA) 消化传代。 1.2.2 基因转染
将真核表达载体pCDNA3.1-X及 空载体pCDNA3.1 2 μg与脂质体10 μl混合,转染入 对数生长早期的HepG2细胞。用含400 μg/ml致死 量的G418的培养液筛选2周,极少数存活细胞继续 在37℃、5%CO2 、饱和湿度下培养3周,并用含 200 μg/ml半致死量G418的培养液加以维持,逐渐 形成细胞克隆。小心用细胞刮刀刮取10个细胞克 隆,分别转移至10个25 ml的小培养瓶中,用胰酶 消化吹打成单细胞悬液,继续用半致死量的G418 培养液培养,约一周后长满培养瓶。 1.2.3 Western blot检测X蛋白在HepG2X细胞株中 的表达
用含10%胎牛血清(FCS)的DMEM培养液 清洗,再加入含10%FCS的DMEM,离心收集各 转染组及空质粒组细胞,取100 μl细胞裂解液(含 PMSF10 μl)充分裂解细胞。15%SDS/PAGE电泳 后电转移至硝酸纤维膜上,经过5%脱脂奶粉封闭。 首先与一抗(鼠抗人Anti-HBx,1:1 000稀释)温育 2 h,充分洗涤后,再与二抗(羊抗鼠,1:10 000稀 释)室温孵育2 h,DAB显色。 1.2.4 转染细胞的细胞生物学检测 1.2.4.1 转染细胞生长曲线测定
HepG2、空质粒 组及转染细胞制成单细胞悬液,按每孔3×103个细胞 的密度接种于24孔板,细胞计数连续7 d。每组实 验均重复3次,取均数进行生长曲线的绘制。 1.2.4.2 平板克隆形成实验
消化对数期生长的细 胞,按每孔1 000个细胞的密度接种于6孔板,移入 CO2孵箱培养2周。甲醇固定,姬姆萨染液染色。计 数大于50个细胞的克隆数,按下面公式计算:克隆 形成率(%) =克隆数/接种细胞数×100%。各组实验 均重复3次。 1.2.5 细胞周期和细胞凋亡检测
消化对数期生 长的细胞,PBS充分洗后,收集1 ×106细胞经乙醇固 定,加碘化丙啶,经流式细胞仪检测细胞周期;细胞 凋亡检测取1×105细胞按试剂盒说明进行,依次加入 碘化丙啶,上流式细胞仪检测,同时采用无血清 诱导24 h检测各转染组细胞凋亡状态。 1.2.6 Western blot检测p53蛋白
用Western blot 分别检测HepG2、空质粒组及转染组p53蛋白的表 达,p53蛋白检测方法同X蛋白检测。一抗1:400稀 释,二抗1∶10 000稀释。 1.2.7 RT-PCR检测p21mRNA水平
Trizol试剂提 取细胞总RNA,操作按说明书进行。采用随机引 物方法进行反转录,PCR进行cDNA 扩增。PCR 引 物序列:上游引物:5'-AGGTGAGGGGACTCCA AAGT-3';下游引物:5'-TGCCTACAGCCTCCTAA TAC-3’。反应条件:94℃,5 min; 94℃2 min,56℃ 2 min,72℃1 min,共30 个循环;最后72℃延伸5 min。扩增片断大小: 200 bp左右。β-actin引物序列: 上游引物5'-AGCGAGCATCCCCAAAGTT-3’;下 游引物5’-GGGCACGAAGGCTCATCATT-3’,扩增 条件同上。扩增产物用1.2%琼脂糖凝胶电泳,紫外 分析仪观察结果,凝胶成像系统照相。 1.3 统计学方法
应用SPSS15.0软件进行统计学分析,数据采用 student T检验分析,以P<0.05为差异有统计学意义。 2结果 2.1 基因转染
转染pcDNA3.1(+)-X株(即HepG2X细胞株)及转 染空载体的HepG2细胞(即HepG2X0细胞株)经G418 筛选后,两周后形成细胞克隆,见图1,而未转染 的细胞株死亡。HepG2X0及HepG2X细胞均形成细 胞克隆,但后者凋亡小体明显增多。
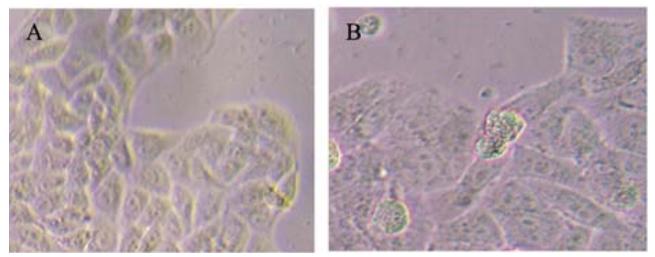 |
A: HepG2X0cell clone;B:HepG2X cell clone
图1 G418筛选细胞克隆图(×400)
Figure 1 Cell clone selected by G418(×400) |
在转染了X基因的10个HepG2X细胞克隆中,X 蛋白仅在1个克隆中有表达,蛋白表达于约21 kD处, 见图2。说明X基因已成功转染入HepG2细胞株。
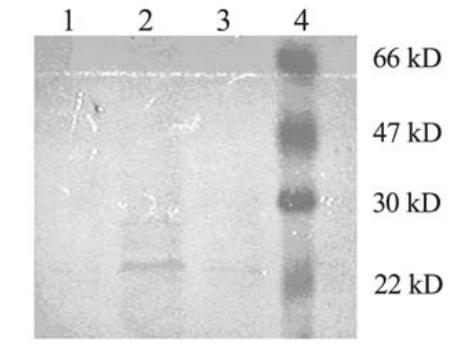 |
1:HepG2;2:HepG2X;3:HepG2X0;4:prestained marker
图2 Western blot检测X蛋白表达
Figure 2 X protein expression detected by Western blot |
HepG2X细胞株较 其他两株细胞生长快,倍增时间缩短,而其他两 株细胞基本一致,见图3 。
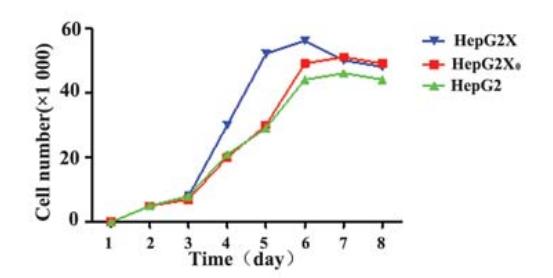 |
图3 HepG2、HepG2X0、及HepG2X三株细胞生长曲线图 Figure 3 Cells growth curves of HepG2, HepG2X0and HepG2X stains |
基因(HepG2)、转染空载体(HepG2X0)及稳定表 达X蛋白(HepG2X)的肝癌细胞亲本细胞各2 000 个/皿,接种于培养皿,培养2周后可见细胞集落形 成,姬姆萨染色,计算克隆形成率,分别为69.6%, 39.9%和42.0%,见图4。T检验显示,HepG2X细胞 株形成率较其他两株细胞高,并且差异有统计学 意义(P<0.05) ,HepG2X0克隆形成率与HepG2细胞 克隆形成率相近,差异无统计学意义(P>0.05)。
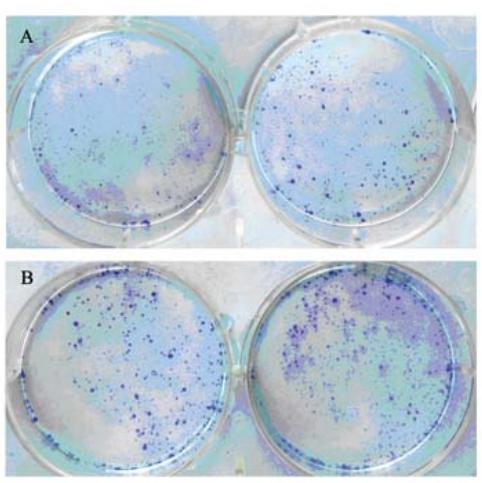 |
A:HepG2 and HepG2X0 plate clone formatting experiment; B:HepG2X
plate clone formatting experiment
图4 平板克隆形成试验检验HepG2、HepG2X0、
HepG2X三株细胞系单克隆形成能力
Figure 4 Plate clone formatting experiments inspect the
monoclonal formation ability of HepG2、HepG2X0 and
HepG2X |
HepG2、HepG2X0及HepG2X细胞的凋亡率依次为 1.23%、5.07%及13.0%,表明HepG2X细胞比其他 两株细胞的凋亡明显增加,见图5。
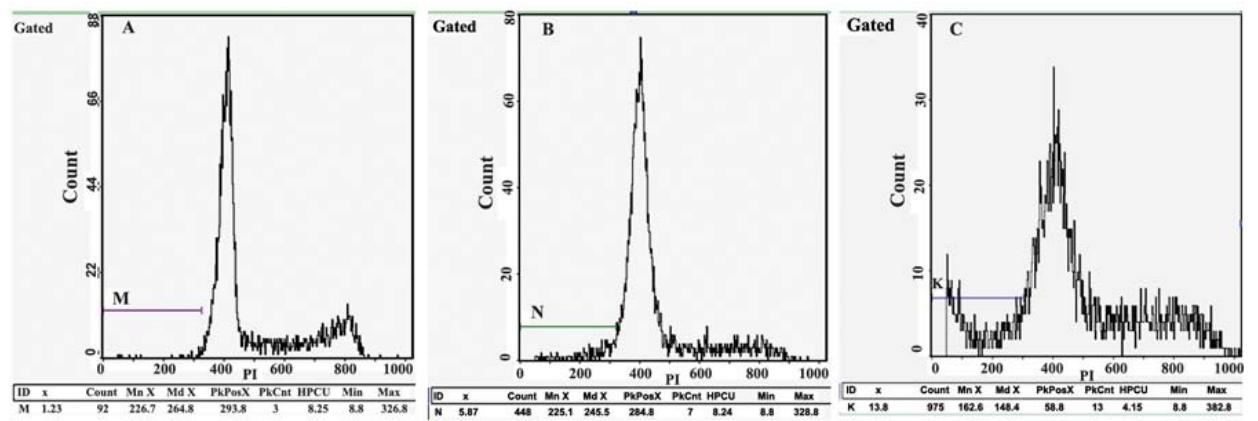 |
A:untreated HepG2 cell apoptosis;B:HepG2X0cell apoptosis;C:HepG2X cell apoptosis
图5 流式细胞仪检测转染后HepG2、HepG2X0和HepG2X细胞的凋亡水平
Figure 5 HepG2,HepG2X0and HepG2X cell apoptosis after transfection detected by flow cytometry |
以上三株细胞在53 kD处均见蛋白表达,三 次上样的HepG2X细胞中P53表达均强于HepG2及 HepG2X0细胞(P<0.0001)。而后两株细胞P53蛋白 表达未见明显差异,见图6。
 |
图6 HepG2X、HepG2X0及HepG2细胞中P53蛋白 Western blot检测 Figure 6 p53 protein expression in HepG2X, HepG2X0and HepG2 detected by Western blot |
约200 bp处可见p21mRNA的PCR产物片段, HepG2X较其他两组细胞p21mRNA水平明显减 低,见图7。
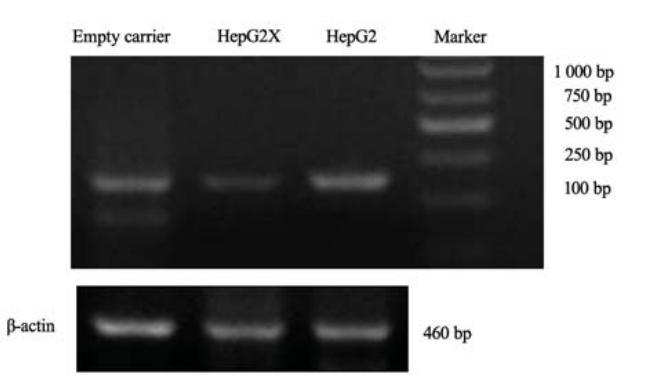 |
图7 RT-PCR检测HepG2、HepG2X及HepG2X0细胞中 p21mRNA的表达 Figure 7 p21mRNA expression in HepG2, HepG2X and HepG2X0detected by RT-PCR |
原发性肝癌是最常见的恶性肿瘤之一,其发生 与发展与HBV感染密切相关,特别是HBx基因编 码的X蛋白具有反式激活作用,可激活病毒和细胞 基因,调控其转录,与病毒复制和慢性感染状态的 维持相关,在HCC的发生发展过程中具有重要作 用[ 4 ]。为研究X蛋白对肝癌细胞恶性表型的影响, 本研究将HBx基因真核表达载体PCDNA3.1-X及空 载体PCDNA3.1用脂质体介导法分别转入肝癌细胞 HepG2,并经G418筛选获得稳定表达X蛋白的肝癌 细胞克隆株HepG2X及HepG2X0。Western blot证实 X蛋白能在转染株HepG2X中表达,而在对照组细 胞中不表达。有研究[ 5 ]表明,HBx蛋白有促进与抑 制凋亡的双重作用,这与本研究的结果一致。细 胞生长实验表明HepG2X株生长的倍增时间明显短于HepG2及HepG2X0细胞株,克隆形成率亦高于对 照组亲本细胞,表明稳定表达X蛋白的肝癌细胞恶 性表型增高,有抑制凋亡的作用。但流式细胞结 果显示,转染株HepG2X比只转染空载体HepG2及 HepG2细胞株凋亡率明显增加,细胞周期结果显示 HepG2X细胞G2/G1比值增加,表明转染组的增殖期 细胞增多,细胞DNA合成旺盛。形态学上转染株 细胞生长力旺盛、分裂相极多见,凋亡小体明显增 多,表明HBx蛋白同样具有促进凋亡作用,使肝癌 细胞恶性表型增加。大量研究表明,HBx参与细胞 凋亡的具体机制可能与p53-p21调节途径有关[ 6, 7, 8 ]。
p53基因定位于17p13.1,编码具有蛋白质-蛋 白质结合功能的p53蛋白。该基因及其表达产物 分为野生型与突变型两种。含野生型p53的细胞在 DNA受到损伤时可使细胞停止于G1期以修复损伤 的DNA,从而抑制凋亡的发生。HBxAg与p53可 以结合形成复合物的形式使p53蛋白在细胞内积聚 的现象也见于Kwun等[ 7 ]及Mathonnet等[ 8 ]的研究结 果,而本研究表明稳定转染X基因的HepG2细胞株 后p53蛋白表达明显高于未转染的HepG2细胞株, 两者研究结果一致。HBx与p53 结合后,可导致 p53基因的突变而失活,从而使后者正常的抑制凋 亡的活性下降。Western blot结果显示,HepG2X细 胞p53含量比HepG2及转染空载体的HepG2细胞株 增加。p53基因可与细胞内的转录因子p21结合,起到活化与调节作用[ 9 ]。p21作为p53基因的下游 转录激活产物,具有抑制细胞周期素/细胞周期 依赖性激酶的作用,导致G1期阻滞,以修复损伤 的DNA [ 10 ]。由于p53的失活,其活化p21的功能减 退。RT-PCR结果表明HepG2X细胞中p21 mRNA水 平减低,从而使p53通过p21来修复损伤的DNA途 径进一步受阻,最终导致细胞的恶性表型增加。 但X基因与p53-p21途径具体的信号转导机制仍有 待进一步研究。
| [1] | Wei W, Huan g W, Pan Y,et al. Functional switch of viral protein HBx on cell apoptosis,transformation, and tumorigenesis in association with oncoprotein Ras[J].Cancer Lett,2006,244(1):119-28. |
| [2] | Lee MO, Kang HJ, Cho H,et al.Hepatitis B virus X protein induced expression of the Nur77 Gene[J].Biochem Biophy Res Commun,2001,288(5):1162-8. |
| [3] | Cao PF,Liu YH. Expression of raf-1 in HepG2 strain stably transfected by HBx gene[J].Zhong Liu Yan Jiu Yu Lin Chuang,2007, 19(11):724-6. [曹鹏飞,柳永和. 稳定转染HBx基因的HepG2细胞对 raf-1表达的影响[J].肿瘤研究与临床, 2007,19(11):724-6.] |
| [4] | Yu DH,Lin J,Qu JH,et al. Hepatitis B virus X protein inhibits hepatoma cell growth in vitro through p14(ARF)-dependent and p14(ARF)-independent pathways[J]. Nan Fang Yi Ke Da Xue Xue Bao,2009,29(6):1089-93.[余党会,林静,曲建慧,等.乙型肝炎病毒X 蛋白和p14ARF依赖性、非依赖性途径对肝癌细胞生长的影响 |
| [5] | Wang F, Zhou H, Xia X,et al. Activated Notch signaling is required for hepatitis B virus X protein to promote proliferation and survival of human hepatic cells[J]. Cancer Lett, 2010,298(1):64-73. |
| [6] | Livezey KW, Negorev D, Simon D. Hepatitis B virustransfected Hep G2 cells demonstrate genetic alterations and de novo viral integration in cells replicating HBV[J].Mutat Res,2000,452(2):163-78. |
| [7] | Kwun HJ, Jang KL.Natural variants of hepatitis B virus X protein have differential effects on the expression of cyclin-dependent kinase inhibitor p21 gene[J].Nucleic Acids Res, 2004, 32(7): 2202-13. |
| [8] | Mathonnet G, Lachance S, Alaoui-Jamali M, et al. Expression of hepatitis B virus X oncoprotein inhibits transcription-coupled nucleotide excision repair in human cells [J].Mutat Res,2004,554 (1-2):305-18. |
| [9] | Han HJ, Jung EY, Lee WJ,et al.Cooperative repression of cyclindependent kinase inhibitor p21 gene expression by hepatitis B virus X protein andhepatitis C virus core protein[J].FEBS Lett, 2002,518(1-3):169-72. |
| [10] | Zhang SJ, Chen HY, Chen ZX,et al.Possible mechanism for hepatitis B virus X gene to induce apoptosis of hepatocytes[J].World J Gastroenterol, 2005,11(28):4351-6. |
 2014, Vol.41
2014, Vol.41
