2.内蒙古医科大学研究生学院
2.Graduate School of Inner Mongolia Medical University
过氧化物酶体增殖物激活受体gamma(PPARγ) 是一种配体激活的转录因子,它的配体可分为合 成配体和天然配体两类。其中15-脱氧前列腺素J2 (15-Deoxy-delta12,14-prostaglandin J2,15d-PGJ2) 是一个重要的天然PPARγ配体[ 1 ]。最近研究表明,PPARγ 除了有参与调节脂肪代谢、脂肪细胞分 化、动脉粥样硬化形成、肥胖、糖尿病及炎性反 应的病理过程等经典作用外,与肿瘤的形成也有 密切关系,其配体在一些肿瘤通过抑制增殖、诱 导凋亡、诱导终端分化、抑制转移和血管的形成 等,具有抗肿瘤作用[ 2, 3, 4, 5, 6, 7 ]。我们前期在体外的研究 显示,PPARγ的天然配体15d-PGJ2通过下调抑制 凋亡的蛋白survivin、细胞周期中S期激酶相关蛋 白2(Skp2)和上调细胞周期素依赖激酶抑制剂 p27蛋白诱导人胃癌细胞凋亡及将胃癌细胞阻滞在 细胞周期的G0/G1期,抑制人胃癌细胞的生长[ 8 ]。
可见,PPARγ的天然配体15d-PGJ2可能对治疗胃 癌有效。那么,PPARγ的天然配体15d-PGJ2在体 内是否能抑制人胃癌细胞生长,是否也通过调节 survivin、p27和Skp2的表达呢?目前有研究认为 细胞表面跨膜糖蛋白CD44表达阳性的瘤细胞为胃 癌的干细胞[ 9 ]。那么,PPARγ的天然配体15d-PGJ2 在体内对胃癌干细胞的生长是否有影响呢?这些 有待进一步探讨。为此,本实验将应用人胃癌细 胞建立裸鼠移植瘤模型,探讨在体内15d-PGJ2应用 后,是否能抑制人胃癌细胞生长;探讨15d-PGJ2是 否能调节survivin、Skp2、p27的mRNA及蛋白表达 变化,探讨15d-PGJ2是否能影响人胃癌细胞裸鼠移 植瘤组织中CD44表达阳性瘤细胞量的变化,探讨 15d-PGJ2对人胃癌干细胞生长的影响,为15d-PGJ2 能否用于治疗胃癌以及机制提供可靠体内依据。 1 材料与方法 1.1 细胞培养与裸鼠饲养
人胃癌MGC803细胞购于北京市肿瘤研究所, 细胞保持在RPMI 1640培养液,并辅以10%的新 胎牛血清,于37℃、5% CO2培养箱内培养。1 mg 15d-PGJ2(Cayman USA) 溶解在40 μmol/ L二甲基 亚砜( dimethyl sulfoxide,DMSO) 中,用PBS稀释至 40 μmol/ L时,DMSO的终浓度为0.047%。BALB/ c-nu裸鼠4~5周龄、体质量15~18g、雄性,由中 国医学科学院实验动物繁殖场提供,其特性已鉴 定,动物合格证号:SCXK(京)2005-0013,在 恒温(25℃~27℃)、恒湿(45%~50%)的SPF层流室中 饲养。 1.2 裸鼠皮下移植瘤模型的建立
取12只裸鼠,将对数生长期的人胃癌MGC803 细胞,制成5×107/ml的细胞悬液,按每只裸鼠0.2 ml分别注入裸鼠右上肢背部皮下。待长出肉眼可 见的小结节,将12只裸鼠随机分为对照组和实验 组两组,每组6只。对照组裸鼠尾静脉每天给予 DMSO的终浓度为0.047%的PBS,实验组裸鼠通 过尾静脉按5 mg/kg每天给予15d-PGJ2 [ 10 ]。每日观 察并记录肿瘤形态、大小和体积,计算肿瘤体积 V=ab2/2(a:最大径,b:最小径)[ 11 ],及肿瘤体积抑 制率=(对照组体积-实验组体积)/对照组体积×100% [ 12 ] ,并绘制肿瘤生长曲线。给予15d-PGJ221 次后的第4天处死裸鼠,取出肿瘤组织和裸鼠的肝 脏、脾脏和肾脏,将一部分肿瘤组织以10%的甲醛 溶液固定,用于HE染色后病理学诊断和CD44免疫 组织化学检测;一部分用液氮速冻,用于Western blot和RT-PCR检测。将裸鼠的肝脏、脾脏和肾脏 以10%的甲醛溶液固定,用HE染色后观察有无损 伤。 1.3 RT-PCR检测皮下移植瘤组织survivin、Skp2 和p27 mRNA 的表达
将用液氮速冻的瘤组织在研钵中研磨成粉 末,以Trizol 试剂(invitrogen)提取总RNA,经 紫外分光光度计定量RNA,琼脂糖凝胶电泳验 证RNA 完整性。RT-PCR 两步法(杭州博日)进行 目的基因的扩增,β-actin为内参。survivin引物序 列上游: 5’-GGACCACCGCATCTCTACAT-3’,下 游:5’-GCACTTTCTTCGCAGTTTCC-3’。 扩增 片段长度338bp。Skp2:上游5’-GCTGCTAAAG GTCTCTGGTGT-3’;下游5’-AGGCTTAGATTC TGCAACTTG-3’,扩增片段长度:291bp。p27: 上游5’-CCGACGATTCTTCTACTCAA-3’,下游 5’-GAGGCAGATCATTTAAGAGTG-3’,扩增片段 长度为316bp。β-actin:上游5’-ATCTGGCACCAC ACCTTCTACAATGAGCTGCG-3’,下游5’-CGTC ATACTCCTGCTTGCTGATCCACATCTGC-3’。扩 增片段长度为838bp,survivin PCR反应条件94℃ 预变性5 min,40个循环( 94℃30s—59℃30s—72℃ 30s) ,72℃ 最后延8 min,Skp2 PCR反应条件: 94℃ 预变性4 min,31个循环(94℃30 s—58℃ 30 s—72℃ 1 min),72℃ 延伸7 min,p27 PCR反应 条件:94℃ 预变性4 min ,扩增33个循环(94℃ 30s—60℃30s—72℃1 min),72℃ 延伸7 min。 β-actin PCR 条件:94℃ 预变性5min,35个循环( 95℃15s—60℃1min—72℃30s) ,72℃ 最后延伸7 min,扩增产物经琼脂糖凝胶电泳,凝胶扫描仪行 DNA 电泳条带扫描。 1.4 Western blot检测皮下移植瘤组织survivin、 Skp2和p27蛋白的表达
将用液氮速冻的瘤组织在研钵中研磨成粉末,倒入匀浆器,加入蛋白裂解液(碧云天生物技术研 究所),反复抽吸成蛋清状,冰上裂解1 h,4 ℃、 14 000 g/min 离心5 min,取上清液,采用紫外分 光光度法测定总蛋白浓度。取40μg 蛋白进行聚丙 烯酰胺凝胶电泳,电转移至PVDF 膜上,5%脱脂 奶粉封闭非特异性抗原,分别加入1:500 稀释的 兔抗人Survivin抗体(Santa Cruz)多克隆抗体, 1:100稀释的Skp2抗体(Zymed USA),1:30的P27 鼠抗人抗体(Santa Cruz)和β-actin 抗体(Santa Cruz),4℃过夜。用含0.1%Tween 20 的TBS 洗 膜,加入1:1 000 稀释的辣根过氧化物酶标记的二 抗,室温下作用1 h,洗膜后化学发光法显色,将 条带结果进行扫描。 1.5 免疫组织化学SP方法检测裸鼠移植瘤组织中 CD44表达阳性细胞量的变化
采用标准非生物素辣根过氧化物酶(NONBIOTIN HRP)免疫组织化学两步法(ZYMED)。用 橘橼酸缓冲液(0.01M,pH6.4)在800W微波炉热 抗原修复12min。鼠抗人单克隆抗体CD44(1:80 稀 释,Santa Cruz) 4℃孵育过夜。DAB显色,苏木精 对比染色细胞核。每次以PBS代替一抗作为阴性对 照。用已知阳性的切片作为阳性对照。在光学显 微镜下,对每张切片在高倍镜(×400)下计数15 个视野。CD44以细胞质出现棕黄色颗粒为阳性。 在肿瘤处选取CD44染色好的区域,至少10个高倍 镜视野(×400),计数1 000个细胞,计算阳性细胞 所占的百分率,作为CD44的阳性率(%),阳性 率(%)=阳性细胞数/总细胞数×100%,每例标本 重复三次,取其平均值。 1.6 统计学方法
采用SPSS13.0软件进行统计学分析。所有结 果以均数±标准差(x±s)表示,两组间均数比较 采用t检验,P<0.05为差异有统计学意义。 2 结果 2.1 人胃癌MGC 803细胞建立的裸鼠皮下移植瘤
人胃癌MGC 803细胞接种于12只裸鼠皮下, 在接种后第7天,均出现肉眼可见的小丘样隆起。 裸鼠生长状态良好,饮食及活动正常,无其他明 显不良反应。 2.2 15d-PGJ2对裸鼠皮下移植瘤生长的影响
接种人胃癌MGC 803细胞的第10天(即开始 给予15d-PGJ2第4天后),两组裸鼠移植瘤体积逐 渐出现变化,第12天,实验组裸鼠移植瘤平均体 积为(25.01±11.24)mm3,对照组裸鼠移植瘤平 均体积为(79.39±59.09)mm3。第14天开始,实 验组的裸鼠移植瘤体积(47.75±18.50)mm3显著 低于对照组(167.07±108.07)mm3,生长速度明 显慢于对照组,差异有统计学意义(P<0.05),其皮 下移植瘤明显小于对照组裸鼠,见图1。实验结 束时(即给予15d-PGJ216次后的第3天;即接种 人胃癌MGC 803细胞的第25天)实验组和对照组 肿瘤体积分别为(573.86±242.90)mm3和(1206.46 ±272.22) mm3,前者明显小于后者(P<0.05), 15d-PGJ2对实验组裸鼠移植瘤的体积抑制率为(53.71 ±5.8)%。以接种胃癌MGC 803细胞天数为横坐标, 测量并计算肿瘤体积为纵坐标,绘制肿瘤生长曲 线,见图2。从肿瘤生长的曲线可以看出,随着 15d-PGJ2作用时间的延长,两组曲线升高趋势和 速度出现变化,即实验组的裸鼠肿瘤生长受到抑 制。从每天测量裸鼠体积的数据也可计算出对照 组和实验组裸鼠皮下移植瘤的平均体积。
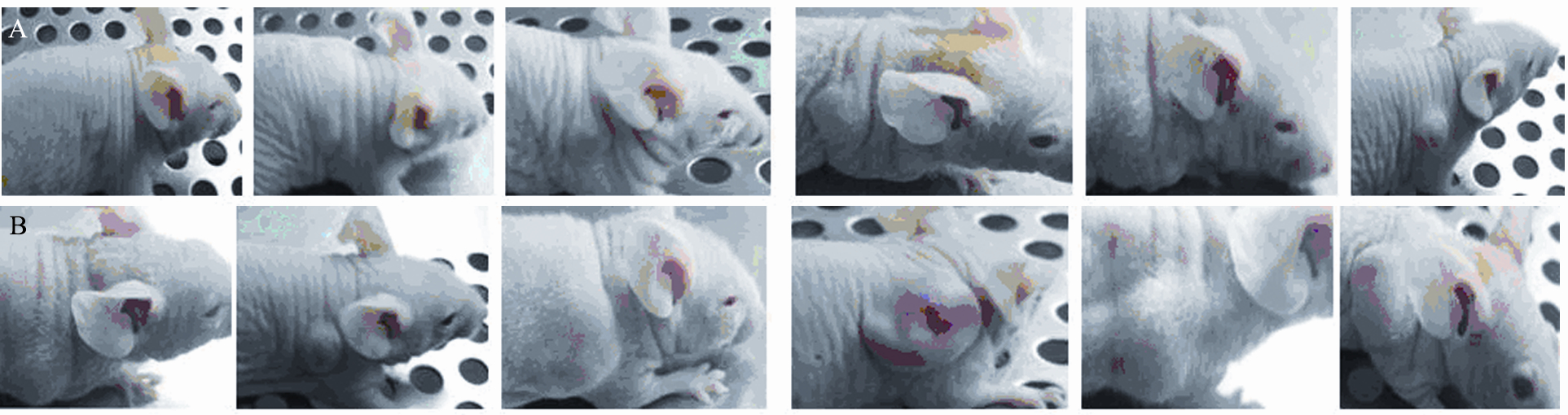 |
A:experimental group;B:control group
图1 静脉注射15d-PGJ27天后两组裸鼠的皮下移植瘤
Figure 1 Subcutaneous xenograft tumors of two groups after intravenous injection of 15d-PGJ2for 7 d |
 |
图2 两组裸鼠皮下移植瘤生长曲线 Figure 2 Growth curves of subcutaneous xenograft tumor of two groups |
光学显微镜下可见移植瘤细胞有明显异型 性,细胞大小不一,细胞核大小、形状及染色不 一,核分裂相易见,为低分化腺癌,瘤组织部分 区域内可见坏死,见图3。另裸鼠肝脏、肾脏和脾 脏在光镜下,没有观察到任何损伤的表现。
 |
图3 裸鼠皮下移植瘤的光学显微镜下的组织学形态(HE ×400) Figure 3 Histological morphology of subcutaneous xenograft tumor of nude mice under light microscope(HE ×400) |
15d-PGJ2对移植瘤p27、Skp2及survivin mRNA 表达的影响,经RT-PCR检测结果显示,与对照组 相比,实验组p27mRNA条带亮度增强,Skp2和 survivin mRNA条带亮度减弱,见图4;定量后,实 验组p27、Skp2及survivin mRNA的含量分别为0.30 ±0.13、0.25±0.10和0.40±0.13,而对照组分别为 0.18±0.10、0.38±0.12和0.46±0.19,经统计学分析 表明,p27、Skp2及survivin mRNA的含量,实验 组与对照组之间差异有统计学意义(P<0.05),实验 组p27 mRNA的含量明显低于对照组,实验组Skp2 及survivin mRNA的含量明显高于对照组。这表明 15d-PGJ2 抑制Skp2、survivin mRNA表达,而促进 p27 mRNA表达。
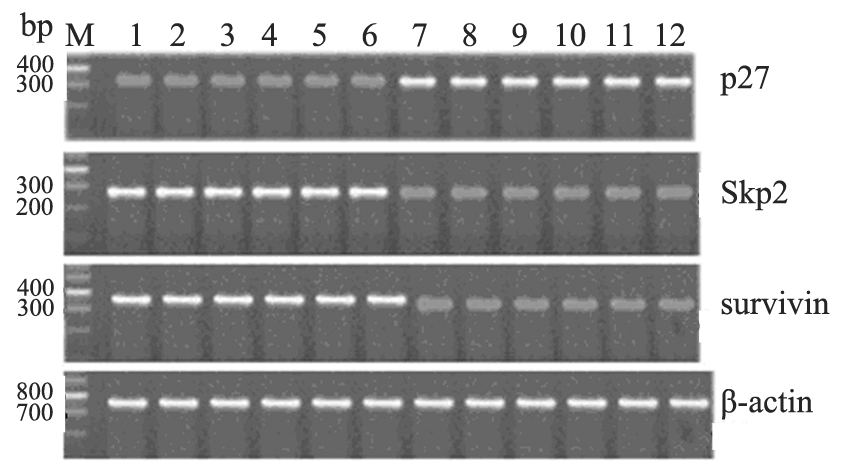 |
图4 RT-PCR检测的裸鼠皮下移植瘤组织中p27 、Skp2、 survivin mRNA的表达 Figure 4 Expressions of p27, Skp2 and survivin mRNA of subcutaneous xenograft tumor of nude mice detected by RT-PCR |
15d-PGJ2对移植瘤p27、Skp2及survivin mRNA 表达的影响,经Western blot检测结果显示,与对 照组相比,实验组P27蛋白条带颜色变深,Skp2和 survivin蛋白条带颜色变浅,表明p27蛋白高表达,Skp2和survivin蛋白低表达,见图5。定量后,实 验组p27、Skp2及survivin 蛋白的含量分别为1.02 ±0.01、0.81±0.02和0.75±0.07,而对照组分别为 0.30±0.02、1.39±0.01和1.49±0.04,经统计学分析 表明,p27、Skp2及survivin 蛋白的含量,实验组 与对照组之间差异有统计学意义(P<0.05),实验组 p27 mRNA蛋白的含量明显低于对照组,实验组 Skp2及survivin 蛋白的含量明显高于对照组。这表 明15d-PGJ2 抑制Skp2、survivin 蛋白表达,而促进 p27 蛋白表达。
 |
1-6:control group;7-12:experimental group
图5 Western blot检测15d-PGJ2对移植瘤组织中p27、
Skp2、survivin蛋白表达
Figure 5 Expressions of p27, Skp2 and survivin protein
of subcutaneous xenograft tumor of nude mice detected by
Western blot |
免疫组织化学染色结果显示,CD44表达 在实验组和对照组的瘤细胞胞质中,均呈棕黄 色,实验组CD44阳性细胞数量较少,见图6。 经统计学检验显示,实验组CD44阳性细胞率为 (51.20±12.45)%,对照组CD44阳性细胞率为 (85.45±15.45)%,两组比较差异有统计学意 义(P<0.05)。这表明15d-PGJ2抑制裸鼠移植瘤 CD44表达。
 |
A:experimental group;B:control group
图6 免疫组织化学检测裸鼠皮下移植瘤的CD44的表达
(IHC ×400)
Figure 6 CD44 expression of subcutaneous xenograft tumor
of nude mice detected by immunohistchemistry(IHC ×400) |
建立肿瘤模型应首先解决宿主动物的免疫排 斥反应。BALB/C裸鼠,是已被国际上认可的实验 动物[ 13 ]。该种小鼠无胸腺,缺乏免疫反应,属于 免疫缺陷动物。裸鼠体内细胞较接近人体内细胞 的情况,接种肿瘤细胞成活率较高。该移植瘤模 型能够很好地观察人体内肿瘤细胞的自然生长情 况。肿瘤表浅易于记录观察,且能完整的保持原 发瘤的生物学特征。
本实验中,我们建立该裸鼠模型,利用 BALB/C-nu裸鼠建立了人胃癌MGC803细胞的皮 下移植瘤模型并取得了成功。但在实验中需要注 意:(1)保证裸鼠饲养环境的无菌;(2)接种细胞时 避免污染;(3)注意皮下注射时的深度和力度,避 免皮丘散开。
本实验将人胃癌MGC803细胞接种到12只裸 鼠皮下,在接种后第7天,均出现肉眼可见的小 丘样隆起,实验组裸鼠尾静脉每天给予5mg/kg 的 15d-PGJ2。在接种人胃癌MGC803细胞的第10天 (即开始给予15d-PGJ2第4天后),两组裸鼠移 植瘤体积逐渐出现变化,实验组裸鼠肿瘤生长明 显缓慢,第12天,实验组裸鼠移植瘤平均体积为 (25.01±11.24)mm3,对照组裸鼠移植瘤平均体积 为(79.39±59.09)mm3。第14天开始,实验组的 裸鼠移植瘤体积(47.75±18.50)mm3显著低于对 照组(167.07±108.07)mm3,差异有统计学意义 (P<0.05),实验结束时(即给予15d-PGJ216次后的 第3天;即接种人胃癌MGC803细胞的第25天)实 验组和对照组肿瘤体积分别为(573.86±242.90) mm3和(1206.46±272.22)mm3,前者明显小于后者 (P<0.05),15d-PGJ2对实验组裸鼠移植瘤的体 积抑制率为(53.71±5.8)%。可见,15d-PGJ2能有效 抑制人胃癌MGC803细胞在裸鼠皮下建立的移植瘤 的生长,这表明15d-PGJ2在体内能有效地抑制胃癌 细胞的生长。
细胞周期的紊乱对大多数恶性肿瘤的发生和 发展是必需的。p27是一个推动细胞周期由G1~S 期的cyclinE-CDK2和cyclinA-CDK2的抑制剂。因 此,p27功能缺失和低表达加速细胞周期的进程, 预示细胞可能恶性转化和加速生长。p27的量主要 被转录后泛素蛋白酶体介导的蛋白降解调节。首 先在G1晚期CDK2导致p27的Thr187部位磷酸化, 然后由包括Skp1、Cull、Rbx1/Roc1和F-BOX蛋 白S期激酶相关蛋白2(S-phase kinase-associated protein 2,Skp2)的泛素连接酶复合体(SCFSkp2) 将泛素分子加入,多聚泛素化的p27在蛋白体内降 解,将p27这个细胞周期的闸移开,细胞由G1期进 入S期。Skp2蛋白表达对于p27泛素化和接下来的 降解是必需的。
survivin是凋亡抑制蛋白家族中的一员,研 究认为,绝大多数恶性肿瘤中都有survivin高表 达。survivin 作用机制包括两方面,一是通过抑 制细胞凋亡转导通路中的半胱氨酸蛋白caspase-3 和caspase-7的活性,阻断细胞的凋亡过程,促进 肿瘤发生发展;一是加速细胞增殖。研究表明, survivin主要在G2/M 期表达,可以对抗G2/M期诱 导的凋亡,在癌组织中,它通过有丝分裂促进转 化细胞的异常增殖。survivin 在肿瘤组织的过度表 达,放映肿瘤细胞凋亡“开关”启动受限,增殖周 期加速,使得细胞增殖和凋亡紊乱,肿瘤生长旺 盛。
我们前期在体外的研究显示,过氧化物酶体 增殖物激活受体gamma(peroxisome proliferatoractivated receptor gamma,PPARγ)的天然配体15-脱氧前列腺素J2(15-Deoxy-delta12,14 -prostaglandin J2,15d-PGJ2)通过下调抑制凋亡的蛋白survivin、 细胞周期中S期激酶相关蛋白2(Skp2)和上调细 胞周期素依赖激酶抑制剂p27蛋白诱导人胃癌细胞 凋亡及将胃癌细胞阻滞在细胞周期中G0/G1期,抑 制人胃癌细胞的生长[ 8 ]。 本实验中经RT-PCR和Western blot检测发现, 给予15d-PGJ2的裸鼠皮下移植瘤中survivin 和Skp2 的mRNA及蛋白质低表达而p27 mRNA及蛋白质 高表达。可见,15d-PGJ2在体内也可以下调抑制 凋亡的蛋白survivin、细胞周期中Skp2和上调细胞 周期素依赖激酶抑制剂p27蛋白的表达,这可能是 15d-PGJ2抑制人胃癌细胞的生长的机制之一。 目前,一些美国专家研究显示,在胃癌,细 胞表面跨膜糖蛋白CD44表达阳性的瘤细胞可能为 胃癌的干细胞[ 9 ] ,本实验观察到,实验组CD44阳 性细胞率[(51.20±12.45)%],明显低于对照组CD44阳性细胞率[(85.45±15.45)%](P<0.05),结果表 明,15d-PGJ2也可能抑制胃癌干细胞的数量,这 可能也是15d-PGJ2能抑制胃癌细胞生长的又一机 制。
| [1] | Forman BM, Tontonoz P, Chen J, et al. 15-Deoxy-delta12, 14-prostaglandin J2 is a ligand for the adipocyte determination factor PPAR gamma[J].Cell, 1995, 83(5): 803-12. |
| [2] | Tennis MA, Van Scoyk MM, Freeman SV,et al. Sprouty-4 inhibits transformed cell growth, migration and invasion, and epithelialmesenchymal transition, and is regulated by Wnt7A through PPARgamma in non-small cell lung cancer[J].Mol Cancer Res,2010, 8(6):833-43. |
| [3] | Papi A, Rocchi P, Ferreri AM,et al. RXRgamma and PPARgamma ligands in combination to inhibit proliferation and invasiveness in colon cancer cell[J].Cancer Lett,2010, 297(1):65-74. |
| [4] | Simpson-Haidaris PJ, Pollock SJ, Ramon S, et al. Anticancer role of PPARgamma agonists in hematological malignancies found in the vasculature, marrow and eyes[J].PPAR Res,2010, 2010:814609. |
| [5] | Shim J, Kim BH, Kim YI, et al. The peroxisome proliferatoractivated receptor gamma ligands, pioglitazone and 15-deoxyDelta(12,14)-prostaglandin J(2), have antineoplastic effects against hepatitis B virus-associated hepatocellular carcinoma cells[J].Int J Oncol,2010, 36(1):223-31. |
| [6] | Toaldo C, Pizzimenti S, Cerbone A, et al. PPARgamma ligands inhibit telomerase activity and hTERT expression through modulation of the Myc/Mad/Max network in colon cancer cells[J]. J Cell Mol Med,2010, 14(6A):1347-57. |
| [7] | Diers AR, Dranka BP, Ricart KC, et al. Modulation of mammary cancer cell migration by 15-deoxy-Delta(12,14)-prostaglandin J(2): implications for anti-metastatic therapy[J].Biochem J,2010, 430(1):69-78. |
| [8] | Ma XM, Yu H, Huai N. Peroxisome proliferator-activated receptorgamma is essential in the pathogenesis of gastric carcinoma[J]. World J Gastroenterol,2009,15(31):3874-83. |
| [9] | Wakamatsu Y, Sakamoto N, Oo HZ,et al. Expression of cancer stem cell markers ALDH1, CD44 and CD133 in primary tumor and lymph node metastasis of gastric cancer[J]. Pathol Int, 2012, 62(2):112-9. |
| [10] | Shin SW, Seo CY, Han H, et al.15d-PGJ2 induces apoptosis by reactive oxygen species-mediated inactivation of Akt in leukemia and colorectal cancer cells and shows in vivo antitumor activity[J].Clin Cancer Res,2009,15(17):5414-25. |
| [11] | Zhang ZH, Chen Y, Zhao HJ, et al. Silencing of heparanase by siRNA inhibits tumor metastasis and angiogenesis of human breast cancer in vitro and in vivo[J]. Cancer Biol Ther, 2007, 6(4):587-95. |
| [12] | Gao H, Wang JY, Shen XZ, et al. Preparation of magnetic polybutylcyanoacrylate nanospheres encapsulated with aclacinomycin A and its effect on gastric tumor[J]. World J Gastroenterol, 2004 ,10(14):2010-3. |
| [13] | Rivette AS, Tokar EJ, Williams DE, et al. Selection of cell lines with enhanced invasive phenotype from xenografts of the human prostate cancer cell line WPE1-NB26[J]. J Exp Ther Oncol, 2005, 5(2): 111-23. |
 2014, Vol.41
2014, Vol.41
