2.南方医科大学附属武汉临床学院
2. Southern Medical University Affiliated Clinical College of Wuhan
组织因子途径抑制物2(TFPI-2)属于Kunitz 型 丝氨酸蛋白酶抑制物超家族蛋白,是近年来发现 的一种广谱的丝氨酸蛋白酶抑制物,可以抑制 多种恶性肿瘤的生长、血管生成、浸润及转移。 近年来研究发现在常见的恶性肿瘤包括肺癌, TFPI-2基因启动子区甲基化使TFPI-2表达下降或 者缺失,这与肿瘤的生长、浸润及转移有关[ 1, 2, 3, 4 ] . 5-Aza-CdR可通过抑制基因启动区的高度甲基化 而恢复多种基因活性,逆转肿瘤的恶性表型[ 5, 6 ]。 本研究通过5-Aza-CdR干预非小细胞肺癌细胞系 A549细胞后,检测TFPI-2 mRNA的表达,并观察 5-Aza-CdR处理后A549细胞的增殖、侵袭,以验 证5-Aza-CdR能通过去甲基化而恢复TFPI-2 mRNA 在非小细胞肺癌细胞株A549细胞中的表达,抑制 A549细胞的生长增殖和侵袭。 1 材料与方法 1.1 材料
A549细胞株购自武汉大学中国典型培养物保 藏中心;RPMI 1640培养液购自美国Hyclone 公 司;5-Aza-CdR、DMSO、MTT液及碘化丙啶均 购自美国Sigma公司;流式细胞仪购自美国BD公 司;Trizol Reagent购自美国Invitrogen公司;定 量PCR试剂盒购自日本TOYOBO公司;荧光定量 PCR仪购自上海宏石医疗科技有限公司;Transwell 小室购自美国Corning公司。 1.2 细胞培养及实验分组
非小细胞肺癌细胞株A549细胞贴壁培养生长 于RPMI 1640培养液,内含10%的胎牛血清、100 u/ml 青霉素和100 μg/ml链霉素,置于37℃、5%CO2的 恒温闭式培养箱内培养,细胞呈贴壁生长,将对 数期细胞以0.1%胰蛋白酶消化,传代。按不同浓 度的5-Aza-CdR分组:对照组:未加5-Aza-CdR干 预,加入等量普通培养液组。实验组:(1)加入 1 μM的5-Aza-CdR干预组。(2)加入5 μM的5-AzaCdR干预组。(3)加入10 μM的5-Aza-CdR干预组。 1.3 MTT法检测5-Aza-CdR处理后24、48、72 h的 细胞增殖活性
取处理前的对数生长期的细胞,按每孔接种 1×104个细胞接种于96孔细胞培养板,每块培养 板共接种4组,每组3孔,接种后等细胞贴壁(24 h)后去上清液,实验组加入含不同浓度(1、5、 10 μM)的5-Aza-CdR培养液,对照组加入等量培 养液,继续置于37℃、5%CO2的恒温闭式培养箱 内培养,处理24、48、72 h后,每孔加入MTT溶液 (10 mg/L)20 μl,孵育4 h,去除孔内上清液,每孔 加入150 μl二甲基亚砜(DMSO),置振荡器振荡 10 min,使结晶物充分溶解。采用酶标仪于490 nm 波长处检测吸光度值(OD值),5-Aza-CdR对细 胞增殖活性的影响用细胞抑制率来表示,细胞增 殖抑制率=(对照组OD值-实验组OD值)/对照组 OD值×100%,绘制细胞增殖曲线。实验重复3次。 1.4 FCM法检测药物处理72 h后的细胞周期分布
已传代的非小细胞肺癌A549细胞株在6孔培养 板培养24 h后,去除培养液,实验组加入含不同浓 度(1、5、10 μM)的5-Aza-CdR培养液,对照组 加入等量普通培养液,将培养板继续置于37℃、 5%CO2的恒温闭式培养箱内培养,72 h后回收细 胞,以0.1%胰蛋白酶消化并收集于4℃离心机离心 (1500 r/min,5 min),磷酸盐缓冲液(PBS)清 洗3次,70%冰乙醇固定,用RNaseA(终浓度为 0.1 g/L)消化30 min,加入0.05 g/L碘化丙啶(PI) 250 μl,室温避光染色30 min后上机检测。以增殖 指数(proliferation index,PI)衡量细胞分裂活动, PI=(S+G2/M)/(G0/G1+S+G2/M)。 1.5 Real-time PCR检测用药后细胞的TFPI-2 mRNA表达变化
收集5-Aza-CdR作用72 h后各组A549细胞, 用Trizol试剂提取各组细胞总RNA。用反转录酶和 Oliga(dT)20引物合成cDNA。TFPI-2 mRNA及内标 基因mRNA的引物序列,见表1。反应体系均为25 μl,PCR反应条件为:95℃预变性1 min,94℃变性 15 s,58℃退火20 s,72℃延伸20 s,共进行40个循 环,72℃延伸5 min。溶解曲线:72℃→95℃,每20 s升温1℃。结果处理:ΔCt=CtTFPI-2−Ctβ-actin,ΔΔCt= ΔCt实验组−ΔCt对照组,相对mRNA表达倍数=2 -ΔΔCt。实验重复三次。
|
|
表1 TFPI-2 mRNA及内标基因mRNA的real-time PCR引 物序列 Table 1 Real-time PCR primer of TFPI-2 mRNA and internal standard gene mRNA |
于穿膜小室的下室内加入含10%胎牛血清的 RPMI 1640培养液,上室加入经不同浓度5-AzaCdR处理后的细胞悬液,每组设3个滤膜,置于培 养箱中作用24 h,将小室取出,用PBS洗去培养 液,结晶紫染色10 min;自来水将表面的结晶紫洗 除干净,用棉签将上室中的细胞擦除干净,于倒 置显微镜下(×200)对非细胞接种侧拍照,以穿膜细 胞数的多少表示细胞侵袭能力的大小。 1.7 统计学方法
计量数据均以均数±标准差(x±s) 表示。应 用SPSS 13.0统计软件分析,采用Levene法进行 方差齐性检验,若方差齐,数据采用方差分析 (ANOVA)检验,组间比较用LSD检验;若方差不 齐,用Games-Howell法进行分析。 2 结果 2.1 5-Aza-CdR处理24、48、72 h后的A549细胞生 长抑制率
5-Aza-CdR对A549细胞生长的抑制作用呈明显 的剂量和时间依赖性。当作用时间相同时,A549 细胞的生长抑制率随着5-Aza-CdR浓度的增加而 逐渐增高,差异有统计学意义(P<0.05);当5-AzaCdR浓度相同时,A549细胞的生长抑制率随着作 用时间的延长也逐渐增高,差异也有统计学意义 (P<0.05),见图1。
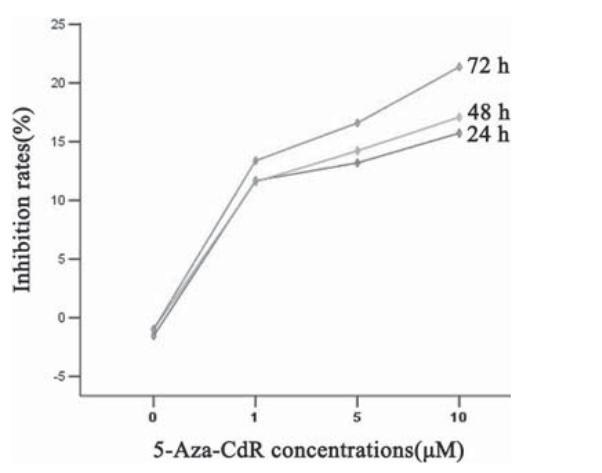 |
图1 不同浓度5-Aza-CdR作用不同时间后A549细胞的生 长抑制率曲线 Figure 1 Growth curve of A549 cells treated with different concentration of 5-Aza-CdR for different time |
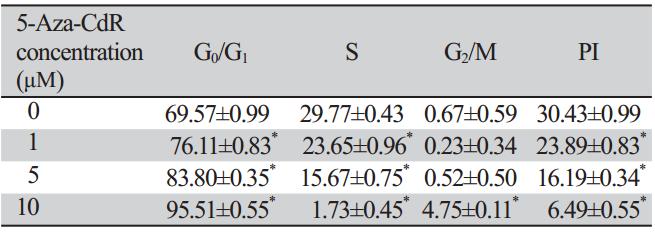
流式细胞仪检测显示,0、1、5、10 μM 5-Aza-CdR作用72 h后,随着其浓度的增加,G0/G1 期的细胞数量逐渐增加,S期细胞数逐渐下降,细 胞增殖指数减低,与对照组相比,P<0.05,差异 有统计学意义,见表2。
|
|
表2 不同浓度5-Aza-CdR处理A549细胞72 h后细胞周期的 变化(x±s,%) Table 2 Cell cycle change of A549 cells treated with different concentrations of 5-Aza-CdR for 72 h(x±s,%) |
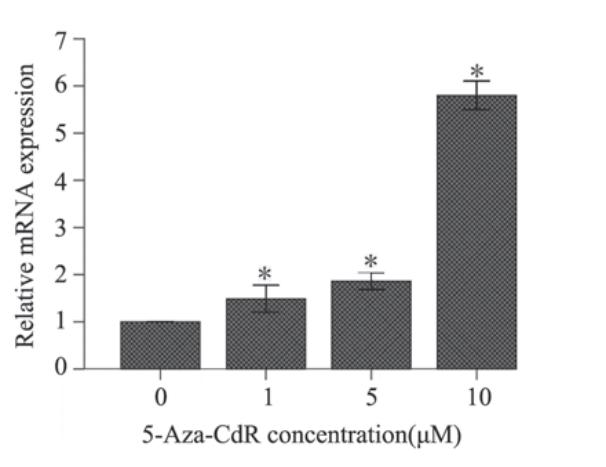
经5-Aza-CdR处理72 h后,TFPI-2 mRNA重 新表达,与对照组相比,各实验组TFPI-2 mRNA 表达呈明显的上升趋势,5-Aza-CdR浓度为0、 1、5、10 μM时,相对mRNA水平分别为(1± 0)、(1.49±0.14)、(1.86±0.09)、(5.80± 0.15)(P<0.05),见图2。
 |
*:P<0.05 vs. control group(0 μM)
图2 不同浓度5-Aza-CdR处理A549细胞72 h后TFPI-2
mRNA的表达情况
Figure 2 Relative TFPI-2 mRNA expression after A549
cells treated with different concentration of 5-Aza-CdR for
72 h |
Transwell小室上室细胞穿过matrigel到膜的 下室面,其细胞数量反映了细胞侵袭能力的大 小。收集5-Aza-CdR处理24 h后的A549细胞,采 用Transwell小室模型检测A549细胞侵袭情况。 5-Aza-CdR浓度为0、1、5、10 μM时,每一高倍 镜下平均穿膜细胞数(316.15±18.7)、(84.15± 12.14)、(28.85±7.13)、(14.35±3.33),与 对照组比较,实验组穿过滤膜的癌细胞数明显下 降,且与浓度相关(P<0.05),见图3、4。
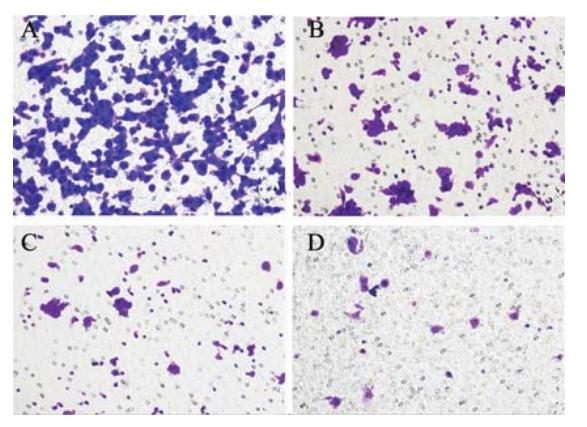 |
A:control group(0 μM);B:1 μM group;C:5 μM group;D:10 μM group
图3 不同浓度的5-Aza-CdR处理A549细胞24 h后高倍显微
镜下细胞穿膜结果(结晶紫染色 ×200)
Figure 3 Cells transmembrane results of A549 cells treated
with different concentration of 5-Aza-CdR for 24 h under
high-power microscope(crystal violet staining ×200) |
 |
*:P<0.05 vs. control group(0 μM)
图4 Transwell小室模型检测不同浓度5-Aza-CdR处理24 h
后A549细胞平均穿膜细胞数
Figure 4 Average cells transmembrane number of A549
cells treated with different concentration of 5-Aza-CdR for
24 h detected by Transwell assay |
随着后基因组时代的到来,表观遗传学 (epigenetics)研究越来越受到重视,DNA甲基化为 表观遗传学的研究肿瘤开辟了一个新的领域[ 7, 8 ]。研究表明,DNA甲基化与肿瘤的发生和演进密切 相关,它可通过基因组总体水平甲基化程度的降 低和某些启动子区域甲基化程度的增高造成基因 功能的失活,从而导致肿瘤的形成,这就是我们 常说的甲基化理论。启动子甲基化异常不是随机 事件,而是具有基因特异性和肿瘤特异性,启动 子甲基化在肿瘤的早期阶段、癌前阶段已存在, 可能是肿瘤发生的主要因素。迄今已发现许多恶 性肿瘤存在一个或多个肿瘤抑制基因启动子甲基化,这些相关的肿瘤抑制基因失活涉及多个环 节,如细胞周期调控、DNA修复、细胞凋亡、肿瘤 浸润等,从而导致恶性肿瘤的发生和进展[ 9, 10 ]。近 年来研究发现在常见的恶性肿瘤(包括肺癌), TFPI-2基因启动子区甲基化使TFPI-2表达下降或 者缺失,这与肿瘤的生长、浸润及转移有关[ 1, 2, 3, 4 ]。 Rollin等[ 4 ]研究发现TFPI-2基因甲基化失活能明 显增加非小细胞肺癌的侵袭作用。进一步研究发 现,TFPI-2基因启动子甲基化状态对于研究肿瘤 的发生、发展、预后具有重要意义。研究发现, 5-氮杂-2'-脱氧胞苷嘧啶能与DNA 甲基化酶共价结 合,抑制该酶的甲基转移活性,逆转肿瘤细胞的 基因甲基化,恢复mRNA转录活性和蛋白表达, 目前主要用于白血病等恶性白血液病治疗,并取得 了一定的疗效[ 11 ]。
本研究将不同浓度的5-Aza-CdR作用于A549 细胞,MTT检测显示不同浓度的5-Aza-CdR处理 的A549细胞24、48、72 h后,细胞的生长受到抑 制,且抑制作用呈明显的剂量和时间依赖性。 FCM检测分析显示G0/G1期细胞逐渐增加,出现 G0/G1阻滞,细胞增殖指数逐渐降低,随着5-AzaCdR浓度增加,细胞增殖指数逐渐降低。Real-time PCR检测显示TFPI-2 基因mRNA表达呈明显的上 升趋势,且随着药物浓度增加而增加。本研究结 果表明,5-Aza-CdR可通过抑制TFPI-2基因启动 子区的高度甲基化而恢复其转录活性,从而发挥 TFPI-2的抑制肿瘤生长及转移等作用。
侵袭和转移是恶性肿瘤最重要的特征之一,也是肿瘤治疗失败的主要原因。本研究结果显示 用不同浓度的5-Aza-CdR处理A549细胞后,其侵 袭能力逐渐降低,且随着5-Aza-CdR浓度的升高和 TFPI-2 mRNA表达水平的增高而下降,表明5-AzaCdR可能通过TFPI-2基因表达的恢复而抑制非小细 胞肺癌细胞的侵袭能力。
综上所述,5-Aza-CdR可抑制非小细胞肺癌 细胞的生长增殖并降低癌细胞的侵袭能力,其机 制可能与其干扰细胞周期并通过去甲基化作用提 高其TFPI-2基因的表达有关。因此,5-Aza-CdR有 可能成为非小细胞肺癌去甲基化治疗的新药物, TFPI-2可能是5-Aza-CdR治疗非小细胞肺癌有效的 分子标志物之一。
| [1] | Vaitkien?P, Skiriut?D, Skauminas K,et al. Associations between TFPI-2 methylation and poor prognosis in glioblastomas[J]. Medicina (Kaunas),2012, 48(7):345-9. |
| [2] | Zheng H,Tang ZG. Effect of 5-Aza-dC on expression and mathylation of TFPI-2 gene in Panc-1 pancreatic cancer[J].Zhong Liu Fang Zhi Yan Jiu,2012, 39(2):150-3. [郑浩, 汤志刚. 5-Aza-dC 对胰腺癌细胞系Panc-1中TFPI-2基因甲基化水平及表达的影 响[J].肿瘤防治研究, 2012, 39(2):150-3.] |
| [3] | Wang S, Xiao X, Zhou X,et al. TFPI-2 is a putative tumor suppressor gene frequently inactivated by promoter hypermethylation in nasopharyngeal carcinoma[J]. BMC Cancer, 2010, 10:617-21. |
| [4] | Rollin J, Iochmann S, Ble'chet C, et al. Expression and methylation status of tissue factor pathway inhibitor-2 gene in non-small-cell lung cancer[J].Br J Cancer,2005,92(4):775-83. |
| [5] | Xiong Hh, Zhuang L,Xiong H,et al.Effects of 5-Aza-CdR on proliferation and apoptosis of human non-small cell lung cancer A549 cells and the expression of Apaf-1 gene[J].Zhonghua Shi Yan Wai Ke Za Zhi, 2009,26(3):324-6.[熊慧华,庄亮,熊华,等. 5-氮杂-2'-脱氧胞苷对人肺腺癌A549细胞增殖及Apaf-1基因表达 的影响[J].中华实验外科杂志,2009,26(3):324-6.] |
| [6] | Dong SW, Ma L, Xu N, et al. Research on the reactivation of Syk expression caused by the inhibition of DNA promoter methylation in the lung cancer[J]. Neoplasma, 2011,58(1):89-95. |
| [7] | Lomberk G, Mathison AJ, Grzenda A, et al. The sunset of somatic genetics and the dawn of epigenetics: a new frontier in pancreatic cancer research[J]. Curr Opin Gastroenterol, 2008, 24: 597-602. |
| [8] | Brune K, Hong SM, Li A, et al. Genetic and epigenetic alterations of familial pancreatic cancers[J]. Cancer Epidemiol Biomarkers Prev, 2008,17: 3536-42. |
| [9] | Chan AO, Rashid A. CpG island methylation in precursors of gastrointestinal malignancies [J]. Curr Mol Med, 2006, 6(4): 401-8. |
| [10] | Fischer JR, Ohnmacht U, Rieger N, et al. Promoter methylation of RASSF1A, RARbeta and DAPK predict poor prognosis of patient, with malignant mesothelioma [J]. Lung Cancer, 2006, 54(1): 109-16. |
| [11] | Kwong J, Lo KW, To KF,et al. Promoter hypermethylation of multiple genes in nasopharyngeal carcinoma [J]. Clin Cancer Res, 2002, 8(1): 131-7. |
 2014, Vol.41
2014, Vol.41