整合素是一类重要的细胞表面黏附分子,由 α(ITGA)亚基和β(ITGB)亚基所组成的异二聚体 跨膜糖蛋白。目前发现哺乳动物中有18种ITGA亚 基和8种ITGB亚基,组成24种整合素异二聚体。 整合素在多种细胞表面表达,通过与配体的结合 介导细胞之间的以及细胞、胞外基质之间的信号 转导,在细胞分化、胚胎发育及细胞黏附等方面 发挥非常重要的作用[ 1 ]。在恶性肿瘤中,整合素 通过介导肿瘤细胞与基底膜、肿瘤细胞与宿主细 胞间的黏附及肿瘤发生发展过程中的多种信号传 递,直接或间接的影响肿瘤的生长、黏附、浸润 和迁移等多个环节[ 2 ]。1993年发现的ITGA9亚基可 以与ITGB1亚基形成异二聚体,与IGTA4亚基组成 整合素的一个亚家族[ 3 ]。作为最新的整合素亚家族 的一员,有关ITGA9的研究相对较少。本研究采 用RNA干扰技术抑制小鼠黑色素瘤细胞B16F1中 ITGA9的表达,观察肿瘤细胞在小鼠体内的生长 及肺转移情况,为肿瘤靶向治疗新途径提供实验 依据。 1 材料与方法 1.1 材料
小鼠黑色素瘤细胞系B16F1,由芝加哥大学孟 玉茹教授提供。用含10%胎牛血清的RPMI1640培 养液,置37℃、5%CO2培养箱中培养。ITGA9靶 向shRNA质粒(ITGA9-shRNA)、阴性对照质粒 (scramble-shRNA)、转染试剂和转染培养液购 自Santa Cruz公司 。RNA提取试剂盒、反转录试剂 盒和PCR试剂盒为大连宝生物公司产品。兔抗小鼠ITGA9单克隆抗体购自Abcam公司。 1.2 方法 1.2.1 shRNA质粒转染B16F1细胞与稳定筛选
将 对数生长期的细胞接种到6孔板,用含10%胎牛 血清的RPMI 1640培养液置37℃,5%CO2培养箱 中培养。等到细胞长至60%~70%融合,按说明书 用转染培养液和转染试剂将ITGA9-shRNA转染细 胞,置37℃,5%CO2培养箱中培养。6 h后更换新 鲜10%胎牛血清RPMI1640培养液。转染24 h后, 将6孔板中的细胞消化,转至培养瓶中培养。待细 胞长至80%融合,用含1 μg/ml嘌呤霉素(Merck公 司)的10%胎牛血清RPMI 1640培养液培养3d,收 集细胞进行Western blot和RT-PCR检测,并冻存。 1.2.2 荧光定量RT-PCR检测ITGA9 mRNA表 达
首先提取细胞总RNA,用1μgRNA反 转录成cDNA。特异性扩增引物由英潍捷基 (上海)合成,ITGA9的上游引物序列为5’- AAGTGTCGTGTCCATACCAAC-3’,下游引物序 列为5’-GGTCTGCTTCGTAGTAGATGTTC-3’; 内参β-actin的上游引物序列为5’-GACCCAGA TCATGTTTGAGACC-3’,下游引物序列为5’- ACGACCAGAGGCATACAGG-3’。PCR循环: 95℃30 s预变性,95℃5 s,60℃30 s共40个循环。 1.2.3 Western blot检测ITGA9蛋白表达
用RIPA (含1%PMSF蛋白酶抑制剂)裂解细胞提取总蛋 白,测蛋白浓度。配置10%的分离胶和5%的浓缩 胶,每孔上40 μg蛋白进行SDS-PAGE,转至PVDF 膜。膜经封闭后,加ITGA9一抗,4℃过夜。经洗 涤,加二抗(凯基生物公司)室温孵育2 h。洗涤 后,DBA显色,数码照相。 1.2.4 动物实验分组
SPF级雌性、6~8周龄 C57BL/6小鼠24只,购自南方医科大学实验动物 中心。随机分为A、B、C3组,每组8只。A组为 ITGA9-shRNA转染组,B组为阴性对照scrambleshRNA转染组,C组为空白对照组。 1.2.5 皮下成瘤及肺转移动物模型的建立
取对 数生长期的B16F1细胞,用胰酶消化后,离心收集细 胞,加PBS制成单细胞悬液,调整密度为1×107/ml。 于小鼠后肢的外侧部位皮下注射100 μl单细胞悬液 (1×106个细胞),建立皮下成瘤模型。同时,经 小鼠尾静脉注射1×106个细胞,建立肺转移模型。 1.2.6 观察指标
观察注射后小鼠皮下成瘤情 况,每3天用游标卡尺测肿瘤长径(a)、短径(b),利 用公式计算肿瘤体积(V=ab2/2),绘制肿瘤生长曲 线。3周后,处死小鼠并解剖取双肺,计数肺部转 移灶的数目。 1.3 统计学方法 实验数据以x±s表示,用SPSS 10.0软件进行单 因素方差分析,P<0.05为差异有统计学意义。 2 结果
2.1 ITGA9-shRNA质粒转染B16F1细胞对ITGA9 表达的影响
RT-PCR和Western blot结果显示,与scrambleshRNA和空白对照相比,在mRNA水平和蛋白水 平,ITGA9-shRNA转染B16F1成功抑制了ITGA9 的表达,抑制率分别为67%(P<0.05)和50%(P <0.05),见图1、2。
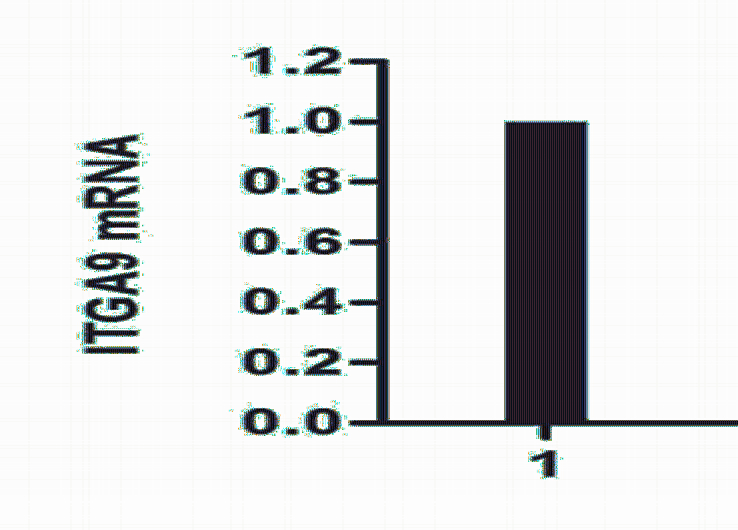 |
1:B16F1 cells;2:scramble-shRNA transfected B16F1 cells;3:ITGA9-shRNA transfected B16F1 cells 图1 荧光定量RT-PCR检测细胞ITGA9 mRNA的表达 Figure 1 Expression of ITGA9 mRNA detected by qRTPCR |
 |
1:B16F1 cells;2: scramble-shRNA transfected B16F1 cells;3:ITGA9-shRNA transfected B16F1 cells 图2 Western blot检测细胞IGTA9蛋白水平的表达 Figure 2 Expression of ITGA9 protein detected by Western blot |
小鼠肿瘤体积生长曲线见图3。ITGA9-shRNA 组的肿瘤生长与scramble-shRNA组和空白对照组 相比显著减慢(P<0.05)。在实验终点,ITGA9-shRNA组的肿瘤平均体积与阴性对照组相比下降 36%。3周后处死小鼠,取双肺,计数肺表面转移 灶的数目。scramble-shRNA组和空白对照组中肺部 转移灶平均值分别为(43.13±6.79)个和(43.38± 6.323)个,而ITGA9-shRNA组的肺部转移灶明显减少(P<0.05),仅为 (18.13±4.74)个,见图4。
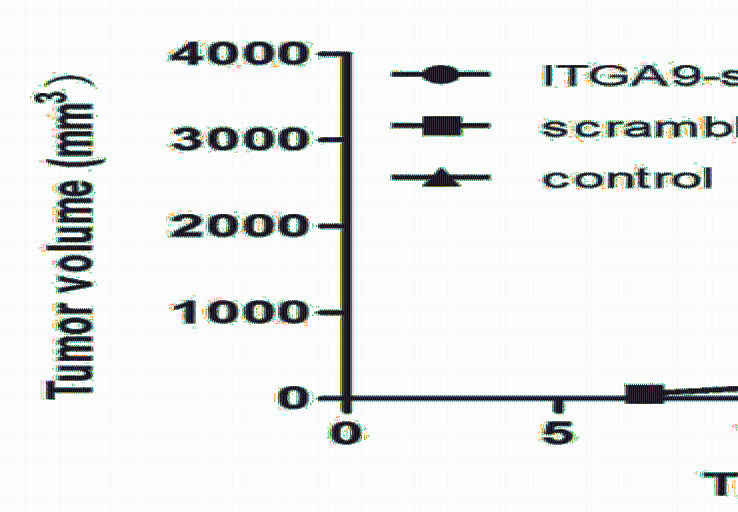 |
图3 各组小鼠肿瘤生长曲线 Figure 3 Growth curves of subcutaneous tumor volume |
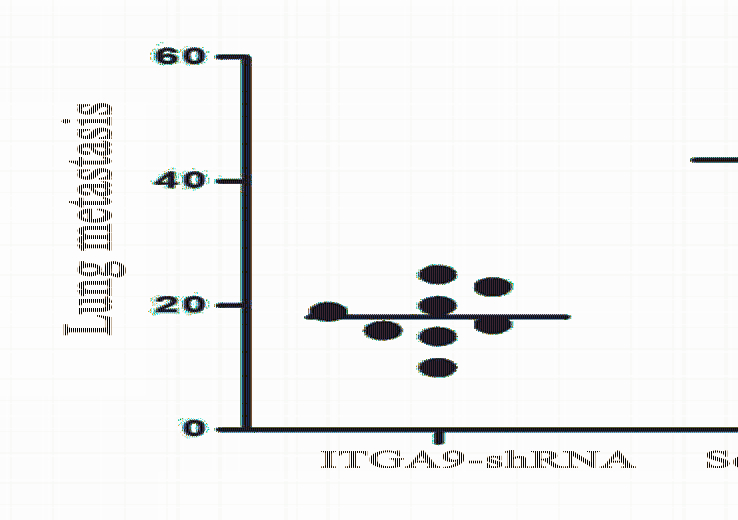 |
图4 各组小鼠肺转移灶数目 Figure 4 Number of lung metastatic lesions |
恶性肿瘤表达的黏附分子与肿瘤的生长、侵袭 和转移密切相关。黏附分子通过与配体结合启动 细胞的多条信号通路,影响细胞的生物学行为,同 时也改变细胞本身的特性[ 4 ]。多项研究表明,整合 素在恶性肿瘤中的表达发生改变。改变表达的整 合素影响肿瘤细胞与细胞外基质的相互作用,促 进肿瘤细胞迁移,并有助于其存活[ 5 ]。整合素有望 成为应用于临床抗肿瘤新药研发的靶点[ 6 ]。 ITGA9在多种肿瘤中表达发生改变。它高表达 于肺癌,特别是小细胞肺癌,可能是预后不良的指 标[ 7 ]。还有研究表明整合素α9β1是basal-like型乳腺 癌的分子标志并提示患者的无转移生存期和总生存 期短[ 8 ]。多项实验研究表明ITGA9与肿瘤的侵袭、 迁移有关[ 9, 10 ]。黑色素瘤恶性程度高,晚期转移患 者的治疗效果并不理想,新的治疗方法和治疗靶点 亟需进一步研究。ITGA9是否在黑色素瘤的侵袭、 迁移中发挥重要作用,需要进一步验证。
本实验用RNA干扰技术,下调B16F1细胞的 ITGA9的表达,在小鼠体内观察到肿瘤生长减 慢,提示ITGA9可抑制B16F1的局部生长。其机制 可能为下调ITGA9影响了B16F1的增殖、分化以及 肿瘤血管生成等环节,需进一步探讨。此结果提 示ITGA9可能是黑色素瘤治疗的潜在靶点。
本实验使用高转移性的黑色素瘤细胞株 B16F1,静脉注射建立肺转移模型,该模型可以很 好的评价处理因素对肺转移的影响。一般认为,进 入小鼠血液循环的恶性肿瘤细胞是通过黏附毛细 血管内皮细胞,穿过基底膜,迁移至组织内增殖, 最终形成转移灶。ITGA9-shRNA转染的B16F1细胞 在小鼠体内形成的肺转移灶减少,提示ITGA9影响 B16F1细胞从黏附、穿过血管内皮到进入组织形成 转移灶这一系列环节中的一个或多个环节。这种肺 转移抑制作用也可能与肿瘤细胞在血液循环中的存 活率降低有关。以上结果表明ITGA9有希望成为抑 制黑色素瘤转移的治疗靶点。
| [1] | Krissansen GW, Danen EHJ. Integrin superfamily. Encyclopedia of Life Sciences: John Wiley & Sons, Ltd.,www.els.net.2007. |
| [2] | Deb M, Sengupta D, Patra SK. Integrin-epigenetics: a system with imperative impact on cancer[J]. Cancer Metastasis Rev,2012,31(1-2): 221-34. |
| [3] | Palmer EL, Rüegg C, Ferrando R,et al. Sequence and tissue distribution of the integrin alpha 9 subunit, a novel partner of beta 1 that is widely distributed in epithelia and muscle[J]. J Cell Biol,1993,123(5):1289-97. |
| [4] | Nasulewicz-Goldeman A, Uszczyńska B, Szczaurska-Nowak K, et al. siRNA-mediated silencing of integrin β3 expression inhibits the metastatic potential of B16 melanoma cells[J]. Oncol Rep, 2012,28(5):1567-73. |
| [5] | Roy S, Bingle L, Marshall JF, et al. The role of α9β1 integrin in modulating epithelial cell behaviour[J]. J Oral Pathol Med, 2011,40(10):755-61. |
| [6] | Perdih A, Dolenc MS. Small molecule antagonists of integrin receptors[J]. Curr Med Chem,2010,17(22):2371-92. |
| [7] | Gupta SK, Oommen S, Aubry MC, et al. Integrin α9β1 promotes malignant tumor growth and metastasis by potentiating epithelialmesenchymal transition[J]. Oncogene,2013,32(2):141-50. |
| [8] | Allen MD, Vaziri R, Green M, et al. Clinical and functional significance of α9β1 integrin expression in breast cancer: a novel cell-surface marker of the basal phenotype that promotes tumour cell invasion[J]. J Pathol,2011,223(5):646-58. |
| [9] | Arihiro K, Kaneko M, Fujii S,et al. Significance of alpha 9 beta 1 and alpha v beta 6 integrin expression in breast carcinoma[J]. Breast Cancer,2000,7(1):19-26. |
| [10] | Gerashchenko GV, Gordiyuk VV, Skrypkina IY,et al. Screening of epigenetic and genetic disturbances of human chromosome 3 genes in colorectal cancer[J]. Ukr Biokhim Zh,2009,81(4):81-7. |
 2014, Vol.41
2014, Vol.41
