2.河北唐山协和医院呼吸内科
2. Department of Respiratory, Xiehe Hospital
目前多发性骨髓瘤仍然难以治愈。在硼替佐 米(bortezomid,BZM)等新药出现之前,中位生存 期仅3年。但BZM不能根治多发性骨髓瘤,且随 着其临床应用范围的扩大和时间的推移,部分患 者对BZM产生了耐药反应,因此人们寻找新的抗 多发性骨髓瘤药物,或者以BZM为基础的联合治疗方案等,以进一步提高多发性骨髓瘤患者的生 存率和治愈率[ 1, 2 ]。力达霉素(lidamycin,LDM)是 大分子肽类抗肿瘤抗生素,LDM具有较强的抗肿 瘤活性[ 3, 4, 5, 6, 7 ],前期结果证实其具有抗多发性骨髓瘤 作用。我们经过前期实验[ 7 ]的摸索,选取了适当 的LDM、BZM和通路抑制剂浓度,本实验拟研究 LDM联合BZM抗骨髓瘤作用,为今后两药联合在 多发性骨髓治疗中的应用提供理论依据。 1 材料与方法 1.1 材料
鼠骨髓瘤细胞U266由本室传代保存。用 含10%胎牛血清(Hyclone)的RPMI 1640培养液 (Gibco),于37℃、5% CO2、饱和湿度条件下培 养,2 d传代1次,实验用细胞为对数生长期细胞。 力达霉素由中国医学科学院医药生物技术研究所 甄永苏院士惠赠。主要实验材料还有:蛋白定量 试剂盒(BCATM protein assay kit)(皮尔斯,美 国伊利诺伊州);宽范围蛋白预染Marker(新英 格兰生物公司,美国马萨诸塞州);蛋白质印迹 发光液和PVDF膜(密理博公司,美国马萨诸塞 州);Actin抗体(sc-1616) (圣克鲁斯公司,美国 马萨诸塞州);HRP 标记的羊抗兔、兔抗羊、羊 抗小鼠IgG 抗体(北京中杉金桥有限责任公司, 中国北京);MAPK家族成员抗体试剂盒、磷酸 化MAPK家族成员抗体试剂盒(细胞信号技术公 司,美国马萨诸塞州);JNK抑制剂SP600125、 p38 MAPK抑制剂SB203580和MEK抑制剂U0126 (默克公司,中国北京)。 1.2 方法 1.2.1 细胞增殖活性检测MTS 法测定细
胞存活率,MTS[3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl) -2H-tetrazolium,inner salt]是MTT的一种新型类似 物,化学名为3-(4,5-二甲基噻唑-2-磺)-5- (3-羧甲基 氧苯基)-2-(4-磺苯基)-2氢四唑内盐,简称MTS。 原理是MTS在PMS (phenazine methosulfate) 存在 的情况下可被活细胞内的脱氢酶类还原,转化成 液态可溶的产物,而死细胞无此功能,该水溶物 可用酶标仪在波长490 nm 处检测,测定在490 nm 波长处的吸光度值,该值可间接反映活细胞的数 量和活性。取对数生长期的细胞,轻轻吹打分散 成细胞悬液,计数后以1×104个/孔的密度接种细 胞于96孔细胞培养板中,2 h 后加入不同浓度的药 物处理48 h,每组至少3个平行孔。每孔加入20 μl MTS和PMS混合液(按说明书配制:每2 ml MTS 溶液中加入100 μl PMS,现用现配),37℃继续培 养1~4 h,用酶标仪(Thermo Labsystems,Multiskan MK3) 于490 nm处测定每个孔的吸收度(A490)值。 实验设无药对照孔和无细胞对照孔各3孔,按下 面公式计算细胞的存活率:细胞存活率=(加药 组A490值-空白组A490值)/(对照组A490值-空白 组A490值)×100%。实验重复3次。为了研究JNK、 p38 MAPK和ERK的激活在LDM联合BZM抑制 U266细胞增殖中的作用,分别用相应的抑制剂 (SP600125、SB203580和U0126)预处理U266细 胞2 h,再加入LDM (0.5 nmol/L)和BZM(10 nmol/L) 继续作用48 h后,用MTS法检测细胞增殖抑制状 况。 1.2.2 Western blot分析
收集不同药物作用48 h及 未加药处理的U266细胞,用预冷的1×PBS洗3遍, 加入新鲜配制的细胞裂解液(50 mmol/L Tris-HCl, pH 7.5;1% NP-40; 150 mmol/L NaCl; 1 mmol/L Na3VO4; 1 mmol/L NaF,临用时加入3种蛋白酶抑 制剂:1% 抑蛋白酶肽、10 g/L 亮抑酶肽;1 mmol/ L 苯甲基磺酰氟) 100 μl,细胞与裂解液充分混合, 冰浴20 min。于4℃,13 000 mmol/L 离心15 min, 收集上清液于新的微量离心管中,按照BCA法测 定蛋白含量。取各样品等量总蛋白30 μg加入0.25 倍体积的5×上样缓冲液,煮沸变性5 min后,在 10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis, SDS-PAGE)胶上进行电泳。然后转移到硝酸纤维 素膜上,1% BSA封闭1 h,一抗4℃孵育过夜后, 加相应二抗孵育2 h,膜上滴加化学发光增强剂 (SC-2048,美国Santa Cruz 生物公司),按照试剂说 明进行操作,通过凝胶成像系统拍照保存结果。 1. 3 统计学方法
计量资料以均值±标准差(x±s)表示,采用 SPSS13.0统计软件进行单因素方差分析比较各组 间的差异,采用 t 检验进行两组之间比较,P<0.05 为差异有统计学意义。 2 结果 2.1 MTS检测LDM联合BZM对U266细胞增殖的 影响
LDM联合BZM作用U266细胞48 h后,能显著 抑制细胞的增殖,与LDM和BZM单药比较差异有 统计学意义,见图1。
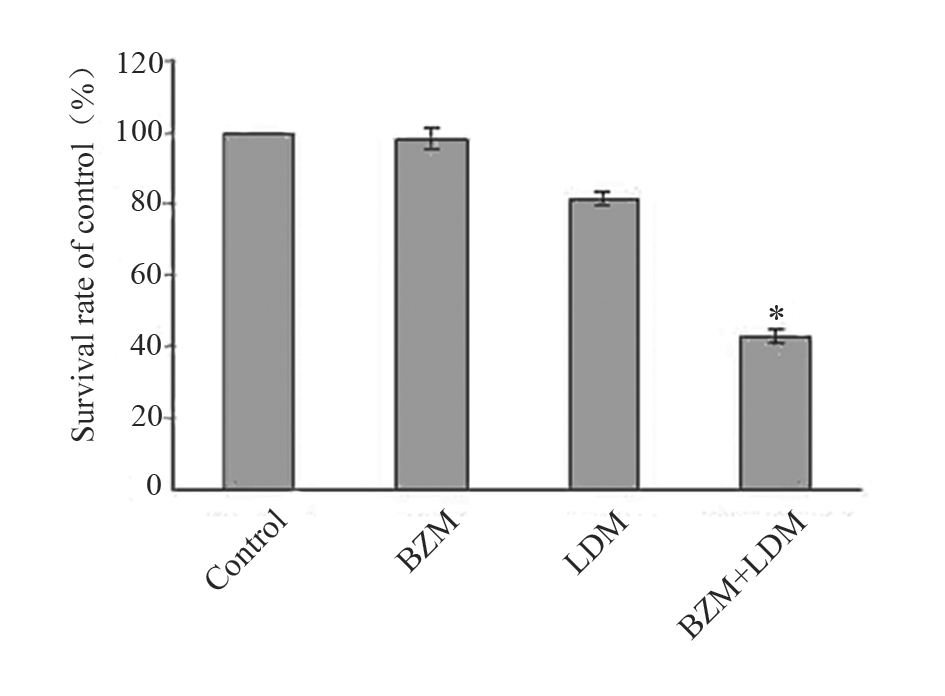 |
Each point represents x±s(n=3), *:P<0.05, the combination versus
LDM or BZM;BZM:bortezomib;LDM:lidamycin
图1 LDM联合BZM对U266细胞增殖的影响
Figure 1 Proliferation inhibition of U266 cells by BZM (5 nmol/L), LDM (0.5 nmol/L) and the combination |
0.5 nmol/L 的LDM作用U266细胞48 h后,可 激活磷酸化的JNK、p38 MAPK和ERK的表达, LDM与BZM(5 nmol/L)联合用药后,可使JNK 和p38 MAPK的激活显著增强,而ERK的激活显著 下降,见图2。
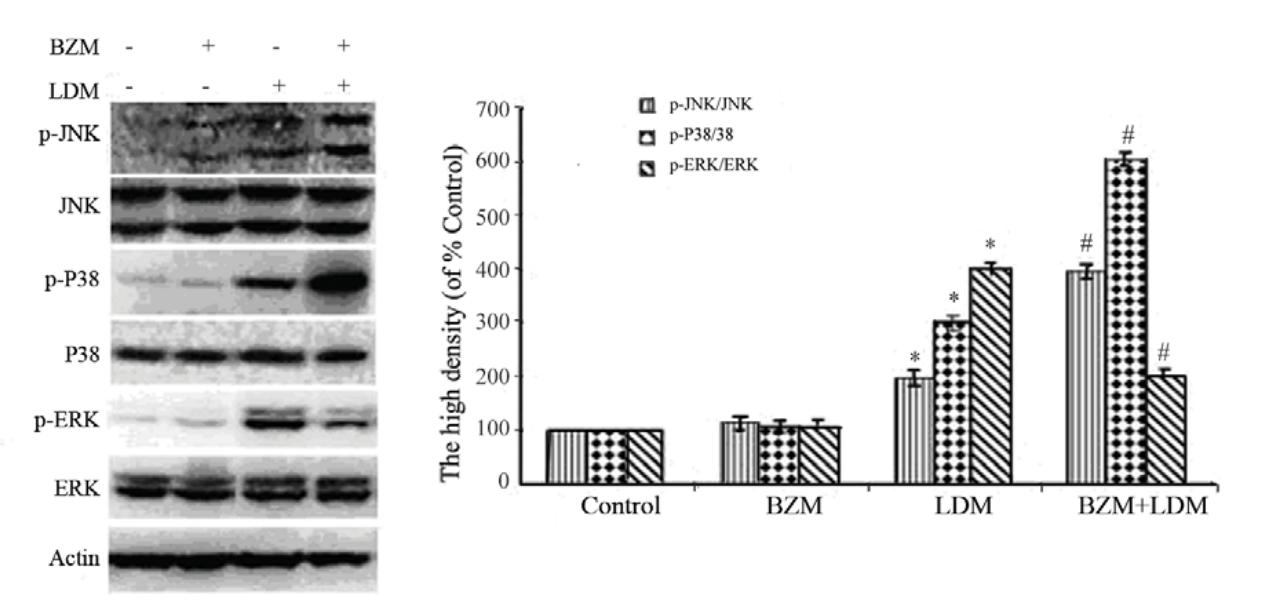 |
Each point represents x±s(n=3), *: P <0.05, LDM vs.control; #: P<0.05, the combination vs.LDM
图2 Western blot检测LDM联合BZM对U266细胞MAPKs表达的影响
Figure 2 The effects of LDM combined with BZM on MAPKs expression in U266 cells detected by Western blot |
BZM (5 nmol/L)联合LDM (0.5 nmol/L)作用 U266细胞48 h后,能显著抑制细胞的增殖,与 LDM和BZM单药比较差异有统计学意义,但联合 用药合用JNK抑制剂SP600125后,降低了对细胞 的增殖抑制作用,与联合用药比较差异有统计学 意义,见图3。
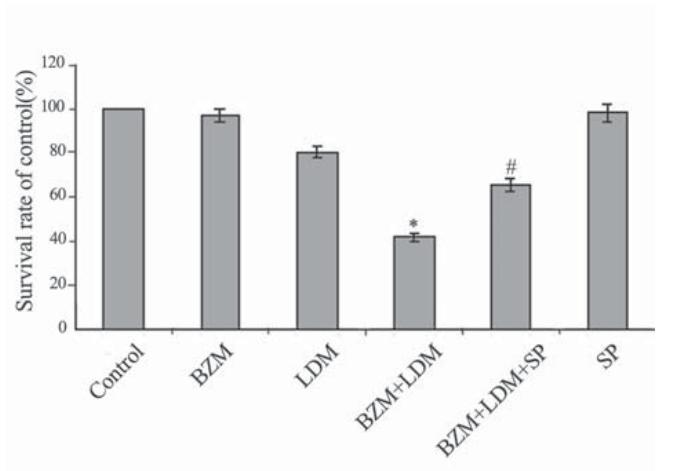 |
SP:SP600125; each point represents x±s(n=3), *: the combination vs.
LDM or BZM, P<0.05; #: the combination plus inhibitor SP600125 vs.
the combination, P<0.05
图3 BZM、LDM联合用药及合用SP600125对U266细胞增殖的影响
Figure 3 Anti-proliferation of U266 cells by BZM, LDM, the combination, and the combination plus SP600125 |
BZM (5 nmol/L)联合LDM (0.5 nmol/L)作用 U266细胞48 h后,能显著抑制细胞的增殖,与 LDM和BZM单药比较有显著性差异,但联合用药 合用p38 MAPK抑制剂SB203580后,降低了对细胞 的增殖抑制作用,与联合用药比较差异有统计学意义,见图4。
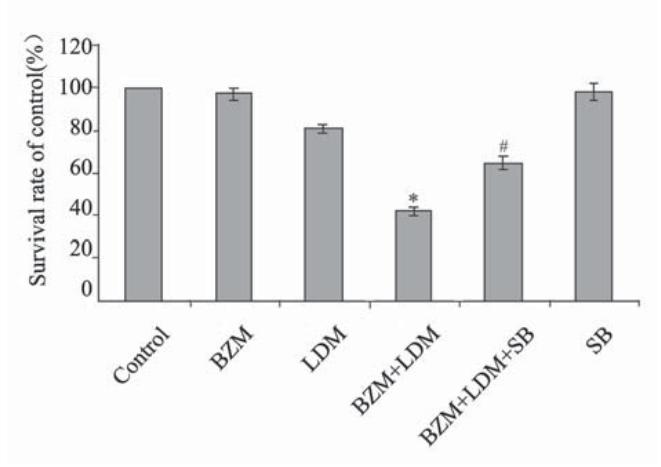 |
SB:SB203580; each point represents x±s(n=3), *: the combination
vs.LDM or BZM, P<0.05; #: the combination plus inhibitor vs.the
combination, P<0.05
图4 BZM、LDM联合用药及合用SB203580对U266细胞
增殖的影响
Figure 4 Anti-proliferation of U266 cells by LDM, BZM,
the combination, and the combination plus SB203580 |
BZM (5 nmol/L)联合LDM (0.5 nmol/L)作用 U266细胞48 h后,能显著抑制细胞的增殖,与 LDM和BZM单药比较差异有统计学意义,但合用 MEK抑制剂U0126后,增强了对细胞的增殖抑制作 用,与联合用药比较差异有统计学意义,见图5。
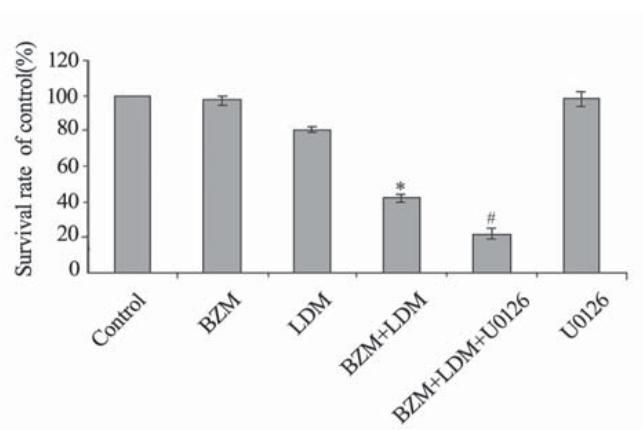 |
Each point represents x±s(n=3), *: the combination vs.LDM or BZM, P<0.05; #: the combination plus inhibitor vs.the combination, P<0.05 图5 BZM, LDM联合用药及合用U0126对U266细胞增殖 的影响 Figure 5 Anti-proliferation of U266 cells by LDM, BZM, the combination, and the combination plus U0126 |
力达霉素属于烯二炔类抗生素,它可诱导DNA 单、双链的断裂。大量研究表明,力达霉素具有 较强的抗肿瘤活性[ 3, 4, 5, 6, 7 ]。前期结果显示,LDM通过 激活JNK和p38 MAPK抑制骨髓瘤细胞增殖,而 LDM作用后ERK的激活有利于细胞生存[ 7 ]。硼替 佐米是首个用于临床的蛋白酶体抑制剂,2003年5 月,美国食品药物管理局(FDA)批准硼替佐米 用于多发性骨髓瘤患者。
本实验结果显示BZM能增强LDM的抗骨髓 瘤作用,LDM激活MAPK家族的三个主要成员: c-Jun氨基末端激酶(c-Jun NH2-terminal kinase, JNK)、p38 MAPK的表达和细胞外信号调节激酶(extracellular signal regulated rotein kinase,ERK), 这一结果和我们前期研究结果吻合,两药联合后 可使JNK和p38 MAPK的激活显著增强,而ERK的 激活显著下降。分别应用JNK抑制剂(SP600125)、 p38抑制剂(SB203580)和MEK抑制剂(U0126)与 LDM联合BZM合用,观察对细胞增殖的影响。结 果显示单独的3种抑制剂对细胞的增殖抑制作用均 不明显,但SP600125或SB203580分别与LDM联合 BZM合用后均降低了两药联合对细胞的增殖抑制 作用,而U0126与LDM联合BZM合用后提高了两 药联合对细胞的增殖抑制作用。
MAPK属于丝/苏氨酸蛋白激酶,广泛存在于 哺乳动物细胞的胞质中,参与调节细胞生长、发 育、分裂、死亡以及细胞间的功能等一系列生命 活动[ 8, 9 ]。研究表明MAPK家族中的这三个主要成 员:JNK、p38 MAPK和ERK均既有抗增殖、促凋 亡作用又有促增殖、抗凋亡作用[ 10, 11, 12, 13 ],这取决于细 胞的类型、死亡刺激的性质及活化的持续时间和 其他信号通路的活性。
MAPK信号转导通路是一个复杂的网络系统, 在哺乳类细胞中各个MAPK信号通路之间通过复 杂的机制既可相互区别,又可相互调节,既有自 身的独立性,相互间又有千丝万缕的联系。JNK、 p38 MAPK和ERK三条通路,或是在上游蛋白激 酶,或是在下游作用底物处,总是有其通路的交 汇。这种复杂的、多联系的网络系统是确保细胞 反应精确性和准确性的关键,细胞对外界刺激的 反应是综合了各个信号通路之间的激活和(或) 抑制效应而产生的。
综上所述,BZM能增强LDM的抗骨髓瘤作 用,这种增强作用是通过进一步激活JNK、p38 MAPK和降低ERK的激活来实现的。本实验为 LDM联合BZM抗多发性骨髓瘤的体内实验和临床 试验研究提供了理论依据。
| [1] | Zeng Z, Zheng L, Lin J,et al. Successful bortezomib treatment in combination with dexamethasone and thalidomide for previously untreated epidural plasmacytoma[J]. Oncol Lett,2012,3(3):557-9. |
| [2] | Leiba M, Jakubikova J, Klippel S, et al.. Halofuginone inhibits multiple myeloma growth in vitro and in vivo and enhances cytotoxicity of conventional and novel agents[J]. Br J Haematol, 2012,157(6):718-31 |
| [3] | Zhen YS, Xue YC, Shao RG. Antitumor activity of the new enediyne antibiotic C1027[J]. Zhongguo Kang Sheng Su Za Zhi,1994,19(2):164-8.[甄永苏, 薛玉川, 邵荣光. 烯二 炔类新抗生素C1027的抗肿瘤作用研究[J]. 中国抗生素杂志, 1994,19(2):164-8.] |
| [4] | Zhong GS, Guo XF, Zhang SH, et al. Optimization of the assembly efficiency for lidamycin chromophore bound to its apoprotein: a case study using orthogonal array[J]. Biomed Environ Sci, 2011,24(6):602-7. |
| [5] | Zhang Q, Liu XJ, Hu L, et al. Factor VII light chain-targeted lidamycin targets tissue factor-overexpressing tumor cells for cancer therapy[J]. Int J Mol Med,2012,29(3):409-15. |
| [6] | Zhen HY, He QH, Zhen YZ, et al.. Inhibition of mouse embryonic carcinoma cell growth by lidamycin through down-regulation of embryonic stem cell-like genes Oct4, Sox2 and Myc[J]. Invest New Drugs,2011,29(6):1188-97. |
| [7] | Zhen YZ, Lin YJ, Shang BY, et al. Enediyne lidamycin induces apoptosis in human multiple myeloma cells through activation of p38 mitogen-activated protein kinase and c-Jun NH2-terminal kinase[J]. Int J Hematol,2009,90(1):44-51. |
| [8] | Pearson G, Robinson F, Beers Gibson T, et al. Mitogen-activated protein (MAP) kinase pathways: regulation and physiological functions[J]. Endocr Rev,2001,22(2):153-83. |
| [9] | Huang P, Han J, Hui L. MAPK signaling in inflammationassociated cancer development[J]. Protein Cell,2010,1(3):218-26. |
| [10] | Lu Z, Xu S. ERK1/2 MAP kinases in cell survival and apoptosis[J]. IUBMB Life,2006,58(11):621-31. |
| [11] | Wen J, Cheng HY, Feng Y, et al. p38 MAPK inhibition enhancing ATO-induced cytotoxicity against multiple myeloma cells[J]. Br J Haematol,2008,140(2):169-80. |
| [12] | Zhang B,Wang X,Cai F,et al. Antitumor properties of salinomycin on cisplatin-resistant human ovarian cancer cells in vitro and in vivo: involvement of p38 MAPK activation[J]. Oncol Rep,2013,29(4):1371-8. |
| [13] | Guo R,Lin J,Xu W, et al. Hydrogen sulfide attenuates doxorubicininduced cardiotoxicity by inhibition of the p38 MAPK pathway in H9c2 cells [J]. Int J Mol Med,2013, 31(3):644-50. |
 2014, Vol.41
2014, Vol.41
