奥沙利铂(Oxaliplatin,OXA)是第三代铂类化 疗药,目前在临床上应用广泛,是用于胃肠道肿 瘤、胆系肿瘤、胰腺癌等常见肿瘤的主要化疗药物 之一。奥沙利铂的胃肠道反应和血液学毒性发生 率均较低,其剂量限制性毒性是周围神经毒性[1], 其发生率高达70%~90%。目前,用于奥沙利铂神 经毒性防治的药物主要有B族维生素、钙镁合剂、 还原型谷胱甘肽、卡马西平、中药制剂等,但疗 效均不理想。神经节苷脂是从神经节细胞分离的 一种鞘糖脂,有促进神经细胞再生的作用,目前主 要用于中枢神经损伤性疾病,在糖尿病引起的周围 神经病变中也有较好的疗效。我科自2011年2月— 2012年10月应用神经节苷脂预防奥沙利铂的神经毒 性,取得了一定的效果,现报道如下。
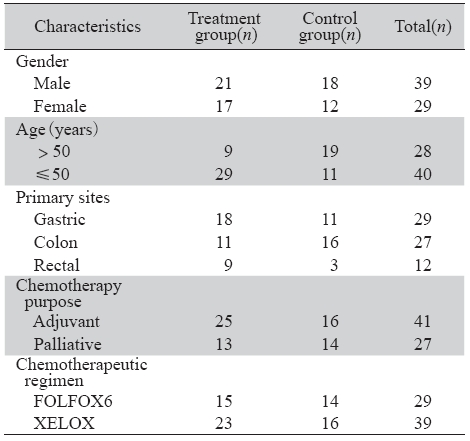
1 资料与方法 1.1 临床资料收集2011年2月—2012年10月在解放军第八一 医院全军肿瘤中心内科接受含奥沙利铂方案化疗 的肿瘤患者,共68例。其中男39例,女29例;年 龄范围31~72岁,中位年龄56岁;全部病例均经病 理组织学检查确诊为恶性肿瘤,其中胃癌29例, 结肠癌27例,直肠癌12例;术后辅助化疗41例, 姑息化疗27例;应用FOLFOX6方案治疗29例, XELOX方案治疗39例。所有患者均有可评价的客 观病灶,并经CT/MRI检查证实;一般情况较好, ECOG评分≤2分,预计生存期≥3月;实验室检测 符合下列标准:胆红素≤正常值上限1.5倍,谷丙 /谷草转氨酶≤正常值上限2.5倍(如有肝转移,则≤ 正常值上限的5倍),肌酐≤正常值上限1.5 倍,中 性粒细胞计数≥1.5×109/L,血小板≥80×109/L,血 红蛋白≥90 g/L,患者一般情况见表1。
|
|
表1 两组恶性肿瘤患者临床特征比较 Table 1 Clinical characteristics of patients with malignant tumor in two groups |
排除标准:脑转移、合并其他抗肿瘤治疗或 放疗,有其他疾病(如糖尿病等)所致的周围神经病 变、或其他原发性神经系统疾病、或正在接受其 他具有神经毒性的药物治疗。
所有患者随机分成2组,其中一组为试验组(神 经节苷脂组),共38例;另一组为对照组(呋喃硫胺 组),共30例。由于神经节苷脂目前并非预防和治疗 化疗药物所致神经毒性的标准方法,故在治疗前已 与患者及其家属进行充分的沟通并获得知情同意。
1.2 治疗方法所有患者均接受FOLFOX6方案或XELOX方案化疗。FOLFOX6方案:奥沙利铂,100 mg/m2, 静脉滴注(vein drop,VD),d1;亚叶酸钙,400 mg/ m2,VD,d1;氟尿嘧啶,600 mg/m2,静脉推注 (IV),d1;氟尿嘧啶,2 400 mg/m2,持续静脉泵内 输注48 h;每2周重复。XELOX方案:奥沙利铂, 130 mg/m2,VD,d1;卡培他滨,1 500 mg/m2,口 服(分2次),d1~14;每3周重复。
试验组:单唾液酸四己酸神经节苷脂钠注射 液(商品名申捷,齐鲁制药有限公司生产)40 mg加 入5%葡萄糖注射液或250 ml 0.9%氯化钠溶液注 射液中,于每周期化疗当天开始静脉滴注,每日 1次,共3天。对照组:呋喃硫胺片(长效维生素 B1),50 mg,口服,每日3次,于首次应用奥沙利 铂当天开始用药,持续口服直至末次奥沙利铂给 药后1月。
1.3 评价标准神经毒性按照奥沙利铂Levi专用感觉神经毒 性分级标准评定[2]:(1)0 级:无;(2)1 级: 感觉异常或感觉迟钝(遇冷引起),1 周内可完全消 退;(3) 2 级:感觉异常或感觉迟钝,21 天内可 完全消退;(4)3 级:感觉异常或感觉迟钝,21 天内不能完全消退;(5)4级:感觉异常或感觉 迟钝,伴有功能障碍。
所有接受过奥沙利铂治疗的患者在每周期化 疗期间均进行急性神经毒性的评价;接受6周期以 上FOLFOX6方案化疗、4周期以上XELOX方案化 疗的患者进行累积性神经毒性评价。
姑息化疗患者的疗效评价按实体瘤疗效评价 标准(RECIST1.1)进行评估,分为完全缓解(CR)、 部分缓解(PR)、稳定(SD)和疾病进展(PD),统 计客观有效率RR(CR+PR)、疾病控制率DCR (CR+PR+SD)和中位无进展生存时间(PFS)。
1.4 统计学方法采用SPSS13.0统计软件进行统计分析。组间 比较采用卡方检验,P<0.05为差异有统计学意 义。中位PFS应用Kaplan-meier法进行分析。
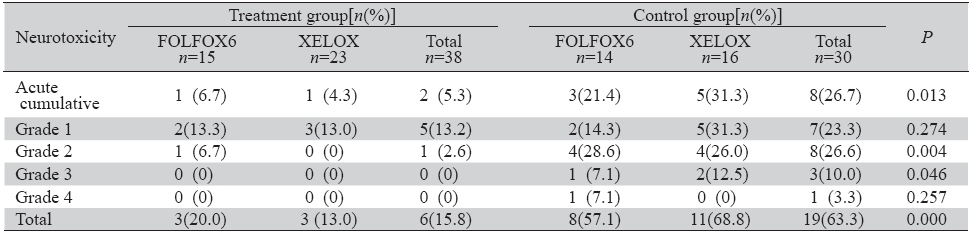
2 结果 2.1 两组患者治疗后周围神经毒性发生率比较两组病例中,符合急性、累积性毒性评价的 病例共68例,其中试验组38例,对照组30例。试 验组有2例发生急性神经毒性,对照组有8例,两 组间差异有统计学意义(P=0.013);其表现以冷刺 激诱发的肢端麻木为主,两组患者均未出现急性 喉痉挛。
对照组中,发生累积性神经毒性的共有19 例,发生率为63.3%,其中1级7例、2级8例、3级 3例、4级1例,主要表现为双手、双足肢端、手掌 及脚掌麻木、感觉迟钝及针刺感,并有1例出现4 级神经毒性,表现为双下肢肌肉肌力下降至4级、 部分影响肢体活动,症状持续超过21天。试验组 累积性神经毒性的总体发生率为13.2%(6/38),显 著低于对照组(P=0.000),且患者症状均较轻,其 中1级5例、2级仅1例,无3~4级毒性。与对照组相 比,试验组患者2、3级累积性神经毒性发生率明 显降低(P<0.05);两组患者的1级和4级累积性神 经毒性发生率相似,差异无统计学意义,考虑可 能与病例数较少、且4级神经毒性发生率低有关, 见表2。
|
|
表 2 两组患者周围神经毒性发生率比较 Table 2 The incidence of sensory neurotoxicity in two groups |
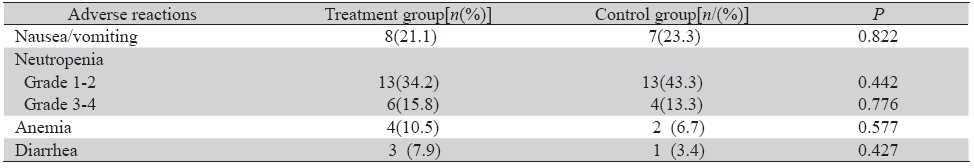
两组患者的其他化疗相关性不良反应(如恶 心、呕吐、中性粒细胞下降、贫血、腹泻等), 发生率均相似,见表3,差异无统计学意义(P> 0.05),提示神经节苷脂不会加重化疗药的不良反 应。在XELOX方案治·疗组患者中,未出现手足 综合征病例,考虑可能与本方案中卡培他滨给药 剂量较低(1 500 mg/m2·d)有关。
|
|
表 3 两组患者其他不良反应发生率比较 Table 3 The incidence of other adverse reactions in two groups |
在疗效方面,由于观察、随访时间较短,在 辅助化疗的患者中尚未观察到中位至肿瘤复发时 间。在姑息化疗的患者中,试验组获得3例PR、5 例SD、5例PD;对照组获得2例PR、7例SD、5例 PD。两组在总有效率(23.1% vs. 14.3%,P=0.557)和疾病控制率(61.5% vs. 64.3%,P=0.883)方面差异 均无统计学意义。试验组中位PFS为5.5月,对照 组中位PFS为4.8月,两者之间的差异无统计学意 义(Log rank=1.048,P=0.306)。
3 讨论周围神经毒性是奥沙利铂的剂量限制性毒 性,包括急性神经毒性和累积性神经毒性。急性 神经毒性为迅速发作的末梢神经感觉异常或感觉 障碍,多为冷刺激所诱发,持续时间较短。累积 性神经毒性为多周期用药后出现的蓄积性迟发 型神经感觉障碍,该毒性呈剂量依赖性,累积剂 量>900 mg/m2时,3度以上神经毒性的发生率达 12%,累积剂量>1 560 mg /m2时为75%[3]。
急性神经毒性目前普遍认为由电压门控性Na+ 通道障碍引起[3],奥沙利铂可作用于感觉和运动神 经元细胞膜上的Na+通道,降低Na+电流的幅度, 降低动作电位的幅度,从而引起可逆性的速发感 觉神经毒性。奥沙利铂所致累积性周围神经毒性 的机制仍不明确,根据现有研究结果、认为以下 因素可能与之有关:(1)轴突神经病变:由于长期 的Na+通道的兴奋性增高导致细胞的应激性过高使 神经细胞受损[4];(2)脊神经后根神经节(dorsal root ganglia,DGR)内感觉神经元的形态改变:研究证 实铂类药物的慢性神经毒靶点为DGR,通过抑制 感觉神经元胞体核仁内rRNA合成,使蛋白质合成 障碍,致感觉神经元细胞器出现异常形态变化及 相应的功能损伤[5]。(3)神经生长因子(nerve growth factor,NGF)表达下调:NGF在维持神经元的生 长、发育及功能的完整性方面起重要作用。研究 发现,NGF水平下降与铂类制剂所致的周围神经 系统功能损伤密切相关[6, 7]。
目前,用于奥沙利铂神经毒性防治的药物主 要有B族维生素、钙镁合剂、还原型谷胱甘肽、 卡马西平、中药制剂等,其中钙镁合剂在临床研 究中被证实疗效较明显,但由于它通过螯合奥沙 利铂中的草酸盐而起到预防神经毒性作用,从而 可能使奥沙利铂的疗效下降[8],因此2008年美国 NCCN指南指出不建议应用钙镁合剂来预防奥沙 利铂的神经毒性。现在临床上最常用于预防、治 疗神经毒性的药物还是B族维生素,因此在本研究 中,应用长效维生素B1(呋喃硫胺片)作为对照 药物。
神经节苷脂是含唾液酸的一类膜糖脂的总 称,是正常细胞膜的组成成分,其主要功能是维 持细胞膜的电负性,影响细胞跨膜信号,并启动 膜脂质基团的翻译和表达。它主要通过以下机制 发挥生物学作用[9, 10]:(1)保护细胞膜Na+-K+-ATP酶 和Ca2+-ATP酶活性,稳定细胞膜结构和功能;(2) 阻止Ca2+内流,降低自由基浓度,防止膜脂质水 解,抑制磷脂酶和磷脂酶C的活性;(3)降低兴奋 性氨基酸(EAA)的神经毒性,并且神经节苷脂只对 过度兴奋的EAA受体有抑制作用,而不影响正常 EAA的神经功能;(4)加强神经营养因子对神经细 胞的作用,促进神经再生和恢复,减少病灶周围 神经细胞死亡,促进神经再生;(5)本身具有神经 营养作用,可挽救去除营养物质的神经细胞。由 于神经节苷脂的神经保护机制针对了奥沙利铂急 性和慢性神经毒性产生机制的各个方面,而不涉 及奥沙利铂的抗肿瘤机制,理论上应不影响奥沙 利铂的抗肿瘤效果。
在本研究中,应用神经节苷脂预防奥沙利铂 所致的周围神经毒性,结果显示,与B族维生素相 比,神经节苷脂能显著降低奥沙利铂所致周围神 经毒性(无论是急性还是剂量累积性毒性),且不良 反应的程度也明显下降;同时,在两组患者中观 察到的胃肠道反应、骨髓抑制等化疗相关性不良 反应的发生率均类似,说明神经节苷脂不会增加 化疗的不良反应。
在疗效方面,由于随访时间较短、尚未观察 到辅助化疗患者的中位至肿瘤复发时间;在应用 以奥沙利铂为主的方案进行姑息化疗的患者中,试验组和对照组在ORR、DCR、中位PFS等方面差 异均无统计学意义,初步证实神经节苷脂不会影 响化疗药物的抗肿瘤效果,但由于本组研究中病 例数不多、观察时间较短,因此尚需扩大规模的 研究和长期随访观察进一步证实。
综上所述,神经节苷脂对奥沙利铂所致周围 神经毒性有良好的预防作用,用药时间短、给药 方便,且不影响化疗的疗效、不增加治疗相关性 不良反应,值得在临床开展进一步的大样本、随 机对照研究,以证实其疗效和应用价值。
| [1] | Cassidy J, Misset JL.Oxaliplatin related side effects: Characteristicsand management[J]. Semin Oncol, 2002, 29(5 Suppl 15):11-20. |
| [2] | Lévi F, Misset JL, Brienza S, et al. A chronopharmacologic phaseII clinical trial with 5-fluorouracil, folinic acid, and oxaliplatinusing an ambulatory multichannel programmable pump. Highantitumor effectiveness against metastatic colorectal cancer[J].Cancer, 1992, 69(4):893-900. |
| [3] | Gamelin E,Gamelin L,Bassi L,et al. Clinical aspects and molecularbasis of oxaliplatin neurotoxicity: current management anddevelopment of preventive measures[J]. Semin Oncol, 2002, 29(5Suppl 15):21-33. |
| [4] | Lehky TJ, Leonard GD, Wilson RH, et al. Oxaliplatin-inducedneurotoxicity: acute hyperexcitability and chronic neuropathy[J].Muscle Nerce, 2004, 29(3):387-92. |
| [5] | Cavaletti G, Tredici G, Petruccioli MG, et al. Effects of differentschedules of oxaliplatin treatment on the peripheral nervoussystem of rat[J]. Eur J Cancer, 2001, 37(18):2457-63. |
| [6] | Cavaletti G, Petruccioli MG, Marmiroli P, et al. Circulating nervegrowth factor level changes during oxaliplatin treatment-inducedneurotoxicity in the rat[J].Anticancer Res, 2002,22(6C):4199-204. |
| [7] | De Santis S, Pace A, Bove L, et al. Patients treated with antitumordrugs displaying neurological defi cits are characerized by a lowcirculating level of nerve growth factor[J]. Clin Cancer Res, 2000,6(1):90-5. |
| [8] | Hochster HS,Grothey A,Childs BH. Use of calcium and magnesiumsalts to reduce oxaliplatin-related neurotoxicity[J]. J Clin Oncol,2007, 25(25): 4028-9. |
| [9] | Yin XH, Sun LM, Deng SH. Mechanism of action and clinicalresearch progress of monosialoganglioside[J].Zhongguo Ji CengYi Yao,2006,13(9):1567-9.[尹晓慧, 孙立明, 邓树海. 神经节苷脂作用机制及临床研究进展[J]. 中国基层医药,2006,13(9):1567-9.] |
| [10] | Ning N, Chen NH. Progress in the research of Ganglioside’s biological activities[J]. Sheng Li Ke Xue Jin Zhan, 2009,40(1):24.[宁娜,陈乃宏. 神经节苷脂的生物学活性[J]. 生理科学进展,2009,40(1):24.][ |
 2014, Vol.41
2014, Vol.41