2. 放疗科
2. Department of Radiotherapy
脑恶性胶质瘤呈浸润性生长,边界不清,在 肿瘤周围2 cm以内的正常脑组织中常有肿瘤细 胞,手术难以全切,手术加传统的放、化疗的平 均生存期仅为8~11月,且不良反应大,患者生存 质量不高[1]。近年来,脑恶性胶质瘤治疗多采用 显微手术切除,术后同步放化疗,但有关脑恶性 胶质瘤显微手术全切后间质内ACNU与TMZ会师 化疗同步适形放疗的临床疗效和安全性的研究较 少。为探讨治疗恶性胶质瘤更为安全有效的治疗 方法,我科收集2003年2月—2009年6月99例术后 病理证实为恶性胶质瘤有完整资料的病例,分析 评估脑恶性胶质瘤的优化方案及效果,现总结报 道如下。 1 资料与方法 1.1 研究对象 病例纳入标准:(1)年龄≥18,Karnofsky 评分≥60;(2)心、肺、肝、肾等重要脏器功 能正常,HGB≥100 g/L,WBC≥4×109/L,PLT≥ 100×109/L;(3)所有患者均首次就诊,脑肿瘤诊 断明确,接受显微镜下全切肿瘤手术治疗,术中 尽量保持瘤腔的圆锥形态及可靠的瘤腔封腔,术 后病理结果均证实为恶性脑胶质瘤(WHOⅢ~Ⅳ 级);(4)术后无严重并发症,包括术后颅内血 肿、颅内感染等;(5)非妊娠期或哺乳期妇女; (6)患者均有完整的就诊病案资料并得到随访。 共收集99例脑恶性肿瘤,其中男48例,女51例, 年龄21~67岁,中位年龄42岁。肿瘤位于额叶26 例、颞叶31例、顶叶9例、颞顶叶17例、颞枕叶12 例、基底节区4例。术后病理诊断间变性星形细胞 瘤Ⅲ级33例、间变性少突胶质细胞瘤Ⅲ级19例、 间变性少突-星形细胞瘤17例、间变性室管膜细胞 瘤Ⅲ级6例、髓母细胞瘤Ⅳ级3例、室管膜母细胞 瘤Ⅳ级2例、多形胶质母细胞瘤Ⅳ级19例。 1.2 病例分组及治疗方案 术后治疗方式的选择和分组,依据患者及 家属的要求在知情同意的情况下进行,分为以 下四组:术后单纯放疗组(radiotherapy,RT) 21例、术后尼莫司汀(nimustine,ACNU)间 质化疗联合放疗组(ACNU+RT)24 例,术 后替莫唑胺(temozolomide,TMZ)口服化疗 同步放疗组(TMZ+RT)23 例、术后间质内 ACNU与口服TMZ会师化疗同步适行放疗组 (ACNU+TMZ+RT)31例。四组性别(χ 2= 0.621,P=0.731)、年龄(χ 2=0.843,P= 0.467)、肿瘤病理分级(χ 2=2.131,P=0.386) 及术后1周Karnofsky≥60(χ2=0.339,P=0.95)间比 较差异无统计学意义。RT组:在手术切口愈合、 血象正常时开始选用6 MV-X线进行三维适形放 疗。靶区的确定参考术前及术后MRI(平扫+增 强),临床靶区(clinical tumor volume,CTV) 为肉眼肿瘤区(cross tumor volume,GTV)+周 围水肿区+外放2.0~3.0 cm,计划靶区(planning tumor volume,PTV)为CTV+外放0.3~0.5 cm。 主要考虑摆位的误差及患者的移动等。照射剂量 为(50~60)Gy/(25~30)次,5~6 周。
ACNU+RT组:术中安置化疗泵,将Ommaya 囊的输出端埋入瘤腔中,Ommaya囊埋植于皮 下。于术后1周应用20%甘露醇125 ml加地塞米 松2.5 mg开放血脑屏障和减轻化放疗反应,0.5 h 后Ommaya囊内注射经体外敏感实验选择的敏感 ACNU药物注射。敏感ACNU 25 mg,用0.9%氯化 钠溶液10 ml稀释,抽取1 ml,用4号半针经皮穿刺 Ommaya囊,空针抽出肿瘤残腔的液体,固定稳妥 并向囊内注入1 ml ACNU化疗药物作为实验剂量缓 慢注入,观察有无不良反应。连用3 d ACNU间质 化疗。术后第1、5、9、13、17 周分别化疗1个疗 程,化疗的同时给予RT。
TMZ+RT组:口服TMZ,最初剂量为按体表 面积一次100 mg/m2,1次/天,在28 d为一治疗周期 内连续服用5 d。如果治疗周期内,第22 d与第29 d (下一周期的第一天)测得的绝对中性粒细胞数 (ANC)≥1.5×109/L,血小板数≥100×109/L时, 下一周期的剂量将增加50 mg/㎡,1次/天,在28 d 的治疗周期内连续服用5 d。在治疗期间,第22 d (首次给药后的21 d)或其后48 h内检测患者的全 血数,之后每星期测定一次,直到测得的绝对中 性粒细胞数(ANC)≥1.5×109/L,血小板数≥100 ×109/L时,再进行下一周期的治疗。在任意治疗 周期内,如果测得的绝对中性粒细胞数(ANC) <1.0×109/L或者血小板数<50×109/L时,下一周期 的剂量将减少50 mg/㎡,但不得低于最低推荐剂量 100 mg/m2。每4 周(28 d)为一周期,维持4~6周 期化疗,同时给予RT。
ACNU+TMZ+RT组:RT期间同步ACNU间质化疗的同时,给予TMZ 100 mg/(m2·d),睡前 口服,连用5 d,均为4 周(28 d)为一周期,连续 应用4~6周期。 1.3 疗效评价及不良反应观察
各组患者术后均定期复查头颅CT或MRI及血 常规,以了解患者手术后恢复及肿瘤复发情况, 术后定期行Karnofsky评分以评价患者术后的生存 质量。每周进行一次血常规检查,每隔4周检查 肝、肾功能及常规体检,以评价药物毒性和患者 耐受性,进行临床评价,以便调整用药,直至给 药结束为止。每4~6周复查头颅CT或者MRI检查 以判定肿瘤生长情况见图1~图3。不良反应以主观 症状和客观体征评价为主,按WHO标准分为0~Ⅳ 度。
 |
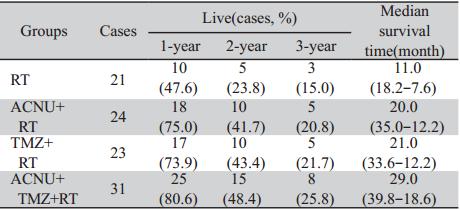
A,B: enhanced MRI simulation before operation. There was an obvious enhancement with irregular margin in the left temporal lobe. C,D:enhanced MRI simulation 3 months after operation. There was no obvious enhancement in the left temporal lobe 图1 56岁男性间变性少突-星形细胞瘤(WHO Ⅲ级)患者手术前后增强MRI对比 Figure 1 Comparison of enhanced MRI simulation of a 56 years old male with anaplastic oligoastrocytoma(WHO grade Ⅲ)before and after operation |
 |
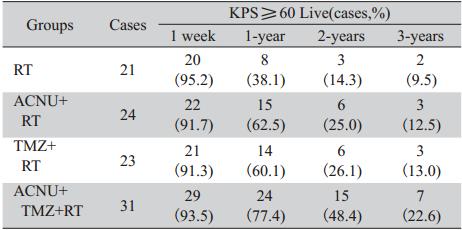
A,B:enhanced MRI simulation before operation. There was a large cystic lesion with obvious enhancement of the cystic margin in the right parietal lobe.C,D:enhanced MRI simulation 3 years after operation. There was no obvious enhancement in the right parietal lobe 图2 42岁女性间变性星形细胞瘤(WHO Ⅲ级)患者手术前后增强MRI对比Figure 2 42Comparison of enhanced MRI simulation of a 42 years old female with anaplastic astrocytoma(WHO grade Ⅲ)before and after operation |
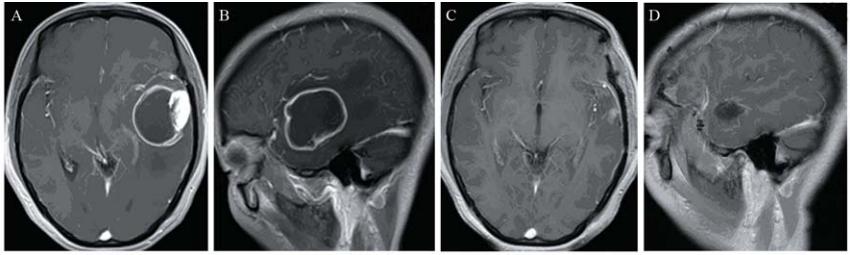 |
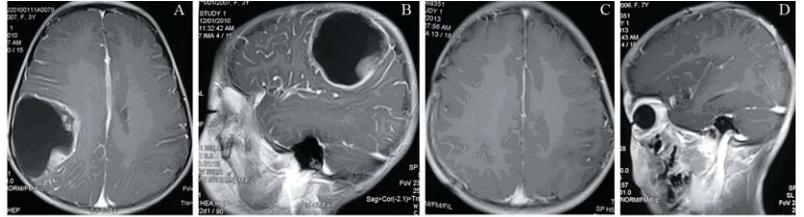
A,B:enhanced MRI simulation before operation. There was a large cystic lesion with obvious enhancement of the cystic margin in the left temporal lobe. C,D:enhanced MRI simulation 3 months after operation. There was no obvious enhancement in the left temporal lobe 图3 40岁女性间变性星形细胞瘤(WHO Ⅲ级)患者手术前后增强MRI对比Figure 3 Comparison of enhanced MRI simulation of a 40 years old female with anaplastic oligoastrocytoma(WHO grade Ⅲ)before and after operation |
采用SPSS13.0进行分析,中位存活时间以 M(P25~P75)表示。采用Kaplan-Meier方法绘制生存 曲线,采用Logrank检验对四组生存曲线进行检 验,检验水准α=0.05。采用R×C表卡方检验对四组 患者的生存质量检验,检验水准α=0.05。 2 结果 2.1 临床疗效 2.1.1 生存时间分析
四组脑胶质瘤患者存活率 及中位生存时间见表1,生存曲线见图4。RT 组与 TMZ + RT 组和ACNU + RT 组的生存曲线比较, 差异有统计学意义(χL2=8.313和8.825,P=0.003和 0.012),即ACNU + RT组和TMZ + RT组的中位生 存时间长于RT 组;ACNU + RT 组和TMZ + RT组 生存曲线差异无统计学意义(χL2=0.047,P=0.915), 即ACNU + RT 组和TMZ + RT组生存时间差 异无统计学意义。ACNU+TMZ+RT分别与 ACNU+RT、TMZ+RT的生存曲线比较差异有统计 学意义(χL2=21.045和22.385,P=0.043和0.045),即 ACNU+TMZ+RT中位生存时间长于ACNU + RT 组 和TMZ + RT 组。
|
|
表1 四组脑胶质瘤患者生存时间比较 Table 1 Comparison of survival time of glioma patients in four groups |
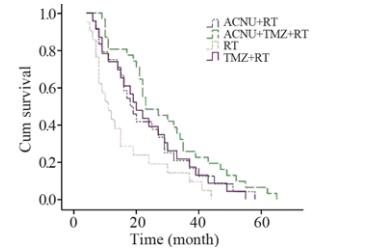 | 图4 四组脑胶质瘤患者生存曲线图Figure 4 Survival curves of glioma patients in four groups |
四组胶质瘤患者术后头痛、恶 心、呕吐等高颅压症状消失,癫痫发作得到控制, 意识障碍得到纠正或均恢复正常,偏瘫和偏身感觉 异常均有不同程度的恢复或改善。四组胶质瘤患者 术后Karnofsky≥60比较,见表2。四组胶质瘤患者 术后1周的Karnofsky≥60比较,差异无统计学意义 (χ2=0.339,P=0.95),即术后1周四组患者生活质量 无明显差异;术后1、2年的Karnofsky≥60比较, 差异均有统计学意义(χ2=8.199和7.864,P=0.042和 P=0.049),即术后1、2年ACNU+TMZ+RT组生存质 量明显优于RT组、ACNU+RT 组及TMZ+RT 组; 术后3年的Karnofsky≥60比较,差异无统计学意义 (χ2=2.059,P=0.560),即术后3年四组患者生活质 量差异无统计学意义。
|
|
表2四组脑胶质瘤患者Karnofsky≥60比较 Table 2 Comparison of Karnofsky≥60 of glioma patients in four groups |
四组脑胶质瘤患者治疗过程中未发现明显的 不良反应。最常见的不良反应为可耐受的胃肠道 反应、头痛、发热,均口服护胃、脱水与激素等对 症治疗后症状缓解。四组患者治疗期间出现不同 程度的白细胞减少,RT、ACNU+RT、TMZ+RT和 ACNU+TMZ+RT组Ⅰ和Ⅱ度骨髓抑制为82.6%(17 例)、83.3%(20例)、76.2%(18例)、77.4%(24 例),Ⅲ和Ⅳ度骨髓抑制发生率分别为17.4%(4例)、 16.7%(4例)、23.8%(5例)、22.6%(7例),差异无统计 学意义(χ2=0.186,P=0.876),经 应 用 升白 剂 治 疗 后白 细胞均在短期内恢复。每一周期均行血常规、肝功 能、肾功能检查,未见明显的骨髓及肝功能损害。 3 讨论
综合治疗脑胶质瘤是现代神经外科的发展理 念,主张采用手术、放疗、化疗的综合治疗[2]。传 统的外科手术治疗是脑胶质瘤主要的,也是基础的 治疗手段,通过显微镜下手术切除肿瘤,可以明显 减少肿瘤细胞数量、缓解症状,同时可以行病理学 肿瘤分类及药物敏感度实验研究,为将来的进一步 放化疗提供指导。由于手术刺激会激活处于休眠期 的肿瘤细胞迅速处于增殖期,导致术后短期内肿瘤 再次复发同时恶性程度增高,故显微手术切除肿瘤 治疗仅仅是胶质瘤治疗的开始,是胶质瘤综合治疗 的基础。术后依据肿瘤的种类、病理分级及药物敏 感度实验研究,积极给予早期的、分步的、多阶段 的及放化疗相结合的综合治疗[2, 3, 4]。
脑胶质瘤的常规化疗效果较全身其他部位的肿 瘤效果较差,主要因为药物难以通过血脑屏障、药 物本身对肿瘤细胞的敏感度较差。术后通过瘤腔安 置Ommaya囊,早期行敏感药物间质化疗,不仅避开血脑屏障,局部敏感化疗药物直接与残存肿瘤细胞 接触,药物浓度高,治疗作用更佳,全身其他部位因 无药物分布而无不良反应[5, 6]。Bodell等[7]研究表明局 部间质化疗,局部化疗药物浓度可达静脉给药时的 13倍以上,药物局部渗透可达瘤腔周围2.5 cm范围, 本研究应用的间质化疗药物ACNU,是 种 较 强的 抗 细胞有丝分裂剂,主要作用于肿瘤细胞的G1期和S 期,对增殖和非增殖肿瘤细胞群均有效。放疗通过 破坏细胞的染色体,使细胞生长停止,对抗快速生 长分裂的肿瘤细胞具有强杀灭作用,但对S期和非 增殖期细胞敏感度差,故放疗与上述药物之间具有 细胞周期时相互补性。Hart等[8]分析了CENTRAL、 MEDLINE、EMBASE及Science Citation Index等权威 发布的近20年恶性胶质瘤术后瘤腔间质化疗数据, 结果显示,脑恶性胶质瘤术后放疗加瘤腔卡莫司 丁(BCNU)间质化疗较单纯术后放疗生存率明显提 高,该结果与本课题组早期的结果一致 [9]。ACNU与 BCNU同为亚硝脲类药物,本研究结果显示,ACNU + RT 组生存曲线显著优于RT 组,即ACNU+RT组脑 胶质瘤患者的生存率和中位生存时间分别高于和长 于RT组,且整个过程未出现明显不良反应。结果提 示,脑恶性胶质瘤显微手术后间质内ACNU化疗同 步适形放疗疗效优于单纯适形放疗。
TMZ是咪唑四嗪类衍生物,为第二代口服烷化 剂类抗肿瘤药物,口服给药吸收快,易通过血脑屏 障,中枢神经系统的药物浓度为30%~40% [10],其 在经非酶催化快速转变为活性化合物甲基三氮烯 咪唑,并对肿瘤细胞的核酸、蛋白质及肽亲核区发 生作用,作用于肿瘤细胞分裂的各个时期,为细胞 周期非特异性药物,具有广谱抗肿瘤活性[11]。研究 证实,TMZ不仅本身杀灭恶性胶质细胞,而且具有 放疗增敏作用[10]。同时秦德兴等 [12]的研究证实了脑部放疗能短暂破坏血脑屏障,认为照射脑组织使毛 细血管内皮细胞膜及神经胶质细胞膜通透性增加, 致使血脑屏障功能下降直至丧失。因此,可以认为 在治疗颅内肿瘤时,应先放疗,使血脑屏障的通透 性增高,便于化疗药物通过,也促进化疗药分布于 瘤腔的浓度。本研究结果显示,TMZ + RT组脑胶 质瘤患者的生存率和中位生存时间分别高于和长于 RT组,而与ACNU+RT组相当,且整个过程未出现 明显不良反应。结果表明,脑恶性胶质瘤显微手术 后同步放化疗(TMZ+RT)组患者疗效优于单纯适 形放疗(RT)组,与间质内ACNU化疗联合同步适 形放疗组相比差异无统计学意义。
ACNU间质化疗不仅避开了血脑屏障,直接达 到药物最高浓度,实现以“点到面”方式,辐射向瘤腔 周围而杀灭残存肿瘤细胞。同时与口服易通过血脑 屏障的TMZ,实 现 以“面到点”方式,辐辏向瘤腔聚集而杀灭残存肿瘤细胞,形成会师化疗,达到立体 全方位杀灭残存肿瘤细胞的目的。放、化疗联合同 步进行可抑制残存肿瘤细胞的放射性亚致死损伤潜 在致死损伤的修复,具有内在的放疗增敏作用[13]。 三者协同并相互增敏最大限度的杀灭显微手术全切 后残存的肿瘤细胞,延长患者的生存率。本研究结 果显示,ACNU+TMZ+RT组患者的生存率和生存 期均明显优于ACNU+RT及TMZ+RT组,同时显 示,术后1、2年ACNU+TMZ+RT组生存质量明显 优于RT、ACNU+RT及TMZ+RT组,并且整个放化 疗过程无明显的不良反应,显著提高了患者的生存 质量。结果表明,脑恶性胶质瘤显微手术力争全切 除,术后间质内ACNU与TMZ会师化疗同步适形放 疗是脑恶性胶质瘤较优化的综合治疗方案,可显著 延长患者的生存时间,提高患者的生存质量。
| [1] | Kogel D,Fulda S,Mittelbronn M.Therapeutic exploitation of apoptosis and autophagy for glioblastoma[J].Anticancer Agents Med Chem,2010,10(6):438-49. |
| [2] | Rainov NG,Heidecke V.Clinical development of experimental therapies for malignant glioma[J].Sultan Qaboos Univ Med J,2011,11(1):5-28. |
| [3] | Tugeu B, Postalci LS,Gunaldi O,et al.Efficacy of clinical prognostic factors on survival in patients with glioblastoma[J].Turk Neurosurg,2010,20(2):117-25. |
| [4] | Bu XY,Zhao YW,Zhang YF,et al.Individual comprehensive therapy study for malignant human brain gliomas[J].Yi Xue Yan Jiu Tong Xun,2004,33(24):44-6. [步星耀,赵跃武,张永福,等.人脑恶性胶质瘤个体化综合治疗研究[J].医学研究通讯,2004,33(24):44-6.] |
| [5] | Bu XY,Zhao HW,Hu MW,et al. Clinical analysjs of interstitiaI chemotherapy concurrent with sensitive radiotherapy for postoperative glioma patients[J]. Shi Yong Zheng Duan Yu Zhi Liao Za Zhi, 2004,18(3):168-70. [步星耀,赵红卫,胡明伟,等. 脑胶质瘤术后敏感药物间质化疗联合增敏放疗的临床分析[J].实用诊断与治疗杂志,2004,18(3):168-70.] |
| [6] | Wang YW,Liu JB,Li HR,et al.Effects of three-dimensional confornal radiotherapy combined with different chemotherapy in treatment of post-operative malignant glioma[J]. Zhengzhou Da Xue Xue Bao(Yi Xue Ban),2012,47(3):367-70. [王跃伟,刘建波,李会荣,等.脑恶性胶质瘤术后适形放疗联合不同形式化疗的临床观察[J].郑州大学学报(医学版),2012,47(3):367-70.] |
| [7] | Bodell WJ,Bodell AP,Giannini DD. Levels and distribution of BCNU in GBM tumors following intratumoral injection of DTI015(BCNU-ethanol) [J].Neuro Oncol,2007,9(1):12-9. |
| [8] | Hart MG,Grant R,Garside R,et al. Chemotherapy wafers for high grade glioma[J].Cochrane Database Syst Rev,2011,(3):CD007294. |
| [9] | Bu XY,Zhang YF,Chai C,et al. Clinical observation of ACNU interstitial chemotherapy concurrent with radiotherapy for postoperative malignant gliomas[J].Henan Zheng Duan Yu Zhi Liao Za Zhi,2001,15(4):196-7. [步星耀,张永福,柴昌,等. 恶性脑胶质瘤术后嘧啶亚硝脲间质化疗同步放疗临床观察[J].河南诊断与治疗杂志,2001,15(4):196-7.] |
| [10] | Ostermann S,Csajke C,Bucilin T,et al. Plasma and cerebrospinal fluid population pharmacokinetics of temozolomide in malignant glioma patients[J].Clin Cancer Res,2004,10(11):3728-36. |
| [11] | Kroemer G,Galluzzi L,Brenner C. Mitochondrial membrane permeabilization in cell death[J]. Physiol Rev, 2007,87(1):99-163. |
| [12] | Qin DX,Zheng R,Ma JL,et al.Influence of Radiation reducing the blood-brain barrier and promoting the permeability of chemotherapy drugs[J].Zhongguo Yi Xue Ke Xue Yuan Xue Bao,1999,21(4):307-10. [秦德兴,郑蓉,马金兰,等.放射线照射降低血脑屏障的作用及促进化疗药物的渗透性[J].中国医学科学院学报,1999,21(4):307-10.] |
| [13] | Pawlik TM,Keyomarsi K.Role of cell cycle in mediating sensitivity to radiotherapy[J].Int J Radiat Oncol Biol Phys,2004,59(4):928-42. |
 2014, Vol.41
2014, Vol.41