2.影像诊断科;
3.病理科
2.Department of Diagnostic Imaging;
3.Department of Pathology
随着乳腺癌发病率不断上升,及早诊断对 于治疗效果有极其重要的临床意义。其中,越 来越多临床上未能触诊的乳腺导管内癌(ductal carcinoma in situ,DCIS)被早期发现。钼靶一直 是诊断乳腺导管内癌的首选方法。然而,随着超 声仪器分辨力及诊断水平的提高,乳腺导管内癌 检出率也有很大提高。本文以病理结果为标准,旨在探讨彩超、数字化钼靶摄影及两者联合诊断 DCIS的敏感度,评价两者的异同,为合理应用诊 断方法,提高诊断DCIS水平提供依据。 1 资料与方法 1.1 研究对象
收集2010年12月—2012年12月间在武汉市 中心医院住院行手术治疗的73例乳腺疾病患 者的79个乳腺异常病灶,并经病理证实其中 48个病灶为DCIS,术前均经彩超(color doppler ultrasonography,CDUS)及钼靶检查,两种检查 手段时间间隔在半月之内。患者均为女性,年龄 25~78岁,平均45.4 ±6.2岁。临床触诊病灶32个,未触诊病灶16个。其中左侧乳腺30个,右侧乳腺 18个。35例病灶位于外上象限,13例病灶分布于 另外三个象限。 1.2 仪器与方法
CDUS检查:采用Philips HD11XE及iu22彩超 诊断仪,探头频率为7~10 MHZ。患者仰卧位, 充分暴露双侧乳房,以乳头为中心,先顺时针扇 形扫查,然后由上至下横向扫查整个乳腺区域, 重点检查病灶数目、大小、形态、边界、有无包 膜、内部血流、内部有无钙化及钙化大小;另外 观察病灶周边导管扩张及有无紊乱。乳腺无病灶 时,应该重点检查腺体紊乱区域及血流情况。最后 应该常规检查腋窝淋巴结大小、形态及血流情况。
数字化钼靶摄影检查:采用Planmed Sophie 钼 靶X线机摄片。摄片体位: 常规采用双侧乳腺轴位 (CC位)和外侧斜位(MLO位),必要时加侧位 或任意位摄影,采用自动曝光条件,获取图像进 行处理,然后作出诊断。观察病灶位置、大小、 边缘、密度及与周边腺体的分界情况;重点观察 肿块有无钙化及钙化大小、形态、分布等;最后还 应观察乳腺区域有无结构紊乱、腺体有无不均匀致 密等情况。将上述诊断特点同CDUS特点比较。 1.3 统计学方法
使用SPSS17.0统计软件进行分析,组间参数 间采用χ2检验,P<0.05为差异有统计学意义。 2 结果
73例患者双乳共检出并行病理确诊病灶共79 个,48个病灶为DCIS、15个病灶为导管内乳头状 瘤、7个病灶为乳腺纤维腺瘤、5个病灶为导管内 乳头状瘤癌变、4个病灶为乳腺导管扩张伴导管内 感染。 2.1 病理诊断
48个DCIS病灶均经手术和病理证实。大体标 本肉眼见肿块边界欠清,表面灰白,发黄,质地 较硬。部分为粉刺状,少数标本未见明显肿块, 切面呈颗粒状。镜下观察,DCIS主要分布于中小 导管,内充满中度异型癌细胞,中心坏死,管壁 基底膜完整,未见明显浸润现象。 2.2 三种检查方法对比
CDUS检出71个异常病灶,总检出率89.87% (71/79),诊断DCIS 32个,诊断良性病灶数目 为28个,准确性75.94%(60/79);钼靶检出65个 异常病灶,总检出率82.28%(65/79),诊断DCIS 34个,诊断良性病灶数目为25个,准确性74.68% (59/79),两种方法DCIS总检出率差异无统计学 意义(χ2=1.901,P=0.168,P>0.05);两者联用 共诊断DCIS 46例,准确性93.67%。两者联用与单 一方法应用诊断效能比较,见表 1 。
| 表 1 DCIS患者超声及钼靶检查敏感度和特异性结果对比 Table 1 Comparison of CDUS and digital mammography (DM)in evaluating curative effect of breast ductal carcinoma |
DCIS彩超诊断特征:根据形态特征,分为 (1)实性肿块型:48个病灶中,28个病灶二维 声像图显示病灶呈低回声,形态不规则,周边无 包膜,内部回声不均,周边可见少许无回声分 布,沿导管长轴方向生长,肿块两端导管明显扩 张,少数病例内见微小钙化,彩色多普勒超声 (CDFI)仅显示少许血流信号,见图1、2;(2) 导管扩张型:48个病灶中,8个病灶二维声像图显 示乳腺导管不规则扩张,局部明显扩张,内未见 明显实性肿块,部分导管壁增厚,透声差部分或 可见少许低回声,少数病例导管内见微小钙化, CDFI未见血流信号;(3)局部腺体结构紊乱型: 48个病灶中,12个病灶二维声像图显示乳腺局部 腺体结构紊乱,未见明显包块,紊乱腺体区域回 声减低,周边导管不规则扩张,局部明显扩张, 透声差,局部可见低回声,少数病例导管内见微 小钙化,CDFI见少许血流信号。
DCIS数字化钼靶摄影特征:恶性钙化影:表 现为线样、树枝状、小棒形、细沙样或多形性。 钙化灶成簇分布(指钙化点>5枚/cm2)30个病 灶,均位于同一象限,23个病灶伴有肿块。软组 织块影18个病灶:表现为圆形、类圆形或不规则 形,密度稍高或者等密度,边缘尚清。其中7个病 灶伴有明显毛刺,11个病灶扭曲或特殊征象,表现 为局部腺体紊乱、收缩或有放射状影,见图 1、2。 DCIS彩超和钼靶的影像学特征表现,见表 2。
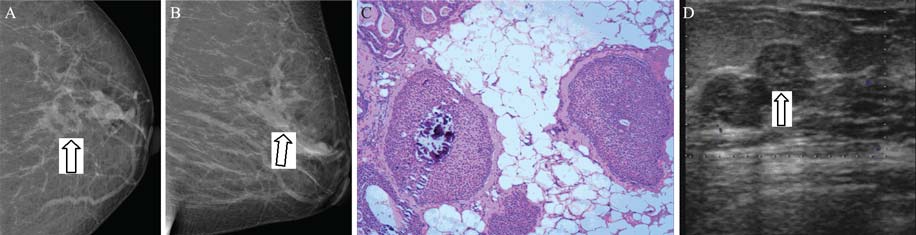 | 图 1 同一DCIS患者的乳腺数字钼靶、病理及CDUS图Figure 1DM,HE image and CDUS image of the same breast lesionA:cranio-caudal (CC) view;B:medio-lateral oblique (MLO) view;A,B:isodense lesion with irregular shape and margin infi ltration. Microcalcifi cation spots in focus are demonstrated in the lesion (white arrow);C:HE image( ×100 magnification) of sections of the lesion;D:US image shows a hypoechoic lesion in the breast ductal. Microcalcifi cations may be seen in the lesion (white arrow) |
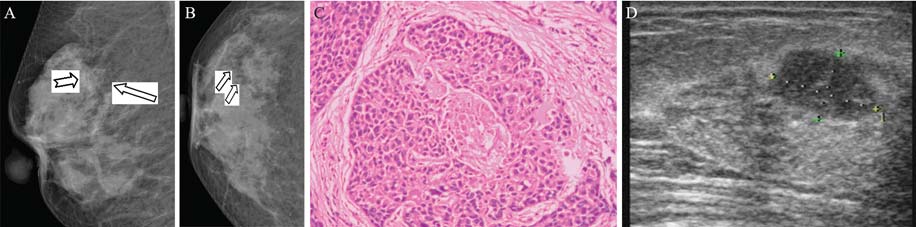 | 图 2 同一DCIS患者乳腺CDUS、钼靶及病理图Figure 2DM image,HE image and CDUS image of the same breast lesionA:cranio-caudal (CC) view;B:medio-lateral oblique (MLO) view;A:isodense lesion with irregular shape and margin infi ltration (white long arrow);Microcalcifi cation spots in focus are demonstrated in the lesion (white short arrow);B:isodense lesion with microcalcifi cation spot in focus (white arrow);C:HE image( ×200 magnifi cation) of sections of the lesion;D:US image shows a hypoechoic lesion in the breast |
| 表 2 DCIS患者彩超与钼靶检查影像学特征比较 Table 2 Comparison of CDUS and digital mammography (DM) |
乳腺导管内癌为乳腺非浸润性癌,起源于乳 腺终末导管小叶单位,由导管上皮增生发展为非典型性增生,进一步发展为乳腺导管内癌,此期 肿瘤细胞仍在基底膜内生长,缺乏转移能力。如不 及时治疗,可发展为浸润性癌[1]。所以及早诊断 对于预后有极其重要的意义。随着超声仪器分辨 力及超声医师诊断水平不断提高,超声(CDUS) 在DCIS诊断中越来越重要[2]。但是超声对于部分 DCIS病灶内微小钙化显示率较钼靶差,因而超声 结合钼靶可明显提高诊断DCIS的准确率。
本研究中CDUS和钼靶在DCIS敏感度方面 差别不大,分别为66.67%(32/48)和70.83% (34/48)。然而两者结合诊断,敏感度较高, 达到95.83%(46/48)。对于两者诊断特点比较 如下:(1)本研究对于结节边界不清检出率 CDUS和钼靶分别为85.19%(23/27)、59.26% (16/27),差异有统计学意义(P<0.05)。有研 究显示DCIS结节密度多数较致密且不均匀,边 界模糊,部分见小分叶[3] ,见表 2。钼靶对于结 节边界的显示较差,结节内部密度显示也稍差, 而CDUS能够清晰显示结节的边界及内部回声等 情况。因此,CDUS对诊断DCIS可以提供重要依 据。(2)CDUS对结节内部微小钙化的检出率难 以与钼靶相媲美,本研究CDUS和钼靶对于结节内 微小钙化检出率分别为37.14%(13/35)、77.14% (27/35),差异有统计学意义(P<0.01),见表 2。由于DCIS结节早期常出现微小钙化,所以及早 发现微小钙化对于诊断DCIS非常重要。微小钙化 形成是由于癌细胞生长较快,肿瘤血管及纤维组 织增生旺盛,比较容易出现钙盐沉积。另外,肿 瘤本身分泌一些物质像糖蛋白和黏多糖有可能是 导致钙化的重要原因[4]。CDUS对于微小钙化的检 出率低,可能与微小钙化显示为小的强光点、易 与相对导管强回声壁或copper韧带横切面相混淆有关[5]。而钼靶能清晰显示仅0.1 mm的微小钙化,并 且能够清楚地显示它分布的形态、特点及范围[6]。
虽然钼靶对于腺体结构局部紊乱内微小钙化 分辨力较高,但它也有一定的缺陷,对于导管扩 张或腺体结构局部紊乱/不对称性致密伴腺体结构 紊乱型DCIS,CDUS诊断率仍高于钼靶。主要原 因在于腺体内微小钙化既可分布于DCIS和浸润性 导管癌[2] ,也可分布于良性病变[7]。钼靶对于腺体局 部紊乱未见结节而只显示微小钙化时,只有分布 典型的簇状钙化才可能提示恶性病变。即使钼靶 在腺体致密性乳腺内发现异常病灶,它通常受腺 体掩盖或重叠影响而不易定性。而CDUS不受腺体 多寡的影响,能清晰显示钙化周边结节特征,病 灶内部回声、形态及边缘等特点,分析结节的良 恶性。另外彩色多普勒血流显像也是超声一大优 势,它能动态观察结节内血流情况,从而作出定 性诊断[8]。因此,超声对于腺体致密乳腺诊断有其 自身价值[9, 10, 11],可弥补钼靶在这方面的缺陷。
本组CDUS误诊16例,其中7例误诊为导管内 乳头状瘤,特征为局部导管明显扩张,内见实性 结节,未见明显微小钙化,而钼靶上显示实性结 节内见多发微小钙化;3例误诊为乳腺增生结节, 特征为局部导管紊乱,导管稍宽,未见明显微小 钙化,钼靶上未显示微小钙化;另6例显示阴性。
分化程度较低DCIS早期就可以出现腋窝淋巴 结转移,易发展为浸润性导管癌[12]。对于部分肿 块小而分化程度较低的DCIS单独通过活检后长时 间随访发现部分病例发展成浸润性导管癌,并且 位于同一象限[13]。CDUS对于早期诊断腋窝淋巴 结转移有更大的意义。如果淋巴结髓质消失或偏 心、纵横比大于1及内部血流紊乱、丰富不规则达 皮质应该高度怀疑淋巴结转移。本组病理证实2例 低分化淋巴结发现同侧腋窝淋巴结转移。而钼靶 对于转移性淋巴结诊断率较差。
综上所述,CDUS发现不能确定的结节、可 疑钙化点及怀疑乳腺导管疾病时,应建议钼靶检 查有无簇状微小钙化;放射医师发现腺体局部致 密、密度增高及乳腺肿块难以定性时,应建议 CDUS检查。两者结合可优势互补,提高DCIS诊 断准确性。
| [1] | Zhou HH, Xu QH, Yan S. Ultrasonographic diagnosis of breast ductal carcinoma in situ[J]. Zhongguo Chao Sheng Yi Xue Za Zhi, 2008, 24(4):367-9.[周辉红,徐秋华,燕山. 乳腺导管内癌的超声 研究[J].中国超声医学杂志,2008,24(4):367-9.] |
| [2] | Zhu QL, Jiang YX, Liu H, et al. Initial experiences of diagnosis on the non-invasive breast cancer: comparison of conventional ultrasound and real-time elastography[J]. Zhongguo Yi Xue Ying Xiang Ji Shu,2008,2(4):683-6.[朱庆莉,姜玉新,刘赫,等.常规超声 结合超声弹性成像对乳腺导管内癌诊断的初步探讨[J].中国医 学影像技术,2008,24(5):683-6.] |
| [3] | Li XM ,LI YH ,Tian JM,et al. Evaluation of peripheral artery stent with 64-slice multi-detector row CT angiography: prospective comparison with digital subtraction angiography[J]. Eur J Radiol, 2010,75(1):98-103. |
| [4] | Khoo ML, Asa SL,Writterick IJ,et al. Thyroid calcification and its association with thyroid carcinoma [J]. Head Neck,2002 ,24 (7):651-5. |
| [5] | Xie F, Zhou B, Yang DQ, et al. Value of mammography and ultrasonography in diagnosis of breast ductal carcinoma in situ[J]. Zhongguo Yi Xue Ying Xiang Ji Shu,2012,28(7):1314-7.[谢菲,周 波,杨德起,等.钼靶X线及超声在乳腺导管原位癌诊断中的价 值[J].中国医学影像技术,2012,28(7):1314-7.] |
| [6] | Fischer U, Baum F,Obenauer S, et al.Comparative study in patients with microcalcifications:full-field digital mammography vs screen-fi lm mammography[J]. Eur Radiol,2002,12(11):2679-83. |
| [7] | Xu P, Hua XY, Shan JL, et al. High-frequency ultrasonographic evaluation of breast microcalcification[J]. Zhongguo Yi Xue Ji Suan Ji Cheng Xiang Za Zhi, 2003,9(4):290-2.[许萍,华秀云,单洁 玲,等. 乳腺微小钙化灶的高频超声声像图评价[J]. 中国医学计 算机成像杂志,2003,9(4):290-2.] |
| [8] | Li HL, Jiang YX, Hao YZ, et al. Comparison results of breast ultrasound, mammography and combination of both modalities[J], Zhonghua Chao Sheng Ying Xiang Xue Za Zhi,2006,15(12):910-3.[李洪林,姜玉新,郝玉芝,等.乳腺超 声与钼靶摄影的比较与联合应用[ J ] .中华超声影像学杂 志,2006,15(12):910-3.] |
| [9] | Leconte I,Feger C,Galant C,et al. Mammography and subsequent whole-breast sonography of nonpalpable breast cancers: the importance of radiologic breast density[J]. AJR Am J Roentgenol, 2003,180(6):1675-9. |
| [10] | Crystal P,Strano S,Shcharynski S,et al. Using sonography to screen women with mammographically dense breasts[J]. AJR Am J Roentgenol,2003,181(7):177-82. |
| [11] | Zonderland HM,Coerkamp EG, Hermans J,et al. Diagnosis of breast cancer: contribution of US as an ajunct to mammography[J]. Radiology,1999,213(2):413-22. |
| [12] | Innos K,Horn-Ross PL. Risk of second primary breast cancers among women with ductal carcinoma in situ of the breast[J]. Breast Cancer Res Treat,2008,111(3):531-40. |
| [13] | Zhang WX, Jiang WY, Dai WJ, et al. [J]. Clinical characteristics and selection of surgical treatment of ductal carcinoma in situ[J]. Zhonghua Nei Fen Mi Wai Ke Za Zhi,2012, 6(2):112-3,116.[张伟 欣,姜文玉,代文杰,等.乳腺导管内癌临床特点与外科治疗的选择[J].中华内分泌外科杂志,2012,6(2):112-3,116.] |
 2014, Vol.41
2014, Vol.41