恶性肿瘤患者血浆高凝状态与患者预后及基 本生活质量密切相关[1]。D-二聚体是交联纤维蛋白 特异性的降解产物,它的生成和增高反映了凝血 和纤溶系统的激活,是继发性纤溶状态的特异性 指标,可以灵敏反映体内凝血和纤溶状态。肿瘤 患者血浆D-二聚体水平的升高与肿瘤的转移、进 展和不良的预后相关[2, 3]。D-二聚体水平定量测定 越来越多地被推荐为恶性肿瘤患者预后状态的评 价指标[4],但是目前尚未有研究评估恶性肿瘤临终 患者自身血浆D-二聚体动态变化情况与不良预后 的关系。本研究对72例恶性肿瘤临终患者临终前 0~4周血浆D-二聚体检测值与临终4~8周血浆D-二 聚体检测值的动态变化情况进行分析,观察恶性 肿瘤临终患者血浆D-二聚体水平变化与不良预后 之间的关系。 1 资料与方法 1.1 一般资料
选取2009年6月至2012年2月在上海同济大学 附属第十人民医院肿瘤科住院的患者72例,均经 临床检查、影像学或病理确诊为恶性肿瘤。患者 主要死因均为晚期恶性肿瘤,排除因突发性疾病 死亡的患者。患者年龄25~80岁,其中<60岁的患 者34例,≥60岁的患者38例;男41例,女31例; Ⅲb期2例,Ⅲc期1例,Ⅳ期69例;肺癌22例,消 化道恶性肿瘤29例,乳腺癌6例,胰腺癌4例,鼻 咽癌1例,肝癌1例,子宫内膜癌2例,胆囊癌1例,前列腺癌1例,舌癌1例,卵巢癌2例,恶性黒 色素瘤2例。所有研究对象在检测前两周内未应用 化疗药物及影响凝血功能及血小板功能的药物,无其他高凝状态疾病。 1.2 检测方法
采用静脉抗凝血,0.11 mol/L的柠檬酸钠9:1抗 凝,血液标本以1 500~2 500 r/min离心,15 min,分离血浆及测定。检测过程及结果严格按照说 明书进行。D-二聚体测定试剂盒购自Siemens Healthcare Diagnostics Products GmbH 公司的 INNOVANCE * D-Dimer。 1.3 统计学方法
结果均采用SPSS17.0统计软件处理,采用配对 t检验,成组t检验。P<0.05为差异有统计学意义。 2 结果 2.1 72例恶性肿瘤患者死亡前不同时期血浆D-二聚体均值变化情况
恶性肿瘤患者血浆D-二聚体浓度随病情进展 有升高趋势,见图1。
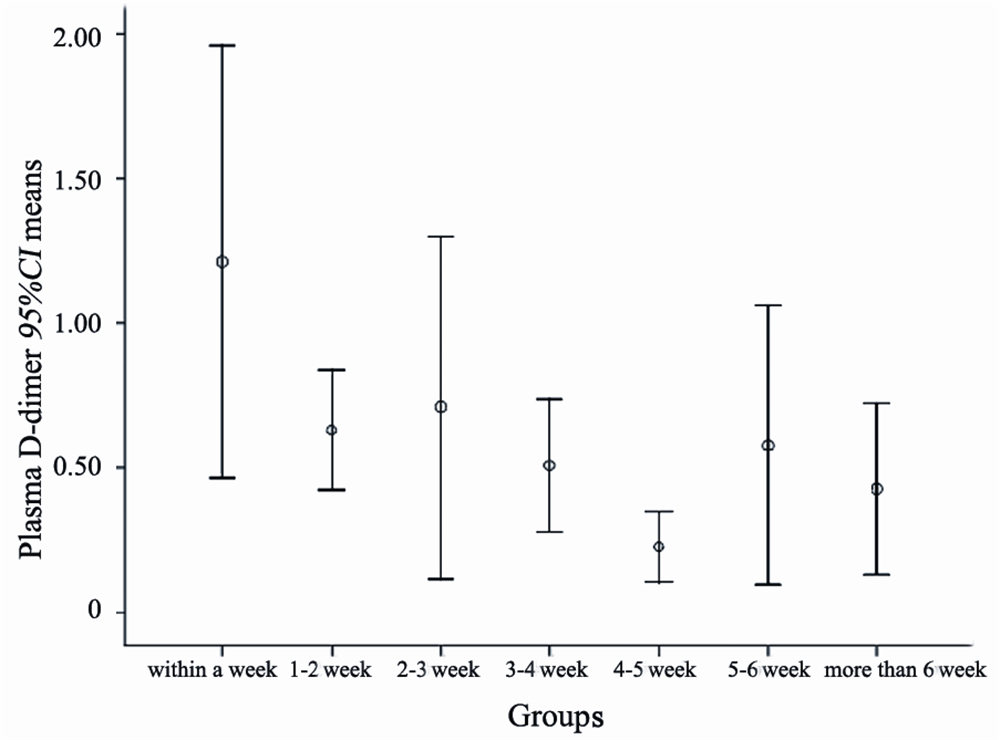 | 图1恶性肿瘤患者死亡前血浆D-二聚体均值动态变化情况Figure 1The continuous change of plasma D-dimer in dying patients with malignant tumorsEPCs: endothelial progenitor cells; *: P<0.05 vs.0 g/ml group |
共入选的72例恶性肿瘤患者血浆D-二聚体动 态检测,结果表明患者临终前0~4周检测值(0.92 ±1.62)μg/ml明显高于4~8周(0.46±0.62)μg/ml检 测值,差异具有统计学意义(P=0.002)。 2.3 不同恶性肿瘤患者动态血浆D-二聚体检测结果
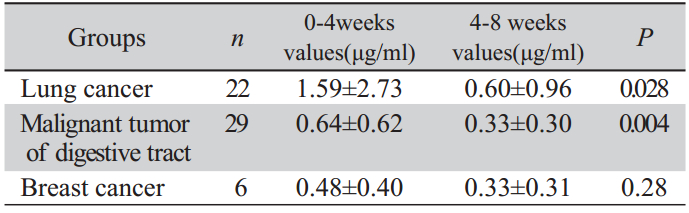
分别比较肺癌组、消化道恶性肿瘤组以及乳 腺癌患者组血浆D-二聚体动态变化情况,其中 消化道恶性肿瘤组血浆D-二聚体升高最为明显 (P=0.004),其次为肺癌组(P=0.028),乳腺癌组 两次检测差异无统计学意义(P>0.05),见表1 。
| 表1 不同恶性肿瘤患者动态血浆D-二聚体检测结果 (x±s,n=57) Table 1 Continuous detection results of the plasma D-dimer values in different malignant tumor patients(x±s,n=57) |
入选的72例恶性肿瘤患者中男41例,女31例,男性和女性D-二聚体变化值(临终前0~4周检测值- 临终前4~8周检测值)均值分别为(0.42±0.90)μg/ml和 (0.50±1.48)μg/ml,变化值的均值均为正值,表明男性 和女性D-二聚体均有升高趋势,但是血浆D-二聚体 的变化值在不同性别之间差异不明显(P=0.77)。 2.5 不同年龄组之间血浆D-二聚体变化水平比较
入选的72例恶性肿瘤患者中≥60岁者38例,<60岁者34例,两个年龄组D-二聚体变化值(临终 前0~4周检测值-临终前4~8周检测值)均值分别 为(0.39±0.91)μg/ml和(0.53±1.43)μg/ml,变化 值的均值均为正值,表明上述两个年龄组D-二聚 体均有升高趋势,血浆D-二聚体的变化值在不同 年龄组之间差异无统计学意义(P=0.61)。 3 讨论
凝血状态的恶化是恶性肿瘤引起的机体重要 的生理改变之一,恶性肿瘤和血栓形成之间的密 切关系已经在临床上得到证实[5],包括我们研究团 队共同参与的SAVE-ONCO临床试验进一步证实肿 瘤患者高凝状态与预后密切相关[1]。血浆D-二聚 体是交联纤维蛋白的特异性降解产物,它的生成 和增高反映了凝血和纤溶系统的激活。Bouillaud [6] 在1983年等首次报道恶性肿瘤并发深静脉血栓,随后有研究[2, 3]表明血浆D-二聚体水平的升高与 肿瘤的进展、转移和不良的预后相关。Altiay等[7] 将78例肺癌患者按照血浆D-二聚体水平高低分为 两组,结果显示,血浆D-二聚体水平高的肺癌患 者累计生存率较低,血浆D-二聚体是判断肺癌患 者预后的独立危险因素。因此,密切关注恶性肿 瘤患者血浆D-二聚体变化情况,以及尽早发现血 栓、栓塞对改善晚期恶性肿瘤患者的生存情况和 判断预后具有重要意义。
大量研究表明,晚期恶性肿瘤患者大多伴有 凝血和纤溶系统的激活,血浆D-二聚体水平明显 高于正常值[8, 9, 10]。Kim等[11]研究表明,在恶性肿瘤 发展过程中纤维蛋白的形成与溶解呈动态变化,D-二聚体作为分子标志物其浓度变化与病情变化 呈正相关。Cihan等[2]研究表明血浆D-二聚体水平 升高是肿瘤富有侵袭性的表现,与患者的临床预后较差有关。本研究中72例恶性肿瘤临终患者死 亡前不同时间的D-二聚体均值变化图也显示D-二 聚体浓度逐渐升高与病情进展相关,其中临终前 5~6周D-二聚体测量值偏高的原因可能与选取数据 的随机性有关。但目前很多研究的局限性在于仅 对不同恶性肿瘤患者血浆D-二聚体进行单次测定 分析血浆D-二聚体水平高低与预后之间的关系。 通过对恶性肿瘤临终患者自身血浆D-二聚体水平 变化连续动态检测,能够为分析患者血浆D-二聚 体水平与病情变化之间的关系提供更加直接的证 据。本研究首次对72例恶性肿瘤临终前患者0~4周 自身血浆D-二聚体检测值与其4~8周检测值进行比 较分析,结果显示,恶性肿瘤终末期患者血浆D-二聚体浓度随病情进展有升高趋势,恶性肿瘤患 者临终前0~4周D-二聚体检测水平显著高于4~8周 检测水平(P=0.002),说明恶性肿瘤病情的进展 与凝血和纤溶系统的激活有关,D-二聚体作为交 联纤维蛋白特异性降解产物,是体内高凝状态和 纤溶亢进特异分子标志物,其水平升高表明继发 性纤溶活性增强,机体处于高凝状态,血浆D-二 聚体含量升高与恶性肿瘤终末期患者预后不良相 关。此外,对不同恶性肿瘤患者进行亚组分析,消化道恶性肿瘤终末期患者血清D-二聚体水平升 高最为明显(P=0.004);其次为肺癌终末期患者 (P=0.028);乳腺癌终末期患者血清D-二聚体升高 不明显(P=0.28),但0~4周D-二聚体检测值均值 高于4~8周检测值均值,可能是由于纳入的样本量 较少(6例),导致统计学差异不明显。本研究分 析了不同性别之间D-二聚体前后两次检测值的变化 值情况,发现D-二聚体的变化值与性别的关系并不 显著(P>0.05)。血浆D-二聚体含量会随着年龄 的升高而增加[12]。Ay等[2]研究表明血清D-二聚体升 高的恶性肿瘤患者死亡率的升高与年龄无关[2]。本 研究也没有发现≥60岁年龄组与<60岁年龄组之间 前后两次D-二聚体检测值的变化值有明显差别(P >0.05)。因此,本研究显示恶性肿瘤终末期患者临 终前血浆D-二聚体浓度显著升高,可以作为终末期 恶性肿瘤患者预后判断的指标;血浆D-二聚体升高 的患者预后较差与性别和年龄无关。
肿瘤细胞具有很强的促凝活性,可以诱导凝血 系统的激活和纤维蛋白沉积,在肿瘤基质形成和肿 瘤组织血管形成方面具有重要作用[13, 14],血浆D凝 血系统的激活主要是由于组织因子表达增加,组织 因子是瀑布式凝血过程的重要触发因子,可以导致 纤维蛋白大量沉积。肿瘤细胞可以通过上调组织因 子的表达来促进一系列的病理过程,比如:深静脉 血栓、侵袭性增加、促进肿瘤生长和血管生成[2]。肿 瘤细胞还可以通过分泌各种促炎细胞因子和促血管 生成因子,如肿瘤坏死因子TNF-α、IL-1β、VEGF 等影响抗凝血系统的功能[15]。 此外,纤维蛋白、 血小板和肿瘤细胞相互作用形成“血小板—肿瘤细 胞—纤维蛋白”复合物,促进肿瘤细胞对血管内皮 的黏附,促进肿瘤细胞生长和转移[16],纤维蛋白的 降解产物同样具有强烈的促血管生成活性[17]。上述 因素综合作用,会导致肿瘤患者出现血小板聚集呈 恶性循环,使血栓形成的机会明显提高,促进肿瘤 的生长和转移,加速患者死亡。D-二聚体是检测凝 血障碍、提示肿瘤恶化的敏感指标,其水平持续升 高与疾病进展和不良预后显著相关。
综上所述,通过对恶性肿瘤死亡患者血浆D-二聚体的动态观察,有助于直接观察病情变化,D-二聚体与病情的严重程度及预后相关,可以作 为终末期恶性肿瘤预后判断的一项参考指标。
| [1] | Agnelli G, George DJ, Kakkar AK, et al. Semuloparin for thromboprophylaxis in patients receiving chemotherapy for cancer [J].N Engl J Med,2012,366(7):601-9. |
| [2] | Ay C, Dunkler D, Pirker R, et al. High D-dimer levels are associated with poor prognosis in cancer patients[J].Haematologica,2012,97 (8):1158-64. |
| [3] | Komurcuoglu B,Ulusoy S,Gayaf M,et al. Prognostic value of plasma D-dimer levels in lung carcinoma[J]. Tumori,2011,97(6):743-8. |
| [4] | Kilic M, Yoldas O, Keskek M, et al. Prognostic value of plasma D-dimer levels in patients with colorectal cancer[J]. Colorectal Dis,2008,10(3):238-41. |
| [5] | Lyman GH, Khorana AA. Cancer, clots and consensus: new understanding of an old problem [J]. J Clin Oncol,2009,27(29):4821-6. |
| [6] | Caine GJ, Stonelake PS, Lip GY, et al. The hypercoagulable state of malignancy: pathogenesis and current debate[J]. Neoplasia, 2002,4(6):465-73. |
| [7] | Altiay G,Ciftci A,Demir M,et al. High plasma D-dimmer level is associated with decreased survival in patients with lung cancer[J]. Clin Oncol (R Coll Radiol),2007,19(7):494-8. |
| [8] | Beer JH, Haeberli A, Vogt A, et al. Coagulation markers predict survival in cancer patients[J]. Thromb Haemost,2002,88(5):745-9. |
| [9] | Shorr AF, Thomas SJ, Alkins SA, et al. D-dimer correlates with proinflammatory cytokine levels and outcomes in critically ill patients[J]. Chest,2002,121(4):1262-8. |
| [10] | Shoji M, Hancock WW, Abe K, et al. Activation of coagulation and angiogenesis in cancer[J]. Am J Pathol,1998,152(2):399-411. |
| [11] | Kim HK,Lee KR,Yang JH,et al. Plasma levels of Dimer and soluble fibrin polymer in patients with hepatocellular carcinoma:a possible predictor of tumor thrombisis [J]. Thromb Res,2003,109(2-3):125-9. |
| [12] | Schutgens RE, Haas FJ, Biesma DH. Reduced efficacy of clinical probability score and D-dimer assay in elderly subjects suspected of having deep vein thrombosis[J]. Br J Haematol,2005,129(5): 653-7. |
| [13] | Palumbo JS, Kombrinck KW, Drew AF, et al. Fibrinogen is an important determinant of the metastatic potential of circulating tumor cells[J]. Blood,2000,96(10):3302-9. |
| [14] | Malik G, Knowles LM, Dhir R, et al. Plasma fibronectin promotes lung metastasis by contributions to fibrin clots and tumor cell invasion[J].Cancer Res,2010,70(11):4327-34. |
| [15] | Kasthuri RS, Taubman MB, Mackman N. Role of tissue factor in cancer[J]. J Clin Oncol,2009,27(29):4834-8. |
| [16] | Jain S, Harris J, Ware J. Platelets: linking hemostasis and cancer[J]. Arterioscler Thromb Vasc Biol,2010,30(12):2362-7. |
| [17] | Thompson WD, Smith EB, Stirk CM, et al. Angiogenic activity of fibrin degradation products is located in fibrin fragment[J]. J Pathol,1992,168(1):47-53. |
 2014, Vol.41
2014, Vol.41