2. 广东省佛山市第一人民医院;
3.唐山市卫生监 督所;
4.河北联合大学公共卫生学院;
5. 澳大利亚昆士兰 州格里菲斯大学黄金海岸医学科学与健康研究所
2. Foshan First People's Hospital;
3.Health Supervision Institute, Tangshan, Hebei Province;
4. School of Public Health, Hebei United University;
5. School of Medical Science and Griffi th Health Institute, Griffi th University, Gold Coast Campus, QLD 4222, Australia
手术、放疗和化疗是目前治疗恶性肿瘤的主要 方法[1]。化疗药物在杀死肿瘤细胞的同时还杀死正 常细胞,引起明显不良反应。如何增强化疗药物的 抗肿瘤效果,同时减低其不良反应,是肿瘤化疗的 研究方向之一[2]。肿瘤生物治疗,特别是肿瘤的免疫治疗,是目前肿瘤治疗的研究热点。肿瘤免疫治 疗调动机体的天然或特异性免疫反应,免疫效应细 胞或因子只杀死肿瘤细胞,而不伤害正常细胞[3]。 化疗结合免疫治疗,比单独使用化疗和免疫治疗, 能明显提高肿瘤的治疗疗效,是肿瘤治疗的一个发展 方向[4]。
氧化石墨纳米颗粒是由单个碳原子组成的薄 膜,其表面带负电荷且与pH值相关,大小通常小于 20 nm,较其他纳米颗粒有巨大的表面积。静脉注 射250 μg的氧化石墨纳米颗粒到小鼠体内,无明显 不良反应,表明其安全性较高。而且静脉注射的氧 化石墨纳米颗粒聚集在小鼠肿瘤周围。氧化石墨纳米颗粒曾被用于吸附5-氟尿嘧啶、Doxorubicin等化 疗药物,还用于吸附DNA,但使用氧化石墨纳米颗 粒吸附多肽和蛋白质的报道不多见[5]。使用氧化石 墨纳米颗粒吸附5-氟尿嘧啶、 抗体和细胞因子治疗 恶性肿瘤,有可能比游离的5-氟尿嘧啶,抗体和细胞 因子产生较好的治疗效果。使用氧化石墨纳米颗粒 吸附化学物质如抗肿瘤药物、细胞因子、抗体的研 究主要为体外实验和动物实验,尚未见用于临床治 疗的报告。
我们使用氧化石墨纳米颗粒,分别吸附5-氟尿 嘧啶、干扰素γ和抗白介素10受体抗体,并在体外验 证氧化石墨纳米颗粒吸附的5-氟尿嘧啶、干扰素γ和 抗白介素10受体抗体的生物学活性。 1 材料和方法 1.1 氧化石墨纳米颗粒吸附5-氟尿嘧啶、干扰素和 抗白介素10受体抗体
氧化石墨纳米颗粒 (graphene oxide,GO)由澳 大利亚卧龙岗大学Kosta Constantinov 博士提供。 200 μl GO(3 mg/ml)与150 μl抗白介素10受体抗体 (6 mg/ml)和(或)10 μg干扰素充分混合后,放 置于4℃过夜。混合物12 h后用大量磷酸盐缓冲液 (PBS)洗涤。1 000 r/min离心5 min后,200 μl PBS 重悬,-80ºC冰箱储存。吸附于氧化石墨纳米颗粒上 的干扰素(GO/IFNγ)和抗白介素10受体抗体(GO/anti- IL10R)浓度分别用总蛋白定量,ELISA和Western blot电泳测定[6]。
2 ml GO(3 mg/ml)与3 mg 5-Fu (Sigma,F6627) 充分混合后,放置于4℃过夜。混合物12 h后用大量 磷酸盐缓冲液(PBS)洗涤。1 000 r/min离心5 min 后,200 μl PBS重悬,储存于-80ºC冰箱备用。吸附 于氧化石墨纳米颗粒中的5-Fu(GO/5-Fu)浓度使用 UV-VIS方法测定,浓度为0.03 mg/ml。 1.2 小鼠和细胞系
6~8周雌性C57BL/6小鼠购于澳大利亚动物研 究中心。所有的动物实验均经卧龙岗大学动物伦理 委员会批准。小鼠黑色素瘤B16细胞系、小鼠乳腺 癌4T1细胞系培养于含10%小牛血清DMEM培养液 中,5% CO2培养箱中培养。 1.3 抗体、细胞因子和其他试剂
抗白介素10受体抗体(货号BE0050)购于美国 BioXcell公司。Anti-MHCⅡ-FITC(11-5321-81), anti-CD11c-APC(17-0114-81),Anti-CD86-PE (12-0861-81) IFNγ(14-8311-63)购于美国 Ebioscience公司。Anti-CD11c 磁珠 (130-052-001) 购 于德国MiltenyiBiotec公司。脂多糖(LPS、L3012)购 于美国Sigma公司。PI (00-6990-50)、 IL12p40 ELISA (88-7120-86)购于Ebioscience公司。 1.4 阳性分选小鼠脾脏CD11c+细胞
阳性分选小鼠脾脏CD11c+细胞参照文献[7],流 式细胞检测CD11c+细胞的纯度为80%。 1.5 5-Fu体外肿瘤细胞杀死实验
5×105小鼠黑色素瘤B16细胞培养于含1 ml DMEM 培养液的24孔培养板 (Nunc公司) 中,24 h 后,加入不同剂量的5-Fu、GO/5-Fu。2、24、48 h 后,用含0.25%胰蛋白酶和0.02% EDTA消化液消化 细胞,PI染色、 LSR Ⅱ流式细胞仪分析。 1.6 体外刺激小鼠脾脏CD11c+细胞
2×105 CD11c+MHC Ⅱ+脾脏树突状细胞培养于 含10%小牛血清的RPMI1640培养液中,分别用100 ng LPS,10 μg/ml 抗白介素10受体抗体和不同浓度 的干扰素γ刺激过夜。隔日收集上清液,用于检测 IL12p40。 1.7 ELISA检测细胞培养上清中IL12p40
ELISA检测细胞培养上清的IL12p40参照文献[8]。 1.8 统计学方法
Two way student t test 用统计学分析软件Prism 5 分析,P<0.05为差异有统计学意义。 2 结果 2.1 GO不抑制B16 肿瘤生长、不引起小鼠CD11c+MHCⅡ+细胞分泌白介素12
GO是由单个碳原子组成的薄膜,吸附抗白介素 10受体抗体后不规则集聚,见图1A 。
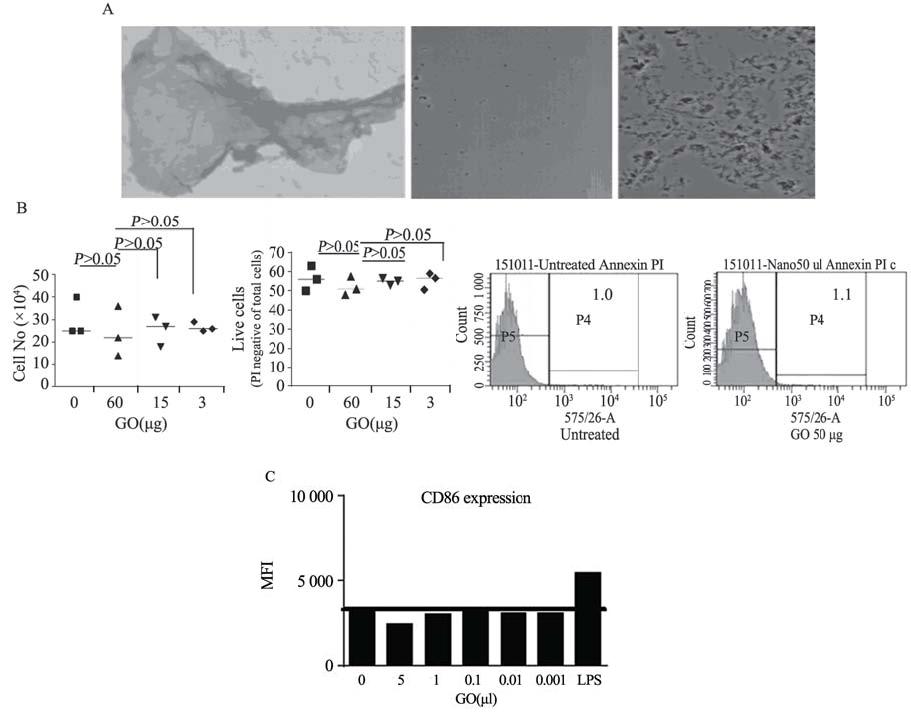 | 图 1 GO对B16肿瘤生长、树突细胞表达CD86的影响Figure 1Effects of GO on inhibition of B16 tumor growth and CD86 expression in dendritic cellsA: Left, Middle: GO,Electronic microscope (×50 000), Optical microscope (×400); Right: GO/anti-IL10R, Optical microscope (×400);B: Graphene oxide does not inhibit tumour growth. Left: Number of B16 tumor cells Middle: No of live cells; Right: FACS profile;C:CD86 expression by CD11c+ dendritic cells after GO stimulation |
将1×105 小鼠黑色素瘤B16细胞培养于含1 ml DMEM 培养液的24孔培养板中。培养24 h,加入不 同剂量的GO。继续培养24 h后,用0.25% 胰蛋酶和 0.02% EDTA消化,计数后用PI染色,流式细胞仪检 测死亡和活细胞。结果表明,GO本身不造成小鼠 B16细胞死亡,即使剂量达到60 μg/ml,其细胞数量 和活细胞数与不加GO时相似,差异无统计学意义(P >0.05),见图1B。2×105小鼠CD11c+细胞培养在含1 ml DMEM 培养液的24孔培养板中,将不同剂量的 GO加入培养的细胞中,24 h后检测细胞表面CD86 的表达,见图1C。结果表明GO不刺激小鼠CD11c+ 细胞表达CD86,即使其浓度达到15 μg/ml。 2.2 GO/5-Fu抑制肿瘤细胞生长的能力
5×105小鼠黑色素瘤B16细胞培养于含1 ml DMEM培养液的24孔培养板中。24 h后,加入 GO/5- Fu 5 μl,准备GO/5-Fu时加入PBS洗涤后的上清液 5 μl或5-Fu 3 μl (35 μg/μl) 。继续培养2、24、48 h后,用0.25% 胰蛋酶和0.02%EDTA消化细胞,计 数后PI染色,经流式细胞仪检测死亡和活细胞。 加入药物2 h后,各组细胞数量一致,差异无统计 学意义。24 h后,5-Fu和GO/5-Fu组的细胞数量明 显减少,且PI阳性细胞也明显增高 (P<0.05);48 h 后,上述现象更加明显。上述结果表明,GO/5-Fu 有细胞毒性作用,上清在体外无杀死肿瘤细胞的 能力,5-Fu的确已经吸附在GO中,见图 2。我们进 一步检测了GO/5-Fu杀死B16肿瘤细胞的效果。结 果表明,GO/5-Fu杀死B16肿瘤细胞的能力与其剂 量呈正相关,见图 3。
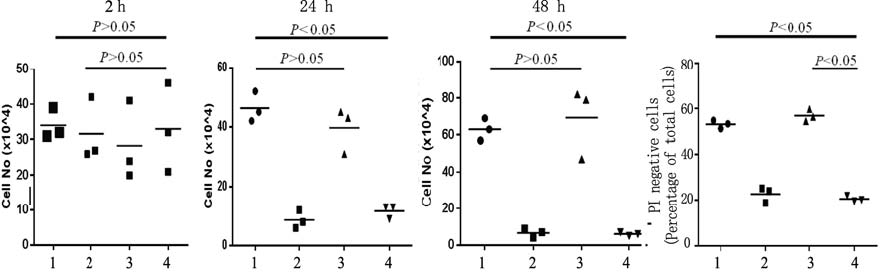 | 图 2 GO/5-Fu 可以抑制B16肿瘤细胞生长Figure 2GO absorbed 5-Fu inhibits B16 tumor growth in vitro1: Untreated; 2: 5-Fu; 3: Supernatant; 4: GO/5-Fu; Upper panel: Number of B16 cells 2, 24, 48 h after 5-Fu, GO/5-Fu or supernatant from GO/5-Fu stimulation;Lower panel: Number of live B16 tumour cells 24 h after 5-Fu, GO/F-Fu or supernatant from GO/5-Fu stimulation |
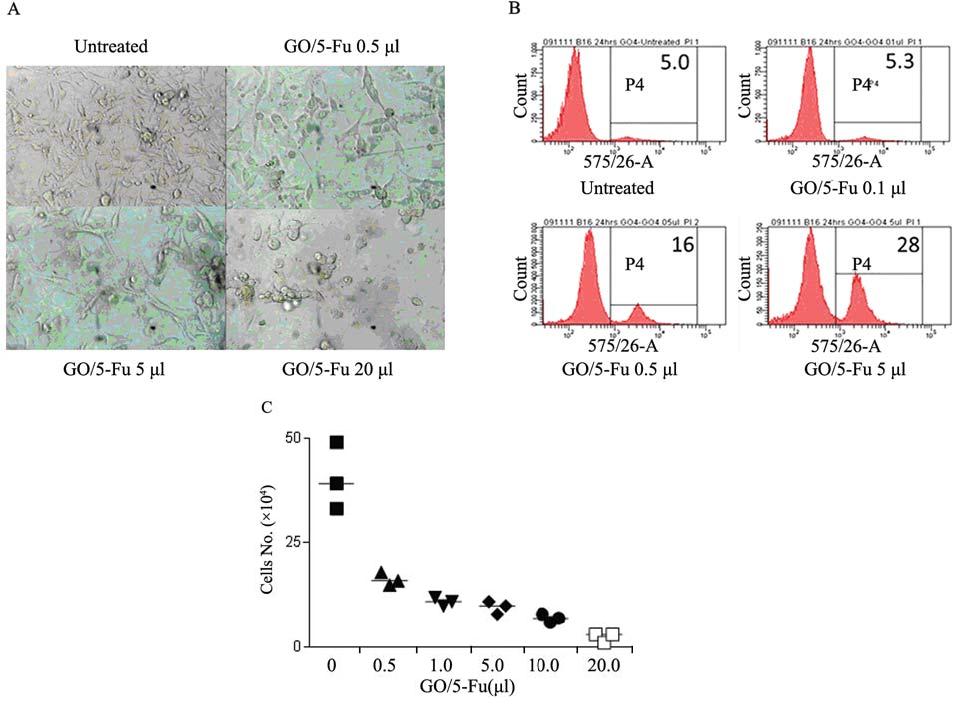 | 图 3 GO/5-Fu抑制B16肿瘤细胞生长与GO/5-Fu的剂量呈正相关Figure 3The effects of Melittin on proliferation of EPCs by MTT assayInhibition of B16 tumor growth by GO absorbed 5-Fu is correlated with GO/5-Fu dosage |
使用对5-Fu更为敏感的小鼠乳腺癌4T1细胞。 5×105小鼠4T1细胞培养在含1 ml DMEM 培养液 的24孔培养板中。24 h后,加入含同等量的5-Fu的 GO/5-Fu (0.1 μl) 和5-Fu (0.003 μg)。24 h后,用 0.25%胰蛋酶和0.02% EDTA消化细胞后计数并经PI 染色后用流式细胞仪检测。结果表明,GO/5-Fu组 比5-Fu组的活细胞显著减少(P<0.05),含同样数量 5-Fu的GO/5-Fu杀死4T1细胞的能力远比5-Fu高, 见图 4。
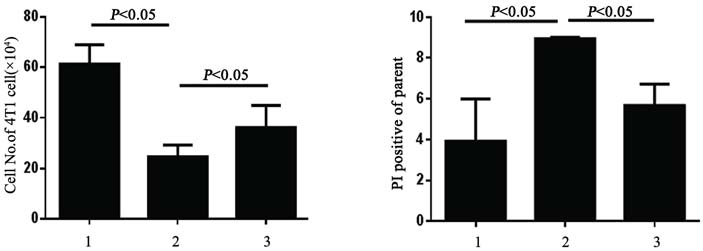 | 图 4GO/5-Fu与5-Fu杀死肿瘤细胞效率比较Figure 4GO absorbed 5-Fu kills tumor cells more effi ciently than free 5-Fu1: Untreated; 2: GO/5-Fu; 3: 5-Fu; 24 hours after GO/5-Fu or free 5-Fu stimulation; Left: Number of 4T1 cells; Right: Number of live 4T1 cells |
将干扰素γ和抗白介素10受体抗体分别吸附到 比氧化石墨纳米颗粒上并通过Western blot、ELISA 等方法确定其浓度[13]。分离小鼠CD11c+树突状细 胞,将2×105CD11c脾脏树突状细胞培养在含10% 小牛血清的RPMI培养液中,分别用100 ng LPS 和 GO、干扰素γ、抗白介素10受体抗体刺激过夜。第 二天收集上清用于检测IL12。结果表明,与对照 组GO/LPS相比,GO/干扰素γ,GO/抗白介素10 诱 导LPS刺激的小鼠CD11c+MHCⅡ+细胞分泌IL12 (P<0.05),而且GO、干扰素γ、抗白介素10刺激LPS 刺激的CD11c+细胞分泌IL12有叠加作用,见图 5。
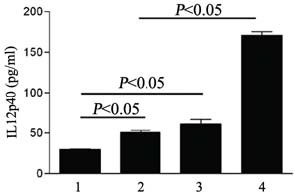 | 图 5GO吸附的IFNγ和Anti-10R抗体促使LPS刺激的 CD11c+细胞分泌IL12Figure 5GO absorbed IFNγ and Anti-10R antibodies promote IL12 secretion by LPS stimulated dendritic cells1:LPS/GO; 2: LPS/GO aIL10R; 3: LPS/GOIFNg; 4: LPS GO/aIL 10R IFNg; CD11c+ dendritic cells were stimulated with GO absorbed LPS, GO/LPS aIL10R, GO/LPS/IFNγ or GO/LPS/aIL10R/IFNγ overnight,IL12p40 from supernatants were measured by ELISA |
我们使用氧化石墨纳米颗粒吸附5-氟尿嘧啶、 抗白介素10受体抗体和IFNγ,体外证明石墨纳米颗 粒吸附的5-氟尿嘧啶、抗白介素10受体抗体和IFNγ 有生物学活性。GO/5-Fu可以杀死B16,4T1肿瘤细 胞,而且杀死肿瘤细胞的效果比5-Fu本身更好。 GO/抗白介素10受体抗体,GO/IFNγ可以分别使LPS 刺激的小鼠树突状细胞分泌更多的白介素12,且GO/ IFNγ/抗白介素10受体抗体对促进LPS刺激的小鼠树突 状细胞分泌更多的白介素12有叠加作用。
肿瘤局部给药是提高恶性肿瘤治疗效果、减少治 疗药物,尤其是化疗药物不良反应的有效方法之一。 氧化石墨纳米颗粒静脉注射入小鼠体内后,聚集在肿瘤细胞周围[9],我们的资料还发现,吸附于氧化石墨纳 米颗粒的抗白介素10受体抗体,在pH值为6~7.4的环 境下,仍能缓慢地从氧化石墨纳米颗粒中释放[6],提 示静脉或肿瘤组织周围注射GO吸附的抗癌药物或免疫 刺激因子,可以较长时间使药物停留在肿瘤组织周围 并维持在较高浓度,而在体内其他部位的浓度将远比 肿瘤组织中低。
肿瘤细胞在与机体的免疫系统不断斗争过程中, 形成了有助于肿瘤细胞生长的免疫微环境,使机体的 免疫系统不能够将肿瘤细胞清除[10]。在小鼠肿瘤体内 注射Toll样受体配体CpG和抗白介素10受体抗体可以解 除肿瘤微环境的免疫抑制作用,促进小鼠肿瘤细胞的 清除[11]。干扰素是杀死肿瘤细胞的重要细胞因子之一 [12]。我们用氧化石墨纳米颗粒吸附抗白介素10受体抗 体,发现该抗体在pH值为6~7.4情况下,缓慢从纳米颗 粒中释放,如果局部注射到肿瘤体内,抗白介素10受 体抗体在肿瘤组织的浓度将会保持在有效治疗浓度。
氧化石墨纳米颗粒吸附的5-Fu和抗白介素10受体 抗体较5-Fu、抗白介素10受体抗体本身的活性好,可 能是由于氧化石墨纳米颗粒吸附的5-Fu更容易被转运 到肿瘤细胞内。用氧化石墨纳米颗粒吸附的抗白介素 10受体抗体和LPS卵蛋白或等量的抗白介素10受体抗 体和LPS卵蛋白免疫小鼠。氧化石墨纳米颗粒吸附的 抗白介素10受体抗体诱导小鼠产生对卵蛋白的细胞毒 性T细胞的反应,比没有被氧化石墨纳米颗粒吸附的 抗白介素10受体抗体诱导小鼠产生对卵蛋白的细胞毒 性T细胞的反应明显提高[6]。氧化石墨纳米颗粒吸附的 抗白介素10抗体很可能较抗白介素10受体抗体本身, 更容易接近抗议提呈细胞,故而提高了抗体效果。
肿瘤药物化疗并结合免疫治疗是近年来肿瘤治 疗的研发方向。过去以为化疗和免疫治疗两者相互拮 抗。认为化疗药物引起细胞凋亡且不伴有炎性反应, 导致免疫耐受。其次,淋巴细胞减少也是许多化疗药物的常见不良反应之一。但近来研究提示化疗和免疫 治疗结合使用有更好的抗癌效果[1]。例如,胶质母细胞 瘤患者化疗结合树突状细胞免疫治疗后2年生存率比单 独化疗或免疫治疗高[13]。化疗可以更多的暴露肿瘤抗 原,通过抗原提呈细胞将肿瘤抗原提呈给T细胞。而且 化疗后的肿瘤组织更有利于效应T细胞的肿瘤杀伤作 用。化疗后使用激活抗原提呈细胞的免疫治疗,可以更 好地清除小鼠肿瘤。研究发现,在致癌剂诱导小鼠乳腺 癌和纤维母细胞瘤模型中,Doxorubicin 治疗可以提高 肿瘤特异性CD8T 细胞的增殖,促进肿瘤特异性CD8细 胞在肿瘤组织中的浸润[14]。GO吸附化疗药物和细胞因 子后,可以更好提高化疗结合免疫治疗的效率。
综上所述,我们用氧化石墨纳米颗粒吸附了化 疗药物5-Fu和免疫刺激因子,发现他们体外有生物活 性。如果局部用于肿瘤组织,有可能有较好的肿瘤治 疗作用。
| [1] | Hodge JW, Ardiani A, Farsaci B, et al. The tipping point for combination therapy: cancer vaccines with radiation, chemotherapy, or targeted small molecule inhibitors [J]. Semin Oncol, 2012, 39(3):323-39. |
| [2] | Kaufmann SH, Earnshaw WC. Induction of apoptosis by cancer chemotherapy[J]. Exp Cell Res,2000, 256(1): 42-9. |
| [3] | Klebanoff CA, Acquavella N, Yu Z, et al. Therapeutic cancer vaccines: are we there yet? [J]. Immunol Rev, 2011, 239(1):27-44. |
| [4] | Ramakrishnan R, Antonia S, Gabrilovich DI. Combined modality immunotherapy and chemotherapy: a new perspective[J]. Cancer Immunol Immunother, 2008, 57(10):1523-9. |
| [5] | Zhu Y, Murali S, Cai W, et al. Graphene and graphene oxide: synthesis, properties, and applications[J]. Adv Mater, 2010, 22(35):3906-24. |
| [6] | Ni G, Wang Y, Wu X, et al. Graphene oxide absorbed anti-IL10R antibodies enhance LPS induced immune responses in vitro and in vivo[J]. Immunol Lett, 2012,148(2):126-32. |
| [7] | Liu XS, Xu Y, Hardy L, et al. IL-10 mediates suppression of the CD8 T cell IFN-gamma response to a novel viral epitope in a primed host[J]. J Immunol, 2003,171(9):4765-72. |
| [8] | Liu XS, Leerberg J, MacDonald K, et al. IFN-gamma promotes generation of IL-10 secreting CD4+ T cells that suppress generation of CD8 responses in an antigen-experienced host[J]. J Immunol, 2009, 183(1):51-8. |
| [9] | Yang KS, Zhang S, Zhang G, et al. Graphene in mice: ultrahigh in vivo tumor uptake and effi cient photothermal therapy [J]. Nano Lett, 2009, 10(9):3318-23. |
| [10] | Kerkar SP, Restifo NP. Cellular constituents of immune escape within the tumor microenvironment [J]. Cancer Res,2012,72(13):3125-30. |
| [11] | Vicari AP, Chiodoni C, Vaure C, et al. Reversal of tumor-induced dendritic cell paralysis by CpG immunostimulatory oligonucleotide and anti-interleukin 10 receptor antibody[J]. J Exp Med, 2002,196(4):541-9. |
| [12] | Chen J, Liu XS. Development and function of IL-10 IFN-gammasecreting CD4(+) T cells[J]. J Leukoc Biol, 86(6):1305-10. |
| [13] | Zhang T, Herlyn D. Combination of active specifi c immunotherapy or adoptive antibody or lymphocyte immunotherapy with chemotherapy in the treatment of cancer[J]. Cancer Immunol Immunother,2009,58(4): 475-92. |
| [14] | Mattarollo SR, Loi S, Duret H, et al. Pivotal role of innate and adaptive immunity in anthracycline chemotherapy of established tumors[J]. Cancer Res, 2011, 71(14):4809-20. |
 2014, Vol.41
2014, Vol.41


