2.新乡医学院第一附属医院肿瘤科
2.Department of Oncology,The First Affiliated Hospital,Xinxiang Medical University
食管癌是我国常见的恶性肿瘤之一[1],在确 诊时,由于多数为中晚期,大部分已失去手术机 会。而单纯放疗在食管癌治疗中疗效较差,在晚 期患者治疗中尤为明显。热疗是通过加热使肿瘤 组织的温度达到40℃~44℃,引起肿瘤细胞生长阻 滞或死亡的一种治疗方式。除了对肿瘤细胞直接 的细胞毒效应,热疗还可以对放、化疗增敏,抑 制肿瘤的转移,提高机体的免疫力。本文旨在探 讨热疗在食管癌放疗方面的应用及其机制,为制 定合理的食管癌放疗策略,提高食管癌疗效提供 研究基础和理论依据。 1 材料与方法 1.1 材料
人食管癌细胞株EC-1细胞由新乡医学院肿瘤 反转录分子生物学实验室提供。用含100 u/ml青霉 素、100 μg/ml链霉素和10% (V/V)胎牛血清的 RPMI1640培养液,于37℃、5% CO2孵箱中培养。 每24 h更换培养液。每48 h传代一次。
恒温循环水浴器(HX-1050)(北京博医康实 验仪器有限公司);电热恒温水浴箱(HB3V21, Cu600)(上海医疗器械七厂);恒温CO2细胞培养箱 (英国RSBionch公司);倒置显微镜(EE 2000-U) (日本Nikon公司),超净工作台(SW-CJ-1F)(苏 州净化设备有限公司) ,6 MV电子直线加速器(德 国西门子公司),Epic) s-XL II型里流式细胞仪(美 国Beckman Coulter公司BX51/BX5)2系统显微镜 (日本Olympus公司),OLYMPUS直立光照照相 系统(日本Olympus公司)。 1.2 实验方法
采用平板克隆形成实验 实验分组分为4组:空 白对照组(O组);单纯热疗组(H组);单纯放 疗组(R组);热疗+放疗组(HR组)。先热疗随即 予以放疗。热疗是将恒温孵育箱(温度波动±0.1℃) 温度调至43℃稳定一昼夜,次日将细胞培养皿瓶口 密封后放入恒温孵育箱中,加热30 min,热平衡5 min。放疗所有照射均在室温下照射,电子直线加 速器6 MVX线,剂量率为200 cGy/min,照射面积 23×16 cm,源轴距100 cm,培养瓶或培养皿下置1.5 cm组织补偿膜,机架角180°室温下照射。
取对数生长期生长的EC-1细胞,制成单细胞 悬液,计数并按梯度稀释分别接种于60 mm培养皿 中,接种24 h细胞贴壁后,行热疗处理热处理,再 将各组细胞培养皿正置,分别给予0、l、2、4、6、 8、10 Gy剂量照射,,继续放入孵育箱中进行培养 14天。培养14天后取出60 cm培养皿,弃培养液, PBS缓冲液清涤2遍,用甲醇固定,加用Gimsa液染 色20 min,计数显微镜下大于50个细胞的克隆数。 按以下公式计算存活分数(SF) =实验组每孔克隆数 /(每孔细胞种植数×贴壁率)×100%。 1.3 流式细胞仪分析细胞周期及凋亡 1.3.1 流式细胞仪检测细胞周期
取对数生长期的EC-1细胞,细胞浓度调整为l×105 /ml接种在6孔 培养板上,每板3 ml,接种后24 h予以下处理: 空白对照组(O组)、单纯热疗组(H组)、单纯 放疗组(R组)、热疗+放疗组(HR组),热疗予以 43℃加热30 min,热疗后即行放疗,剂量率为200 cGy/min,照射剂量为2 Gy。处理结束后于37℃、 5%CO2的培养箱中再培养48 h,消化离心制成单细 胞悬液,以冷PBS洗涤2次。1 ml PBS打散离心管中 的细胞制成细胞悬液,加入5 μl核糖核酸酶RNASE (10 mg/ml),置37℃水浴中消化1 h以去掉RNA,然 后马上放在冰浴中终止消化。加入50 μl碘化丙啶PI (l mg/ml),30 min避光染﹙4℃﹚,400目筛网滤过 后,样品上流式细胞仪于488 nm处检测细胞DNA 含量,每份标本累计分析104个细胞,应用Exppo 32 ADC进行免疫荧光数据分析,用Multicycle AV分 析软件对DNA细胞周期拟合分析。 1.3.2 流式细胞术检测细胞凋亡
实验分组与处理同1.3.1,收集各组的EC-1细胞,PBS缓冲液洗 涤2次,调整细胞浓度为1×106/ml,加入1 ml PI染 液,Single histogram statistic软件分析细胞凋亡率。 1.4 统计学方法
本研究采用t检验(两样本均数比较)和单因
素方差分析(多样本均数比较),实验数据以均
数±标准差( ±s)表示,统计软件使用的是SPSS
17.0,检验水准为α=0.05。
2 结果
2.1 平板克隆形成实验测定细胞放射敏感度
±s)表示,统计软件使用的是SPSS
17.0,检验水准为α=0.05。
2 结果
2.1 平板克隆形成实验测定细胞放射敏感度
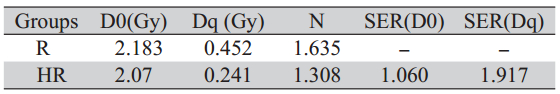
热疗作用于食管癌细胞照射后所形成细胞克 隆状态,见图 1。(以2 Gy照射剂量为例),热疗 联合放疗细胞克隆数明显少于单纯放疗组,使用 克隆形成实验检测热疗联合或不联合放射线对人 食管癌EC-1细胞的作用,计其存活分数,绘制细 胞存活曲线,见图2。通过单击多靶模型相关参 数,见表 1。热疗联合放疗组D0、Dq 、N分别为 2.07、0.241、1.308。放疗增敏比为1.059。HR组 与R组相比,细胞存活曲线肩变窄,斜率增大。表 明热疗对食管癌细胞有放射增敏作用。
 | 图 1 不同处理组食管癌克隆形成情况 Figure 1 Colony forming state of different groups A : radiotherapy group (2 Gy);B:hyperthermia+radiotherapy group(2Gy) |
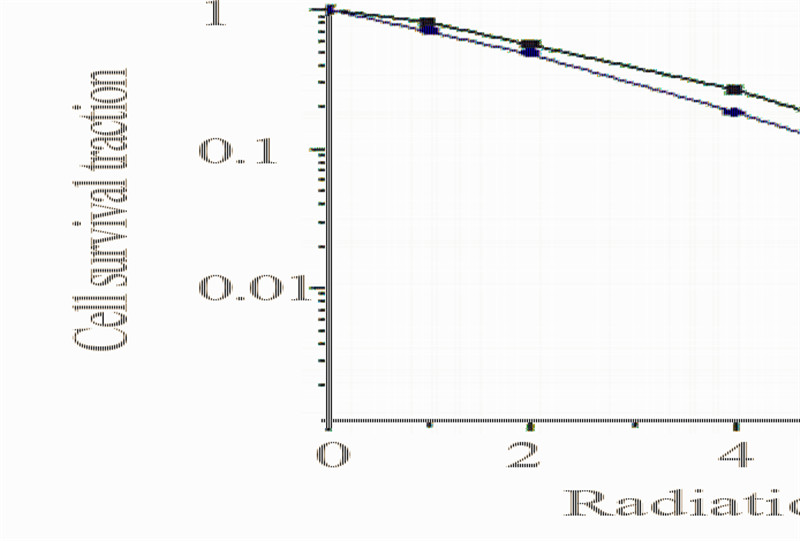 | 图2 食管癌EC-1细胞存活曲线 Figure 2 Survival curves of EC-1 esophageal cancer cell R:radiotherapy;HR:hyperthermia+radiotherapy |
|
|
表 1 EC-1细胞照射后存活曲线的主要参数 Table 1 The main parameter of EC-1 cell SF curve after irradiation |
为研究热疗对人食管癌EC-1细胞放射增敏效 应的可能机制,用流式细胞仪检测各组细胞经不 同处理后的细胞凋亡以及细胞周期分布的改变。
|
|
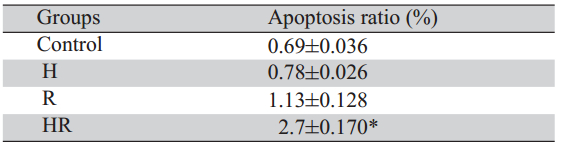
表 2 不同处理组细胞凋亡检测结果(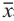 ±s)
Table 2 Test results for apoptosis in different groups ( ±s)
Table 2 Test results for apoptosis in different groups (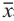 ±s) ±s)
|
经不同处理48小时后各组细胞凋亡变化见表 2,空白对照组凋亡率为0.69%、单纯热疗组凋亡 率为0.78%,差异有统计学意义(P<0.05)。单 纯放疗组凋亡率为1.13%、热疗+放疗组凋亡率为 2.7%,其凋亡率差异有统计学意义(P<0.05)。
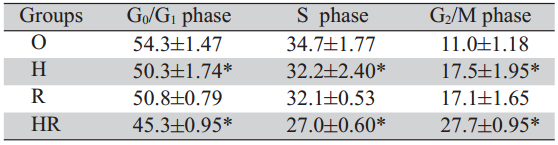
不同处理48小时后各组细胞所占细胞周期比 例变化,见表 3。
|
|
表 3 不同处理组细胞周期结果(%,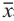 ±s)
Table 3 Test results for cell cycles in different groups(%, ±s)
Table 3 Test results for cell cycles in different groups(%, ±s) ±s)
|
研究证实,热疗不仅对黑色素瘤 [2]等实体瘤化疗 有增敏作用,在脑胶质瘤 [3]、乳 腺 癌 [4]、宫 颈 癌 [5, 6]、肝 癌[7]放疗也有增敏。我国在上世纪80年代热疗开始 在食管癌的应用研究。郭可锋等[8]在研究中晚期食 管癌也发现热放治疗组的近期疗效(95.8%)明显 优于单纯放疗组(70.8%)。临床研究 [9, 10]发现在食 管癌热放治疗组明显优于单纯放疗组。
本实验中,根据单击多靶模型公式进行两组 细胞放射-生存曲线的拟合比较后发现,单纯照射 组经过热疗作用后的细胞D0值、Dq值、N值均减 小,热疗对人食管癌EC-1细胞放疗增敏[SER(D0)为 1.059,SER(Dq)为1.917]。上述结果提示:经热疗作 用后细胞对照射的平均致死剂量较单纯照射组降 低,肩区缩小,细胞亚致死性损伤修复能力减弱。 通过流式细胞术检测细胞周期及凋结果显示:热疗 使细胞阻滞在G2/M期,S期细胞减少,从而使放射 敏感度增加。但幅度不大,最低才降至2.7%。可能 原因是热疗联合放疗后,细胞周期抑制基因p57表 达显著上调,而细胞周期促进基因cyclinB的表达受 到明显下调所致[10]。热疗可以增加放射线诱导的凋 亡,但作用不明显。此外,在做细胞周期分析时发 现,热疗联合放疗后G2/M期细胞比例降之最低, 达27.7%。细胞受到DNA损伤后,p53的激活常会 导致G0/G1期停滞,但食管癌EC-1细胞可能p53基因 突变,G0/G1期不受阻滞,甚至促进该期,从而使 G0/G1期细胞比例降低,细胞凋亡不明显,而缺乏 p53时则多引起G2/M期停滞。
本研究实验显示:热疗对食管癌EC-l细胞均 具有明显增敏作用,其可能放疗增敏机制是通过 影响食管癌EC-l细胞周期,其次通过诱导细胞凋 亡,增强放射线对细胞的杀伤作用。
| [1] | Ding T,Zhang XH,Li XM,et al.Significance of eIF4E expression in carcinogenesis of esophageal epithelium[J].Zhang Liu Fang Zhi Yan Jiu,2009,36(6):504-7.[丁涛,张祥宏,李学民,等.eIF4E在食管鳞状上皮癌变过程中的表达及意义[J].肿瘤防治研究,2009,36(6):504-7.] |
| [2] | Misir Krpan A, Ivankovic S, Krajina Z,et al. Tamoxifen in trimodal therapy with cytotoxic drugs and hyperthermia in vivo significantly enhance therapeutic efficacy against B16-F10 melanoma[J]. Tumori,2012,98(2):257-63. |
| [3] | Jiang H, Wang C, Guo Z, et al.Silver nanocrystals mediated combination therapy of radiation with magnetic hyperthermia on glioma cells[J].J Nanosci Nanotechnol[J].2012,12(11):8276-81. |
| [4] | Varma S, Myerson R, Moros E,et al.Simultaneous radiotherapy and superficial hyperthermia for high-risk breast carcinoma: a randomised comparison of treatment sequelae in heated versus non-heated sectors of the chest wall hyperthermia[J]. Int J Hypert hermia,2012,28(7):583-90. |
| [5] | Yu J, Zhang GN, Fan Y.Curative effect of synchronous radiochemotherapy in medium-term and advanced cervical carcinoma[J].Shi Yong Fu Chan Ke Za Zhi, 2007, 23 (5): 287-9.[余健, 张国楠, 樊英.同步放化疗联合深部热疗治疗中晚期宫颈癌50例临床疗效观察[J]. 实用妇产科杂志, 2007,23(5):287-9. ] |
| [6] | Shi XY, Zhou TC, Lin XD,et al. Evaluate of short-term effect of hyperthermia combined with chemoradiation therapy in advanced cervical cancer[J].Zhongguo Dang Dai Yi Yao,2011,18(35):7-9.[石兴源,周同冲,林晓丹,等.深部热疗联合同步放化疗对中晚期宫颈癌的近期疗效观察[J].中国当代医药,2011,18(35):7-9.] |
| [7] | Zhang L, Gong MY,Li YX, et al. Apoptosis of hepatoma cell line HepG2 induced by the combination of radiotherapy and thermotherapy and its relationship with Bcl-2/Bax protein expressions [J]. Zhongguo Quan Ke Yi Xue, 2011,14(6):627-30.[张力, 龚明玉, 李毅学,等. 放疗联合热疗诱导肝癌HepG2细胞凋亡及其与Bcl-2和Bax蛋白表达关系的研究[J].中国全科医学,2011,14(6):627-30.] |
| [8] | Guo KF,Liu YH, Li ZM. Effect of the Combination of three dimensional conformal radioth- erapy and radio frequency hyperthermia in the treatment of upper esophageal carcinoma[J] Shi Tong Ai Zheng Za Zhi,2011,26(1):76-7.[郭可锋,柳玉华,李宗民. 三维适形放疗联合射频热疗治疗中晚期食管癌的疗效观察[J].实用癌症杂志,2011,26(1):76-7.] |
| [9] | Yang MX, Sheng YX. Comparison of efficacy and toxicity of thermoradiotherapy, Chemor-radiotherapy and radiotherapy alone for patients with esophageal cancer [J]. Zhong Liu, 2011,31(1):74-7.[杨孟祥,盛延兴. 热放疗、放化疗和单纯放疗治疗食管癌的临床对比观察[J]. 肿瘤,2011,31(1): 74-7.] |
| [10] | Li Z, Mi DH, Yang KH, et al. Radiotherapy plus thermotherapy for esophageal carcinoma: a Meta-analysis [J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2012, 19(9): 671-5.[李征,米登海,杨克虎,等. 放疗联合热疗治疗食管癌的Meta分析[J].中华肿瘤防治杂志,2012,19(9):671-5.] |
 2014, Vol.41
2014, Vol.41