2. 华中科技大学同济医学院附属同济医院 肿瘤中心
2.Cancer Center, Tongji Medical College, Huazhong University of Science and Technology
放疗和分子靶向治疗是非小细胞肺癌的重要 治疗手段,但针对EGFR的靶向治疗只有小部分人 受益,且易耐药。有研究显示,吉非替尼与放疗 联用可增加肿瘤细胞凋亡率,主要机制同厄洛替 尼相似,抑制EGFR与DNA-PK的结合[1]。EGFR 单克隆抗体C225与放疗的协同作用比较明确,其 机制是抑制了放疗后活化的EGFR进入核内激活 DNA-PK进行的DSB修复[2]。本实验选取A549细 胞,EGFR为野生型;H1975细胞,EGFR为双重突 变(L858R/T790M)作为研究对象[3],分析吉非替 尼对含有不同状态EGFR的NSCLC细胞是否有放射 增敏效应及其可能的机制。 1 材料与方法 1.1 材料
人NSCLC细胞株A549由同济医院妇产科国 家重点实验室惠赠; NCI-H1975购于中国医学科学 院基础医学研究所基础医学细胞中心。实验药品 吉非替尼由英国阿斯利康公司惠赠,称重研磨溶 于DMSO,终浓度为10 mmol/L,分装后-20℃保 存备用。主要试剂:Anti-phospho-Histone H2A.X (Ser139),clone JBW301 (Millipore公司); Mouse EGFR(14C8):sc-81450(Santa Cruz公 司),Lamin B1 polyclonal anti-body (Biovision公 司)。 1.2 方法 1.2.1 细胞培养
人NSCLC细胞株A549和NCI-H1975 采用含10%灭活胎牛血清RPMI1640培养液,于 37℃、5%CO2、相对湿度90%的细胞培养箱中培 养,隔天换液,细胞每4~5天传代一次。细胞呈贴壁 生长,取对数生长期细胞进行实验。 1.2.2 MTT法检测
吉非替尼作用A549\HA1975细胞的IC50值及细胞增殖抑制率 配制0.5 mg/ml的MTT 溶液,采用0.22 μm的滤膜过滤除菌,4℃避光保 存。接种培养细胞,药物处理组加入吉非替尼的 终浓度分别为0.001、0.01、0.05、0.1、0.5、1.0、 5.0、10、50、100 μmol/ml,每孔重复3次。每孔 加10%DMEM 100 μl,同时每组设一空白对照孔 (仅加PBS,没有接种细胞)置37℃ 5%CO2培养 箱内培养。吉非替尼作用24 h后,每天取培养细胞 一板,每孔加MTT 100 μl,置培养箱内继续培养 4 h。取出培养板吸弃培养液,同时每孔加入150 μl DMSO。置脱色摇床上振摇15 min,使结晶物充 分溶解。在酶标仪上595 nm波长处检测各孔OD值 (吸光度),纪录结果。实验重复3次,取3次实 验结果的平均值作为实验结果。按下列公式计算 肿瘤细胞增殖抑制率:肿瘤细胞增殖抑制率(%) =[1-(药物处理组OD值-空白对照组OD值)/(细胞 对照组OD值-空白对照组OD值)]×100% 1.2.3 细胞照射及实验分组
室温于同济医院肿 瘤中心直线加速器(瑞典ELEKTA-precise)室, 源皮距100 cm,机架角度180°,6 MV-X线照射, 培养皿/24孔板/培养瓶底部垫置1 cm有机玻璃板。 2株细胞A549和H1975均分别分为2组:单纯X线照 射组、X线+吉非替尼组,前者进行单纯 X 线照 射,后者在10 μmol/L 吉非替尼作用 24 h 后再进 行 X 线照射。 1.2.4 克隆形成实验
常规消化细胞,计数,稀释,接种不同细胞数于60 mm直径培养皿中培养。 细胞贴壁后,单纯X线照射组更换新鲜培养液,X 线+吉非替尼组改为含吉非替尼浓度为10 μmol/L的 培养液作用24 h,分别接受0 、1、 2、3、 4、6、 8 Gy单剂量照射,每个剂量点设3个平行样本。照 射后培养10~14 d,PBS漂洗后用甲醇固定20 min, 0.1%结晶紫染色15 min,室温自然干燥。低倍显微 镜下计数≥50个细胞的克隆数。以0 Gy组计算克 隆形成效率(plating efficicy,PE),计算各个剂量 下的细胞存活率(survival fraction,SF),PE=(0 Gy剂量下集落数/细胞接种数)×100%,SF=某一 剂量照射组细胞形成的克隆数/(该组细胞种植数× PE),根据LQ模型SF=exp(-αD-βD2)拟合曲线计算 得到SF2,重复3次。 1.2.5 免疫荧光法
收集对数生长期细胞,调整 细胞悬液浓度为1×105/ml,接种于24孔板,使细 胞在盖玻片上贴壁生长,以4 GyX线照射,X线 +吉非替尼组以10 μmol/L吉非替尼提前24 h预处 理;取照射后0、15、30、45、60 min细胞,PBS洗,1%多聚甲醛10 min,70%酒精10 min固定; 0.2%Triton X-100,10 min破膜;PBS洗3遍,5% 山羊封闭血清室温下封闭10 min;加入一抗1:100 (γ-H2AX),18 h,4℃;PBS洗3遍,TRITC-II抗 1:50,1 h,37℃;Hoechst33342染核,浓度0.005 mg/10 ml,避光孵育15 min,PBS洗,甘油封片,固 定至载玻片上,避光保存,激光共聚焦显微镜观 察照相(日本Olympus),显微镜图像分析软件计 数亮点(美国Image-pro plus)。 1.2.6 免疫印记法
以4GyX线照射铺满瓶底80%~ 90%的细胞,X线+吉非替尼组以10 μmol/L吉非替 尼提前24 h预处理,取照射后0、15、30、60 min 细胞(5×106)~(1×107)个/毫升,提取细胞质、细 胞核蛋白进行蛋白定量(BCA蛋白浓度测定试剂 盒,Pierce,NO.2161297),分装保存于-80℃。 制备5%浓缩胶,8%分离胶,以60 μg蛋白上样, 电泳,先180 mA转膜120 min,再350 mA转膜90 min,5%脱脂奶粉室温封闭90 min,EGFR 1:500稀 释4℃孵育过夜,PBS洗,HRP-Ⅱ抗1:2,000稀释室 温孵育2 h,PBS洗,ECL室温5 min,暗室胶片曝 光。扫描胶片,凝胶成像灰度定量系统(美国Bio- Rad)对蛋白条带进行灰度分析。 1.3 统计学方法
各组实验均重复 3 次,数据取均数,实验数 据采用SPSS 13.0软件进行统计学处理,免疫印记 结果采用重复测量资料方差分析,其余实验结果 采用t检验,P<0.05为差异有统计学意义。 2 结果 2.1 MTT检测IC50及细胞增殖抑制率
吉非替尼对A549、H1975细胞增殖的抑制作 用呈剂量依赖性,其抑制A549细胞增殖IC50值是30 μmol/L,抑制H1975细胞增殖IC50值是27 μmol/L。 不同浓度吉非替尼对A549、H1975细胞增殖抑制 率,见图 1。结合本课题组前期实验[4, 5],吉非替尼 的半衰期及本实验结果选取实验浓度10 μmol/L。
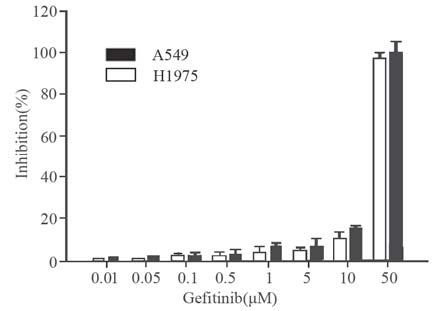 | 图 1 吉非替尼对A549和H1975细胞增殖的抑制率 Figure 1 Inhibition rate of Gefi tinib on the growth of A549 and H1975 |
用Sigmaplot软件拟合A549、H1975细胞剂量 生存曲线,以放疗剂量为横坐标,SF值取对数作 为纵坐标,结果显示X线+吉非替尼组A549细胞相 比单纯X线组生存曲线有明显差异,两条曲线分 开较大,见图 2,X线+吉非替尼组A549的SF2值 明显小于单纯X线组(单纯X线组:α=0.2983, β=0.0537,SF2=0.4833;X线+吉非替尼组:α= 0.3354,β=0.1097,SF2=0.3475)。而H1975细胞,X线+吉非替尼组和单纯X线组的生存曲线无明显 差异(单纯X线组:α=0.2804,β=0.1441,SF2 =0.3207;X线+吉非替尼组:α=0.2812,β= 0.1527,SF2=0.3094),见图 3。
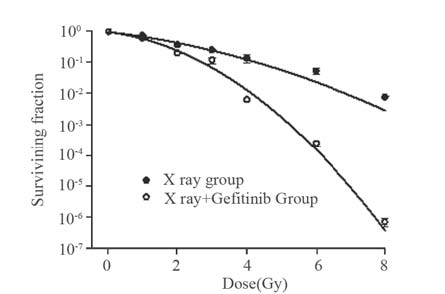 | 图 2 A549细胞生存曲线 Figure 2 Survival curve of A549 cell dose |
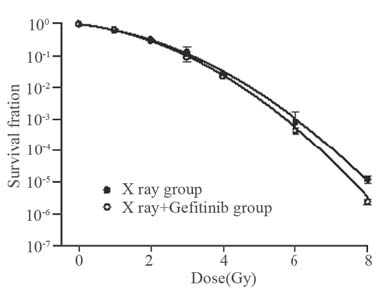 | 图 3 H1975细胞生存曲线 Figure 3 Survival curve of H1975 cell dose |
激光共聚焦显微镜观察经4 GyX线照射后不 同时间点各组细胞核内γ-H2AX亮点情况,蓝色为 细胞核,绿色亮点为γ-H2AX亮点,各组细胞均在 15 min时细胞核内开始出现绿色亮点,在30 min时 细胞核内绿色亮点最明显,60 min后开始消失;A549细胞X线+吉非替尼组比单纯X线组各时间点 绿色荧光更明显,见图 4A,而H1975细胞X线+吉 非替尼组对比单纯X线组各时间点无明显差别,见 图 5A。每组随机选取30个细胞,用Image-pro plus 软件计数亮点,比较相同时间点X线+吉非替尼组 与单纯X线组γ-H2AX亮点平均值,A549细胞X线+ 吉非替尼组比单纯X线组30、45、60 min时γ-H2AX 表达明显增高,见图 4B;而H1975细胞X线+吉非替尼组相比单纯X线组30、45、60 min时γ-H2AX表 达则无明显差异,见图 5B。
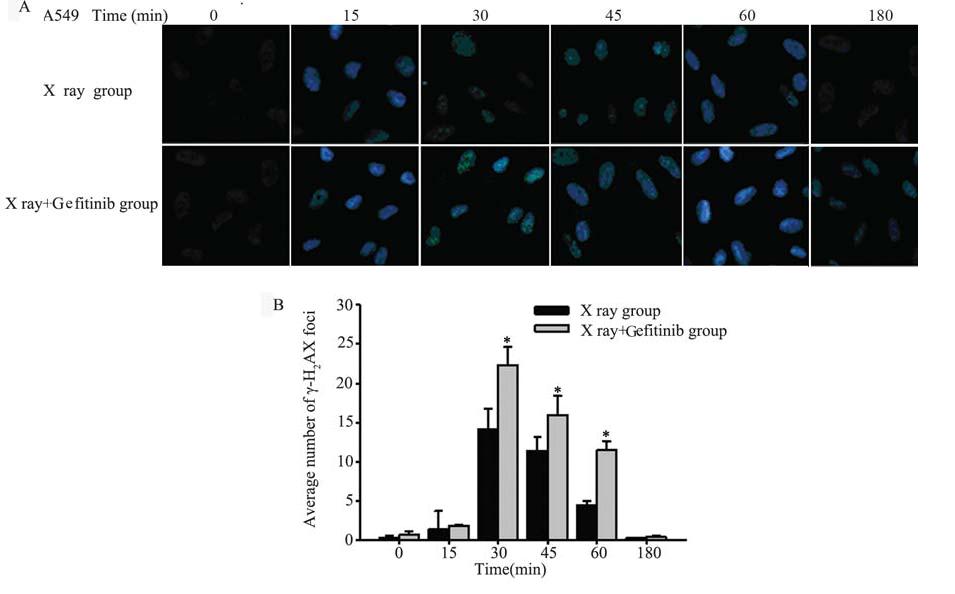 | 图 4 放疗后A549细胞中γ-H2AX免疫荧光结果 Figure 4 Fluorescence of γ-H2AX in A549 cells after irradiationA:immunostaining for confocal micros-copy testing for nuclear γ-H2AX foci of A549 cells after 4 Gy X ray; B:analsis of A549 cells nuclear γ-H2AX foci,*:X ray +Gefi tinib group vs.X ray group,P<0.001 |
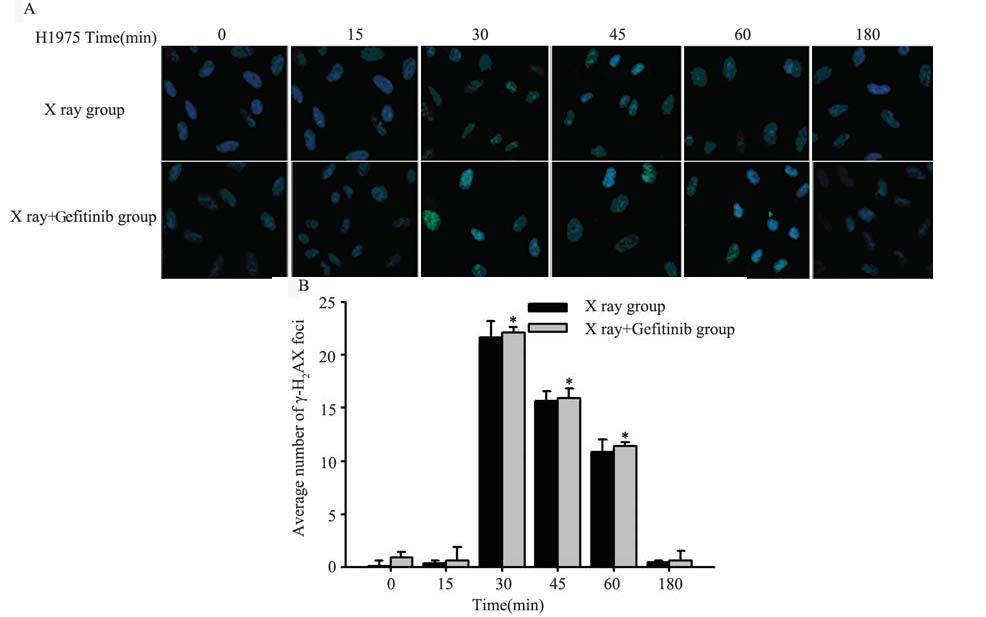 | 图 5 放疗后H1975细胞中γ-H2AX免疫荧光结果 Figure 5 Fluorescence of γ-H2AX in H1975 cells after irradiationA:immunostaining for confocal micros-copy testing for nuclear γ-H2AX foci of H1975 cells after 4 Gy X ray; B:analsis of H1975 cells nuclear γ-H2AX foci,*:X ray +Gefi tinib group vs.X ray group,P30min=0.108,P45min=0.123,P60min=0.070 |
A549细胞单纯X线组EGFR在放疗后有入核情 况,从放疗后15 min开始EGFR在胞核中表达逐渐 增多,到60 min时条带达最深,而胞质中EGFR表 达随时间呈递减趋势,说明4 Gy放疗后EGFR从胞质进入胞核,见图 6A;X线+吉非替尼组EGFR绝 大部分在胞质中表达,核内EGFR表达很少,且 条带无递增或递减变化。采用凝胶成像灰度定量 系统计算各条带的灰度值,做成柱状图,分别对 胞质、胞核内EGFR表达的两组数据进行重复测量 资料方差分析,差异有统计学意义(P胞质=0.043,P 胞核=0.004),见图 6B。结果表明A549细胞在放疗 后60 min内,在相同的时间点,X线+吉非替尼组细胞核EGFR表达均少于单纯X线组,可能是由于 吉非替尼通过某种途径阻止EGFR放疗后入核。 H1975细胞单纯X线组和X线+吉非替尼组EGFR在 各时间段均在胞质中表达,且胞质中条带无递增 或递减变化,胞核中无EGFR条带,见图 7A。采用 凝胶成像灰度定量系统计算各条带的灰度值,并 做成柱状图,分别对胞质、胞核内EGFR表达的两 组数据进行重复测量资料方差分析,差异无统计 学意义(P胞质=0.288,P胞核=0.623),见图 7B。结果 表明H1975细胞在放疗后60 min内,在各相同时间 点,单纯X线组和X线+吉非替尼组EGFR表达无差 异,且EGFR在胞核中表达明显少于胞质。
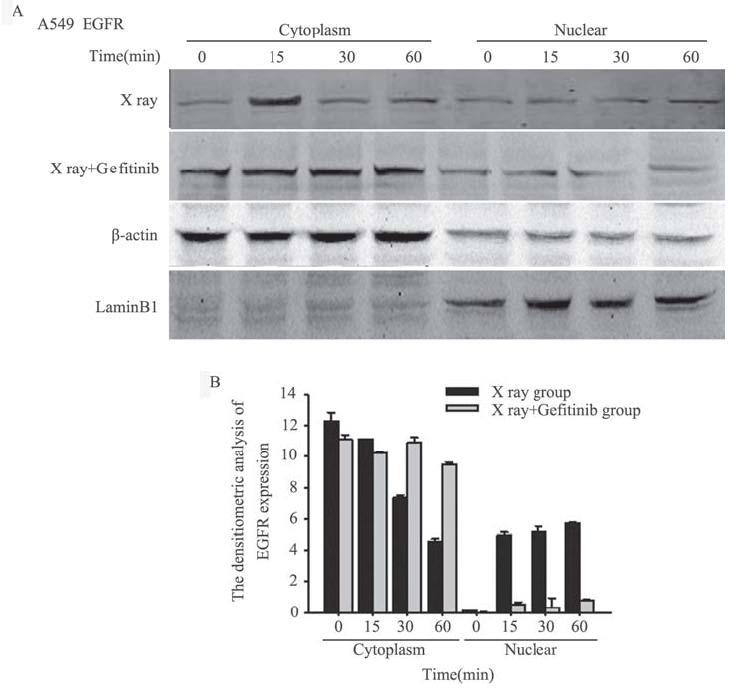 | 图 6 A549细胞EGFR的表达水平 Figure 6 The expression of EGFR in A549 cellsA:Western blot testing for cytoplesm and nuclear EGFR of A549 cell after 4Gy X ray;B:the densitometric of EGFR expression of A549cell |
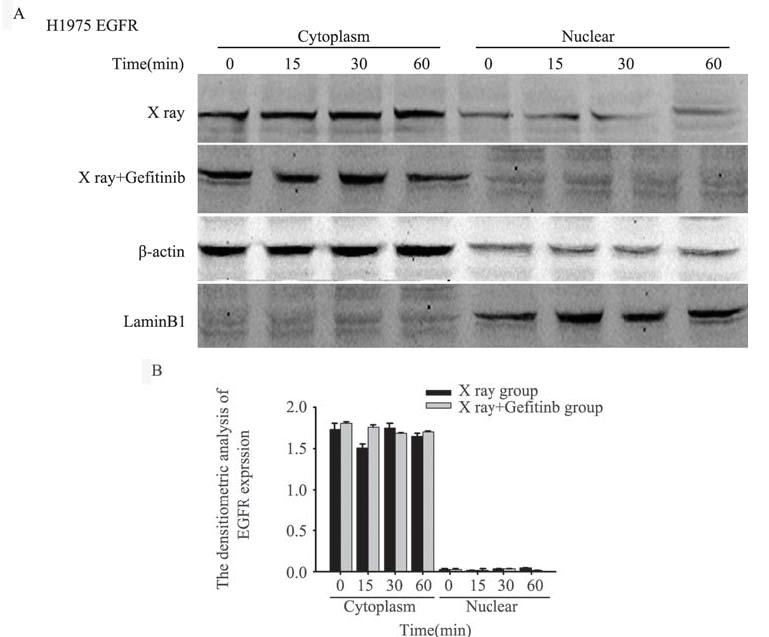 | 图 7 H1975细胞EGFR的表达水平 Figure 7 The expression of EGFR in H1975 cellsA:Western blot testing for cytoplesm and nuclear EGFR of H1975 cell after 4Gy X ray;B:the densitometric of EGFR expression of H1975 cell |
放射线可直接或间接作用于DNA,导致DNA 损伤,其中DNA双链断裂(DNA double strand break,DSB)是最致命的,DSB的修复方式主要 有两种:同源重组(homologous recombination, HR)和DNA非同源性末端连接(nonhomologous end joining,NHEJ)。HR主要在低等生物如酵母 细胞中起作用,或在人类等哺乳动物细胞的晚S期 和G2/M期发挥作用,主要由ATM蛋白主导,居于 从属地位;NHEJ修复在哺乳动物细胞中居于主要 地位,由DNA依赖性蛋白激酶(DNA-dependent protein kinase,DNA-PK)主导 [6]。DNA-PK由调 节亚单位Ku蛋白二聚体(包括Ku80和Ku70亚单 位)及催化亚单位DNA-PKcs(DNA-PK catalytic subunit)组成。当DSB产生后,Ku80和Ku70亚单 位迅速形成异源二聚体,与受损DNA末端结合, 激活DNA-PKcs,引导XRCC4和DNA-LigaseⅣ组 成复合体,最后由DNA-LigaseⅣ定位并连接断裂 的DNA双链末端完成修复[6]。
外源性化学、物理及生物性物质所致的DSB 都可能会使组蛋白H2AX发生快速磷酸化,形成 γ-H2AX。γ-H2AX的形成在DNA的DSB中不仅起到 损伤的标志性作用,而且在DNA的DSB修复中具 有连接的作用 [7] 。由于γ-H2AX的数量与DNA损伤 的数量存在一一对应的关系,因此,γ-H2AX可以 作为低剂量电离辐射衡量肿瘤放疗敏感度的指示 因子[8]。
EGFR的活化有两种形式:自身形成同二聚 体,在受到某些因素如表皮生长因子 (epidermal growth factor,EGF)刺激,或基因突变致构象改 变情况下被激活;与HER家族其他成员(主要是 HER2和HER3)形成异二聚体,在受到刺激的情 况下被激活。EGFR激活后将磷酸化胞内端的特异 性酪氨酸残基,活化胞内的下游通路,如Ras/Raf/ MAPK和PI3K/AKT通路,发挥调节细胞凋亡、生存、增殖和有丝分裂等作用[9]。Dittmann等[10]发现 EGFR除了通过上述信号转导通路以外,还有一 种直接入核的途径:放射线除了直接导致DSB, 还能使细胞中和细胞间的水电离,产生大量氧自 由基,细胞外的氧自由基作用于细胞膜上的一些 膜受体如EGFR,EGFR活化后直接通过胞质进入 胞核,与DNA-PK结合,激活DNA-PK的催化亚基 DNA-PKcs,进行受损DNA修复。
放射线引起的EGFR入核与scr激酶激活EGFR 进入细胞质膜微囊相关。Scr激酶分别在Y845残 端激活EGFR和Y14残端激活caveolin-1,两者激活 后形成复合物进入细胞质膜微囊,包含有EGFR 的微囊通过微管转运至高尔基复合体/内质网,并 融合为内质网膜。EGFR存在于易位子Sec61复合 体中,并可以被其释放进入胞质。Sec61易位子 广泛存在于内质网和内质网/高尔基复合体过渡区 域,在蛋白合成期将分泌蛋白和跨膜蛋白插入内 质网。通过PKCε途径EGFR在T654残端磷酸化, 并与核转运蛋白α和β结合,这一过程使EGFR通 过细胞核孔进入细胞核[11]。而与核转运蛋白结合 的先决条件是负荷蛋白出现核定位位点(nuclear localization site,NLS),Lin等[12]证实了EGFR序 列中该位点的存在及其功能,并且EGFR磷酸化的 T654残端正好位于该EGFR核定位位点。
本实验选取A549和 H1975细胞作为研究对 象,旨在探讨吉非替尼对此两株细胞是否有放疗 增敏作用,其机制是否同C225,即抑制放疗后活 化的EGFR直接进入核内激活DNA-PK进行的DSB 修复[3]。
根据克隆形成实验,计算SF值绘制剂量生存 曲线,发现A549细胞X线+吉非替尼组各剂量点细 胞存活率及SF2值均低于单纯X线组,说明前者放 疗后发生增殖性死亡的细胞多于后者,吉非替尼 能增加A549细胞的放疗敏感性。而H1975细胞X线 +吉非替尼组和单纯X线组SF2值并无明显差异, 吉非替尼对细胞株H1975无明显放疗增敏效应。
我们用免疫荧光技术观察以γ-H2AX焦点形成 为特征的DNA双链断裂,通过激光共聚焦荧光显 微镜观察放疗后不同时间点细胞核内γ-H2AX的表 达,并比较γ-H2AX亮点平均值,发现A549细胞两 组均可观察到放疗后细胞核内γ-H2AX的表达,且 在放疗后30 min达到高峰,60 min后逐渐消失,X 线+吉非替尼组的γ-H2AX亮点在各时间点均明显 多于单纯X线组,这说明了吉非替尼使A549细胞 放疗后DSB形成增多,表现出放疗增敏作用。而 H1975细胞,两组γ-H2AX亮点的变化及持续时间 无明显差异,说明放疗后两组DSB基本相同,吉 非替尼对H1975细胞无放疗增敏作用。
本实验通过Western blot检测放疗后两株细胞 EGFR入核情况,结果与激光共聚焦荧光显微镜 所观察到的一致。 A549细胞单纯X线组在放疗后 60 min内胞质EGFR表达随时间减少,胞核EGFR 表达随时间增多,X线+吉非替尼组EGFR大部分 在胞质中表达,细胞核内很少。Dittmann 等[10]前 期研究发现野生型EGFR肺癌细胞A549受X线照射 后,迅速入核与胞核内DNA-PK结合,进行DNA损伤 修复,出现放射抵抗。结合本实验结果分析,吉 非替尼可能是通过抑制放疗后A549细胞EGFR入核 与DNA-PK结合,从而阻止受损DNA进行修复, 产生放疗增敏作用。Tanaka等[13]报道,吉非替尼 与厄洛替尼的作用机制也许不同,因为他们未观 察到A549细胞加药组放疗后胞质及胞核内EGFR 表达的变化。产生不同结果的原因可能与加药浓 度高低有关,本实验吉非替尼的浓度为10μmol/L, 而Tanaka的研究[13]中浓度仅为1μmol/L。与此同 时,H1975细胞单纯X线组和X线+吉非替尼组EGFR 均在胞质中表达,没有观察到放疗后入核情况,且 各时 间点无趋势差异,组间也无差异。Das等[14]研 究发现,具有L858R + T790M 双重突变的H1975 细胞对放射线相对敏感,且放疗后在胞核中未检 测到EGFR的表达。本实验结果与之相似,由此 推测H1975细胞对放射线的敏感度不受吉非替尼 影响,原因与H1975细胞具有双重突变的EGFR 在两种条件下均不入核,无法与核内DNA-PK结 合完成DNA损伤修复相关。此外,吉非替尼通过 与ATP竞争,结合于EGFR-TK胞内端的催化区 域(EGFR结构域中高度保守的ATP结合位点),阻 止EGFR的自磷酸化及下游的信号传导,亦可影响 A549细胞修复。而H1975细胞EGFR发生二次突变 T790M,Kobayashi[15]和Pao等[3]研究显示T790残基位 于EGFR催化区域的ATP结合位点,该位点是吉非 替尼和厄洛替尼的关键作用点。当该点的苏氨酸 被甲硫氨酸替换后,出现两种药物结合到此位点的 空间阻碍现象,可见吉非替尼对H1975细胞作用甚 微。
综上所述,吉非替尼是否还通过其他途径影 响A549细胞放疗敏感度;达到增敏效果需要多大 的用药浓度;对其他不同状态的EGFR是否有放疗 增敏作用;能否将EGFR作为放疗增敏的靶点应用 于临床,以上问题还需进一步验证。
| [1] | Friedmann BJ, Caplin M, Savic B, et al. Interaction of the epidermal growth factor receptor and the DNA-dependent protein kinase pathway following gefitinib treatment[J]. Mol Cancer Ther,2006,5(2):209-18. |
| [2] | Dittmann K, Mayer C, Rodemann HP. Inhibition of radiationinduced EGFR nuclear import by C225 (Cetuximab) suppresses DNA-PK activity[J]. Radiother Oncol,2005,76(2):157-61. |
| [3] | Pao W, Miller VA, Politi KA, et al. Acquired resistance of lung adenocarcinomas to gefi tinib or erlotinib is associated with a second mutation in the EGFR kinase domain[J]. PLoS Med,2005,2(3):e73. |
| [4] | Deng J, Zhuang L, Chen Y. Effection and mechanism of radiosensitivity of non-small cell lung cancer cell line H358 following gefitinib treatment[J]. Zhongguo Fei Ai Za Zhi, 2011,14(11):841-7.[ 邓洁,庄亮,陈元.吉非替尼对肺癌细 胞株H358放疗敏感性的影响及其机制[ J] .中国肺癌杂 志,2011,(14):11841-7.] |
| [5] | Gao ZY, Zhuang L, Chen Y. Effect and mechanism of gefitinib inhibition on non-small cell lung cancer radiosensitivity of HCC827 and H358 cell lines[J]. Zhongguo Fei Ai Za Zhi,2012,15(6):324-31.[高子夜,庄亮,陈元.吉非替尼对肺癌细胞 株HCC827和H358放射敏感性的影响及其机制研究[J]. 中国肺 癌杂志,2012,15(6):324-31.] |
| [6] | Collis SJ, DeWeese TL, Jeggo PA, et al. The life and death of DNAPK[ J]. Oncogene,2005,24(6):949-61. |
| [7] | Rogakou EP, BoonC, Redon C, et al. Megabase chromatin domains involved in DNA double-strand breaks in vivo[J]. J Cell Biol,1999,146(5): 905-16. |
| [8] | Thiriet C, Hayes JJ. Chromatin in need of a fix: phosphorylation of H2AX connects chromatin to DNA repair[J]. Mol Cell,2005,18(6):617-22. |
| [9] | Mass RD. The HER receptor family: a rich target for therapeutic development[J]. Int J Radiat Oncol Biol Phys,2004,58(3):932–40. |
| [10] | Dittmann K, Mayer C, Fehrenbacher B, et al. Radiationinduced epidermal growth factor receptor nuclear import is linked to activation of DNA-dependent protein kinase[J]. J Biol Chem,2005,280(35):31182–9. |
| [11] | Dittmann K, Mayer C, Rodemann HP. Nuclear EGFR as novel therapeutic target: insights into nuclear translocation and function[J]. Strahlenther Onkol,2010,186(1):1-6. |
| [12] | Lin SY, Makino K, Xia W, et al. Nuclear localization of EGF receptor and its potential new role as a transcription factor[J]. Nat Cell Biol,2001,3(9):802-8. |
| [13] | Tanaka T, Munshi A, Brooks C, et al. Gefi tinib radiosensitizes nonsmall cell lung cancer cells by suppressing cellular DNA repair capacity[J]. Clin Cancer Res,2008,14(4):1266-73. |
| [14] | Das AK, Sato M, Story MD, et al. Non-small-cell lung cancers with kinase domain mutations in the epidermal growth factor receptor are sensitive to ionizing radiation[J]. Cancer Res,2006,66(19):9601-8. |
| [15] | Kobayashi S, Boggon TJ, DayaramT, et al. EGFR mutation and resistance of non-small-cell lung cancer to gefitinib[J]. N Engl JMed,2005,352(8):786-92 |
 2014, Vol.41
2014, Vol.41


