2.航空总医院妇科
2.Department of Gynaecology, Aviation General Hospital
上皮性卵巢癌发病隐匿,发现时多为晚期,而 且治疗效果差,63%的患者确诊已为晚期(Ⅲ~Ⅳ 期),75%的患者在初治后的两年内易复发[1],广 泛性肿瘤细胞减灭术和多疗程化疗是卵巢上皮癌 的基本治疗原则。其中以铂类为基础的联合化疗 是卵巢癌治疗的重要组成部分,而肿瘤细胞多药 耐药性和化疗药物的不良反应,常导致化疗的失 败。寻找新的、低毒性的、有效杀灭肿瘤细胞并对 基础化疗药有增敏的药物迫在眉睫。二氢青蒿素 (dihydroartemisinin,DHA)是一种青蒿素类药物中 活性较强的衍生物,是青蒿素类药物在体内的主要 活性代谢产物。近年来研究发现,DHA除可抗疟疾 外,在体内、外均具有抗肿瘤作用,与其他青蒿素 类衍生物相比具有更强的抗肿瘤活性[2]。本研究以 人卵巢癌SKOV3细胞为对象,观察二氢青蒿素对该 细胞系的体外抑制作用。 1材料与方法 1.1 材料与仪器
人卵巢癌SKOV3细胞,购于中国医学科学院 肿瘤细胞库。DHA购自中国药品生物制品检定所 (以DMSO助融)。RPMI1640培养液和DMSO购自 Salarbio公司;胎牛血清购自北京全世金生物技术有 限公司;MTT购自美国Sigma公司;流式凋亡试剂盒 购自KeyGEN 公司;反转录试剂盒购自康为试剂有限 公司;Bcl-2、Bax引物购自南京金斯瑞生物科技有限 公司。流式细胞仪购自BD FACSCalibur;酶标仪购 自美国Beckman公司;CO2 培养箱购自美国Thermo公司;PCR 仪购自美国Bio-RAD 公司。 1.2 方法 1.2.1 药物配置
二氢青蒿素用DMSO溶解配制 成100 mmol/L的母液,使DMSO终浓度<0.1%,过 滤,-20℃保存,用之前均用RPMI1640配成终浓度。 1.2.2 细胞培养
将人卵巢癌SKOV3细胞培养在含 100 u/ml青霉素、100μg/ml链霉素的10%胎牛血清的 RPMI1640培养液中,37℃、5% CO2饱和湿度条件 下培养,当细胞长至80%~90%,用0.25%胰蛋白酶 消化传代,取对数生长期细胞进行实验。 1.2.3 细胞增殖抑制试验(MTT法)
取对数生长 期的细胞接种于96孔板,将细胞浓度调为1×10 5个/毫升,每孔200 μl细胞数1×104个细胞培养24 h贴壁 后加入适当浓度药物,药物浓度组为二氢青蒿素 (5、10、20、40、80 μmol/L),各浓度各设计5个 复孔,空白对照组加入等体积含0.1%DMSO的培养 液,37℃、5% CO2饱和湿度下培养24、48、72 h, 弃上清液,每孔中加入MTT溶液(5 mg/ml) 20 μl继 续避光孵育4 h,终止培养。加样器小心吸去上清 液,每孔加DMSO 150 μl,震荡10 min。在酶标仪上 测490 nm处吸光值(OD值),记录结果。抑制率 =(1-OD实验组/1-OD对照组)×100% 。采用SPSS16.0 统计软件计算药物的半数抑制浓度( IC50值)。重复 实验3次,取其平均值。 1.2.4 Annexin V/PI双染色法流式细胞仪检测细胞凋 亡率
取不同浓度组的DHA(空白对照组0 μmol/L、 低浓度组5 μmol/L、中浓度组20 μmol/L、高浓度组 80 μmol/L)对数生长期的细胞,以每孔(1~5)×10 6 密度种植于6孔板。细胞贴壁后,吸弃上清液,对照 组和加药组处理24、48、72 h后收集所有悬浮及贴 壁细胞,每样本细胞数约为1×10 6个,1 000 r/min离 心5 min,弃去培养液。加入冷的PBS洗涤两次,2 000 r/min离心5 min。用500 μl Binding Buffer重悬细 胞,然后用5 μl标记溶液(FITC-Annexin V和PI加入 到Binding Buffer中,终浓度均为1 μg/ml),室温下避 光孵育10~15 min。在流式细胞仪上测定检测凋亡率 (早期凋亡、晚期凋亡及坏死)。实验重复3次。 1.2.5 反转录-聚合酶链反应(RT-PCR)
按实 验室常规操作提取细胞总RNA,并制备cDNA。 在Taq酶的作用下,进行扩增。扩增程序为94℃变 性30 s,54.5℃,退火30 s,72℃延伸1 min,35个 循环。所得的扩增产物进行1%的琼脂糖凝胶电泳 (120 V,30 min),凝胶成像系统(Bio-Rad公司)成 像,用Band Leader软件定量分析产物条带的吸光 度值。实验用的引物:Bcl-2引物序列为5'-ATCC ATTATAAGCTGTCGCA-3'(正向引物)和5'-CG GTTCAGGTACTCAGTCAT-3'(反向引物);Bax 引物序列为5'-GCTCTGAGCAGATCATGAAGA-3 (正向引物)5'-CCATGTTACTGTCCAGTTCGT-3'(reverse primer);内参(h-actin)引物序列为5'- CGGGAAATCGTGCGTGAC -3'(正向引物)和5'- TGGAAGGTGGACAGCGAGG -3' (反向引物)。 所有实验都重复3次。 1.3 统计学方法
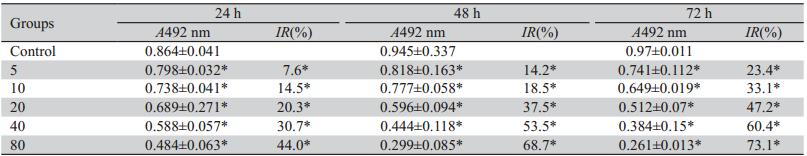
实验数据均以x±s表示。采用SPSS 16.0统计程 序,以t检验分析样本均数间的差异,以P<0.05为差 异有统计学意义。 2 结果
2.1 DHA对人卵巢癌SKOV3细胞增殖抑制的作用
不同浓度及时间的DHA作用于卵巢癌SKOV3 细胞后,细胞生长速度呈下降趋势,并且呈现较明 显的时间及浓度依赖性。其中在较低浓度组(5、10 μmol/L)的48 h内对比中,抑制率生长稍微缓慢,抑 制率上升空间为4.3%、6.9%,在其72 h起抑制率上 升幅度为14.6%及9.2%,且其48~72 h的上升幅度明 显高于24~48 h上升幅度(6.8%、6%)。而同一时间 的中、高浓度组(20、40、80 μmol/L)抑制率上升 均较快,为10.4%~16%之间,而在此浓度组的不同 时间的抑制率中,24~48 h抑制率上升幅度较48~72 h抑制率上升的幅度有着明显的差异,24~48 h上升 的幅度为17.2%~24.7%,而48~72 h上升的幅度仅为 4.4%~9.7%。同时,在此实验结果中可以看到,各个 时间的浓度组与对照组之间相比差异均具有统计学 意义(F=10.297,P﹤0.05)。不同浓度的DHA(5、 10、20、40、80 μmol/L)作用24、48、72 h后,IC50分 表1 MTT法检测DHA对SKOV3细胞增殖的抑制作用(n=5,x±s)别为117、35.677、23.382 μmol/L,见表1。
|
|
表1 MTT法检测DHA对SKOV3细胞增殖的抑制作用(n=5,x±s) Table 1 The inhibition of dihydroartemisinin on proliferation of SKOV3 cells by MTT (n=5,x±s) |
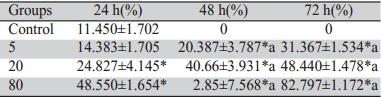
Annexin V/PI双染色法将凋亡早晚期的细胞以 及死细胞区分开来,取不同浓度组的DHA [ 0(对 照组)、5 、20、80 μmol/L] 在不同的时间段(24、 48、72 h)作用于卵巢癌SKOV3细胞后,细胞凋 亡率上升,并且呈现明显的时间及浓度依赖性。 根据统计学数据,除去24 h 5 μmol/L浓度组以外, 各个浓度组与对照组比较差异均有统计学意义 (F=122.232,P﹤0.05),各时间的浓度组与对照 组之间差异有统计学意义,并且各个浓度组在不 同的时间阶段均有统计学意义(5 μmol/L:one-way ANOVA,F=34.056,P=0.001;20 μmol/L one-way ANOVA,F=37.429,P=0.000;80 μmol/L one-way ANOVA,F=45.509,P=0.000),差异具有统计学意 义。5 μmol/L随着时间的延长,其抑制率上升幅度 增大,其48~72 h为24~48 h 的2倍左右,而中、高浓 度组(20、80 μmol/L)时间上抑制率的上升幅度刚 好与低浓度组相反,其24~48 h的上升幅度为48~72 h的2倍左右。同时,流式细胞仪结果显示不同浓 度组(0、5、20、80 μmol/L)作用SKOV3细胞24 h 后,其凋亡率分别为(11.450±1.702)%,(14.383± 1.705)%,(24.827±4.145)%,(48.550±1.654)%, 随浓度的增高而升高,差异有统计学意义(one-way ANOVA; F=132.132,P=0.000),见图1、表2。
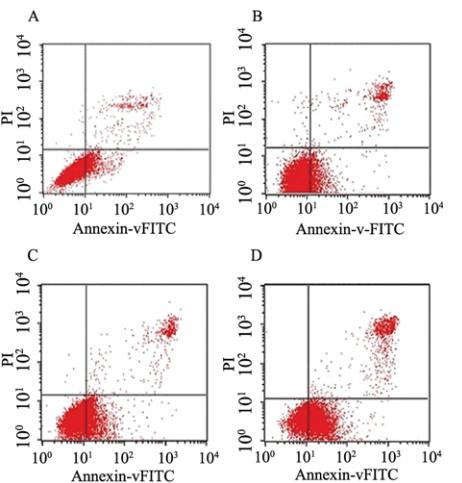 | 图1 Annexin V/PI双染色法检测不同浓度二氢青蒿素24 h诱导SKOV3细胞凋亡的结果图Figure 1 Assessment of SKOV3 cell apoptosis induced by DHA of different concentrations for 24 h by Annexin V/PINotes:A:control group;B:5 μmol/L;C: 20 μmol/L;D:80 μmol/L |
|
|
表2 FCM检测DHA诱导SKOV3细胞的凋亡率(n=5,x±s) Table 2 Effects of DHA on the apoptosis rate of SKOV3 cells by FCM (n=5,x±s) |
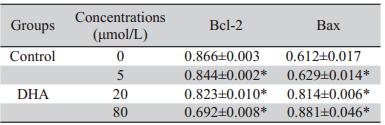
根据Band Leader软件分析,不同浓度组二氢青 蒿素(0、5、20、80 μmol/L)作用于SKOV3细胞,各 DHA浓度组Bcl-2吸光度值与对照组相比较呈下降 趋势,差异具有统计学意义(P﹤0.05),各浓度Bax 吸光度值与对照组相比较明显增高,差异有统计学意 义(P﹤0.05),见图2、表3。
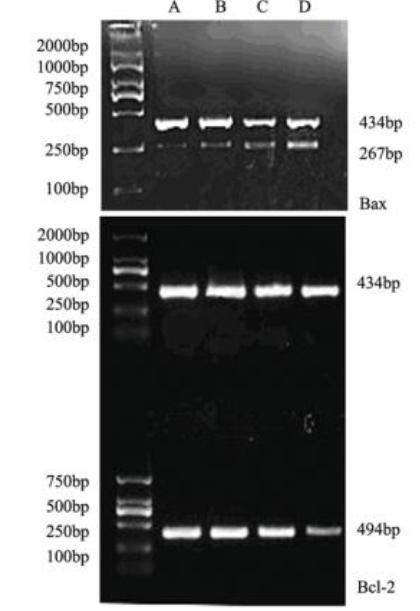 | 图2 RT-PCR产物的琼脂糖凝胶电泳结果 Figure 2 Agarose gel electrophoresis of RT-PCR products A: h-actin, Bcl-2 and Bax level in control group:B:expressions of h-actin, Bcl-2 and Bax after SKOV3 cells treated with Dihydroartemisinin(5 μmol/L);C:expressions of h-actin, Bcl-2 and Bax after SKOV3 cells treated with Dihydroartemisinin(20 μmol/L);D: expressions of h-actin, Bcl-2 and Bax after SKOV3 cells treated with Dihydroartemisinin(80 μmol/L) |
|
|
表3 二氢青蒿素对SKOV3细胞Bcl-2和Bax表达的影响(x±s,n=3) Table 3 Effects of DHA on gene expression of Bcl-2 and Bax in SKOV3 cells (x±s,n=3) |
卵巢癌是女性常见的恶性肿瘤,死亡率居于妇 科恶性肿瘤之首[3]。卵巢癌化疗药物对人体不良反 应较大,且复发率较高,寻求高效低毒的治疗用药 是必经之路。青蒿素(Artemisinin)是我国药学工作者 1971年从菊科植物黄花蒿(Artemisiaannal)叶中提取 分离到的一种具有过氧基因的倍半萜内酯化合物, 具有清热解毒,抗肿瘤、抗菌、抗疟,增强免疫等 药理作用,临床上已用于治疗脑型疟、恶性疟[4, 5], 青蒿素类药物具有较强的抗肿瘤活性作用[2],二氢 青蒿素(DHA)是一种青蒿素类药物中活性较强的衍 生物,是青蒿素类药物在体内的主要活性代谢产 物,近年来各种研究发现,DHA在体内、外具有抗 肿瘤作用,与其他青蒿素类衍生物相比具有更强的 抗肿瘤活性[6]。相关研究表明,二氢青蒿素可以通 过抑制细胞增殖、阻滞细胞周期,诱导肿瘤细胞凋 亡,抑制肿瘤血管生成,Fe2+介导产生氧自由基的 细胞毒作用,耐药性逆转,从而提高肿瘤细胞对放 化疗的敏感度起着抑制肿瘤生长的作用。
本实验结果表明,DHA对SKOV3细胞生长的抑 制随浓度的升高和时间的延长而增强,24、28、72 h的IC50值分别为117、35.677、23.382 μmol/L,提示 DHA一定程度上可抑制SKOV3细胞的生长。一定浓度的DHA可抑制卵巢癌SK0V3细胞增殖,诱导细胞 凋亡,并表现出时间和浓度依赖性。低浓度组及中、 高浓度组对于细胞的抑制率方面又有着一定程度上 的差异性,低浓度组时间依赖性比高浓度组较强, 而高浓度组对于低浓度组而言,随着时间的推移, 其抑制细胞生长的幅度有着较明显的下降趋势,是 由于药物依赖性所致还是药效已经达到饱和值或者 是否已产生耐药性,需要进一步的论证。因此,如何 在这些浓度中寻找到一个较佳值,使其在相对短的 时间促进癌细胞的凋亡,需要进一步的实验论证。
卵巢癌的发生发展不仅是细胞增殖异常的结 果,也可能与细胞凋亡失衡有关。本研究通过流式 细胞仪检测可以看出,不同浓度的DHA在不同的时 间段作用于卵巢癌SKOV3细胞后,细胞凋亡率有一 定程度的上升,并表现出一定的量效和时效关系。 同时,低浓度组较高浓度组的时间依赖性更明显,这 一结果可以表明,高浓度组可能在较短的时间内抑 制细胞的增殖,细胞抑制之后的维持期是否继续使 用此药物维持高浓度来抑制细胞的增殖,是否可以在中、高浓度组作用于细胞24或48 h后,采用低浓度 组维持药物作用,其抑制率是否相同,单一药物是 否具有一定程度的耐药性,都有待进一步的研究。 线粒体参与细胞凋亡的发生、发展及调控过 程。有研究表明,线粒体膜上Bcl-2表达水平的增高 抑制线粒体中细胞色素c的释放,从而抑制肿瘤细 胞凋亡。Bax可直接结合Bcl-2抑制其抗凋亡作用, DHA能有效升高细胞内促凋亡蛋白Bax,同时下调 抗凋亡蛋白Bcl-2 [7, 8, 9, 10]。同时,研究表明 [11],内质网 应激可参与细胞凋亡,本实验也表明,DHA可以通 过下调Bcl-2基因表达,上调Bax基因的表达来促进 细胞的凋亡。而DHA在线粒体通路与内质网应激中 是否存在相关性以及相关网,我们将进一步研究。
综上所述,二氢青蒿素作为一种中药成分,一 定程度上能抑制肿瘤细胞增殖,有可能成为新型辅 助化疗药物。在卵巢癌方面,二氢青蒿素一定程度 上可以降低卵巢癌细胞的凋亡率,但其在体内实验 中是否同样可以降低肿瘤的生长或者抑制肿瘤的生 长,有待进一步考证。在卵巢癌基础抗肿瘤药物联 合使用时,对于二氢青蒿素对抗癌药是否有协同增 敏作用,成为化疗药物增敏剂;能否提高基础化疗 药物顺铂、卡铂的疗效以及有效率,抑或逆转肿瘤 细胞的耐药性方面,也有待进一步研究。
| [1] | Tummala MK, McGuire WP. Recurrent ovarian canner[J]. Adv Hematol Oncol,2005,3(9):723-36. |
| [2] | Nam W, Tak J, Ryu JK,et al. Effects of artemisinin and its derivatives on growth inhibitionand apoptosis of oral cancer cells[J]. Head Neck,2007,29(4):335-40. |
| [3] | Lee S.Artemisinin,promising lead natural product for various drug developments [J].Mini Rev Med Chem,2007,7(4):411-22. |
| [4] | Hien TT, White NJ. Qinghaosu[J]. Lancet,1993,341(8845):603-8. |
| [5] | Dhingra V,Vishweshwar Rao K,Lakshmi Narasu M. Current status of artemisinin and its derivatives as antimalarial drugs[J]. Life Sci,2000,66(4):279-300. |
| [6] | Nam W, Tak J, Ryu JK, et al. Effects of artemisinin and its derivatives on growth inhibitionand apoptosis of oral cancer cells[J]. Head Neck,2007,29(4):335-40. |
| [7] | Gu HT,Mao HT,Zhang L,et al. Effects of dihydroartemisinin on proliferation and apoptosis of breast carcinoma cell line T47D[J].Zhonghua Zhong Liu Fang Zhi Za Zhi,2009,16(14):1051-4.[顾洪涛,毛海婷,张玲,等.二氢青蒿素诱导乳腺癌细胞凋亡的分子机制初探[J].中华肿瘤防治杂志,2009,16(14):1051-4.] |
| [8] | Li A,Zhou HJ.The dihydroartemisinin induces apoptosis in HL-60 cells[J].Zhongguo Yao Li Xue Yu Du Li Xue Za Zhi,2007,21(3):217-22.[李傲,周慧君.二氢青蒿素诱导HL-60细胞凋亡[J].中国药理学与毒理学杂志.2007,21(3):217-22.] |
| [9] | Chen T, Li M, Zhang R, et al. Dihydroartemisinin induces apoptosis and sensitizes human ovarian cancer cells to carboplatin therapy[J]. J Cell Mol Med,2009,13(7):1358-70. |
| [10] | Li QC,Gao XL,Zou C,et al. Regulatory effects of dihydroartemisinin on Bcl-2 and Bax expression in implanted prostate cancer in nude mice[J].Di Er Jun Yi Da Xue Xue Bao,2010,31(1):24-7.[李庆春,高小玲,邹聪,等.双氢青蒿素对前列腺癌裸鼠种植瘤Bcl-2和Bax表达的调控[J].第二军医大学学,2010,31(1):24-7.] |
| [11] | Lu JJ, Chen SM, Zhang XW, et al. The anti-cancer activity of dihydroartemisinin is associated with induction of iron-dependent endoplasmic reticulum stress incolorectal carcinoma HCT116 cells[J]. Invest New Drugs,2011,29(6):1276-83. |
 2014, Vol.41
2014, Vol.41