卵巢癌恶性程度高,死亡率位居妇科肿瘤 之首。75%患者确诊时已是晚期,多伴有腹腔等 远处转移,5年生存率约为25% [1]。上皮间质转化 (epithelial-mesenchymal transition,EMT)是肿瘤侵 袭转移中发生的重要特征[2, 3]。在卵巢癌中,EMT 的进程也被证实与肿瘤进展及转移密切相关[4, 5]。 E-cadherin不仅是EMT进程的重要分子标志,同时 作为EMT进程的关键分子,是研究调控肿瘤细胞 EMT机制的重要分子靶标[3, 6, 7]。研究表明E-cadherin 在卵巢癌组织中的表达下调,但是机制仍然不十分 明确。microRNA是大约由20到25个核苷酸构成、进 化上高度保守的一类非编码RNA [8, 9]。它 通 过 碱 基 互 补配对的方式与靶基因的3’UTR区结合,在转录后 水平调控靶基因的表达[10],对于多种肿瘤细胞的生 长、分化、侵袭和转移有着重要的调控作用 [11, 12]。
为了探索miRNA与卵巢癌E-cadherin表达异常 之间的关系,本课题组首先用生物信息学分析了可 能与E-cadherin表达调控有关的miRNA,发现miR-9 是唯一能与E-cadherin编码基因(CDH1)3’UTR 区发生结合的miRNA。由此,本研究对miR-9对 E-cadherin表达的调控作用及其对卵巢癌细胞侵袭 和转移能力的影响进行了探讨。 1 材料和方法 1.1 主要试剂和仪器
RPMI 1640培养液购自美国Gibco公司;miR-9 mimics及所用引物购自中国广州锐博生物科技有 限公司。Dual-luciferase检测试剂盒购自Promega公 司;E-cadherin,Vimentin,β-Catenin抗体购自美 国Epitomics公司;Transwell培养板由美国Corning 公司生产;Matrigel 购自美国BD公司。 1.2 生物信息学miRNA靶基因预测
使用目前公认的miRNA靶基因预测数据库 TargetScan、(http://www.targetscan.org/)、PicTar (http://pictar.mdc-berlin.de/),预测哪些miRNA 可以靶向E-cadherin的编码基因CDH1,并使用 RNA22软件计算两者的结合自由能。 1.3 细胞培养及转染
卵巢癌细胞株SKOV-3购自美国标准生物 品收藏中心(ATCC)。用含有10%胎牛血清的 DMEM培养液,5% CO2条件下传代培养。转染 前取每孔4×105个细胞接种六孔板,培养过夜后, 使用Invitrogen LipofectamineTM 2000转染miR-9 mimics(100 μM) 试剂,转染miR-9 mimics 48 h后进 行后续实验。 1.4 双荧光素酶报告基因体系
构建含有CDH1 mRNA的3’UTR的双荧光素 酶报告基因体系,称为psi-check2-CDH1。miR-9 mimics 分别和psi-check2-CDH1及对照psi-check2共 转染,24 h后使用Dual-luciferase检测试剂盒检测 luciferase活性。 1.5 Western blot检测E-cadherin表达
取转染miR-9 mimics后48 h的SKOV-3细胞,裂 解细胞提取总蛋白。一抗(1:1 000稀释)4℃孵育 过夜,β-actin作为内参照,结果用Image J软件分 析条带灰度值。 1.6 细胞免疫荧光
取转染miR-9 mimics 24 h及对照组的SKOV-3细 胞,消化接种至无菌载玻片上,培养24 h,4%多聚甲 醛固定10 min,PBS冲洗,Triton100破膜5 min,PBS 冲洗,羊血清封闭室温30 min,分别加入E-cadherin (1:50稀释)、Vimentin(1:100稀释)、β-Catenin (1:100稀释)抗体,4℃孵育过夜,PBS冲洗, 加入绿色荧光二抗(1:200稀释)37℃避光孵育30 min,之后均避光操作,PBS冲洗,DIPI工作液染 核5 min,荧光显微镜下观察并拍照。 1.7 Transwell试验(细胞侵袭试验)
Matrigel用DMEM培养液1:5稀释,每孔80 ul加 入Transwell上室,37℃放置1 h备用。24孔板每孔 加入600 μl含10%胎牛血清的RPMI1640培养液,放 入Transwell上室,每小室内加入200 μl无血清培养 液,内含含5×103个细胞。培养24 h后取出上室, 用4%多聚甲醛固定10 min,1 g/L的结晶紫染色10 min,PBS冲洗3次,风干后置于显微镜下观察, 随机计数6个高倍镜视野计数细胞数,拍照并用 ImageJ软件分析。 1.8 统计学方法
采用SPSS 18.0统计软件处理数据,计量资料 用t检验分析。P<0.05为差异有统计学意义。 2 结果 2.1 miR-9可与CDH1 mRNA的3’UTR区域结合
通过目前公认的miRNA靶基因预测数据库 TargetScan和PicTar预测可以靶向E-cadherin编码基 因CDH1的miRNAs。结果发现只有miR-9可以结合 于CDH1 mRNA 3’UTR区的第1327-1333号碱基, 见图 1A。RNA22软件计算结合自由能为-26.40 Kcal/mol,并且生物信息学分析显示和miR-9种子 序列特异性结合的CDH1 3’UTR序列存在高度种属 保守性,见图 1B。
 | 图 1 CDH1 mRNA的3’UTR区与miR-9相结合 Figure 1 miR-9 directly targets CDH1 by interacting with its 3’UTR A: the binding site of CDH1 mRNA 3’UTR predicted by TargetScan and PicTar algorithms analysis; B:the predicted binding site of CDH1 mRNA 3’UTR with miR-9 was highly conserved in many species, and the complementary sequences of seed sequence of miR-222 were highlighted |
构建含有CDH1 mRNA 3’UTR的双荧光素酶报 告载体,称为psi-check2-CDH1。miR-9 mimics 分 别和psi-check2-CDH1及对照psi-check2共转染,发 现miR-9可以降低psi-check2-CDH1组海肾荧光素 酶活性到58%(t=7.937,P=0.001),见图2A,提示 miR-9可以与CDH1的3’UTR区相结合。
在SKOV-3中,转染miR-9 mimics 48 h,Realtime PCR检测发现miR-9表达上调为对照组的23.4 倍(t=8.257,P=0.001);CDH1 mRNA表达降低 至对照组的24%(t=16.8,P=0.000),见图2B; Wester n blot法检测E-cadherin的表达明显下降,为 对照组的26%(t=28.3,P=0.000),见图2C。
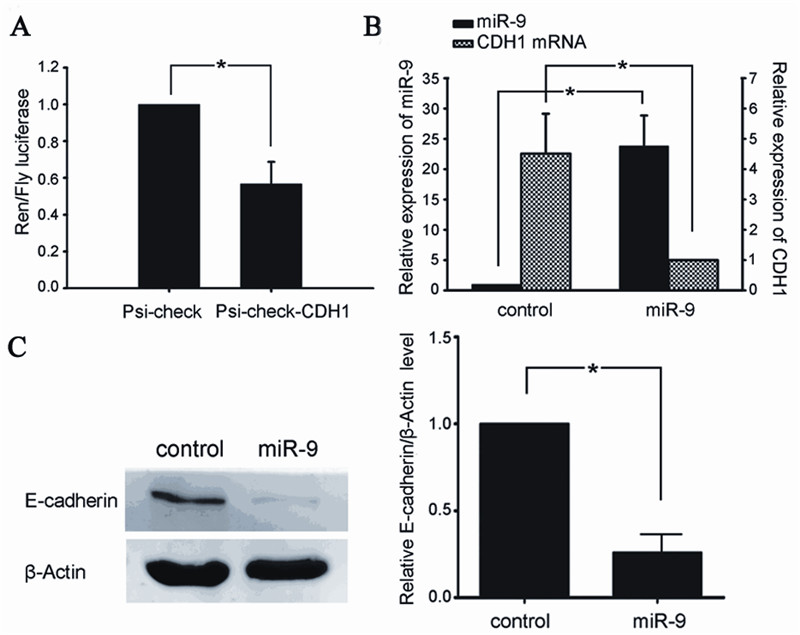 | 图2 体外验证CDH1为miR-9的靶基因
Figure 2 Validation that miR-9 directly targets CDH-1 in vitro
A:Luciferase activities were measured in SKOV3 cells cotransfected with
psi-check2-CDH1 with miR-9 mimic or miR-control; B: Real-time PCR
of miR-9 and CDH1 mRNA in miR-9 mimic or miR control transfected
cells; C: Immunoblotting of E-cadherin in miR-9 mimic or miR-control
transfected cells. Values represented 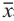 ±s,n=3;*:P<0.05 ±s,n=3;*:P<0.05
|
转染miR-9 mimics 48 h后,显微镜见SKOV-3-miR-9细胞间连接更为松散,胞质向外延展成“伪 足”样,表现为成纤维细胞或间质细胞形态,见图 3A。免疫荧光结果显示,与对照组相比,SKOV-3-miR-9组上皮性标志物E-cadherin在胞质内表达明 显下降,而间质性标志物Vimentin和β-Catenin的荧 光强度显著增强,见图3B。
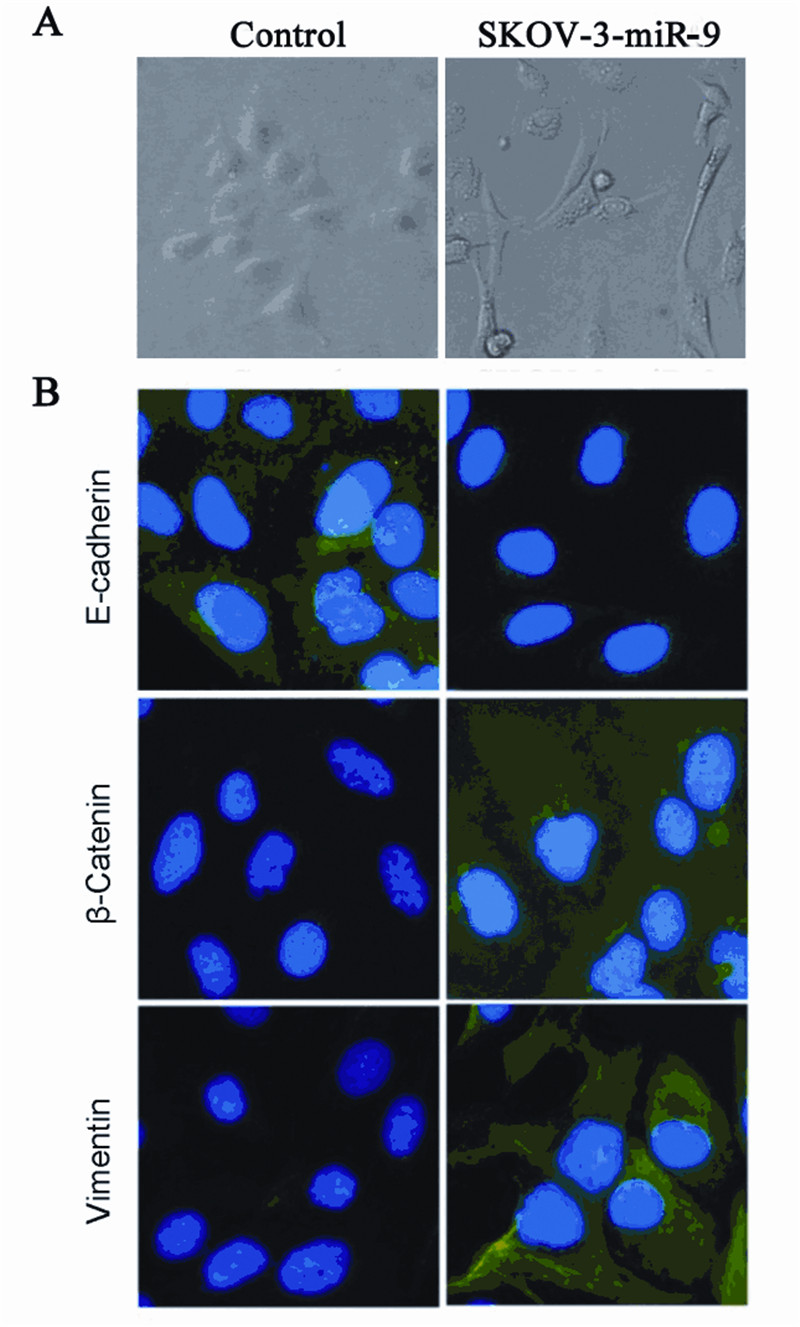 | 图3 上调miR-9促进卵巢癌细胞系SKOV-3的EMT进程 Figure 3 miR-9 upregulation promotes EMT transformation of SKOV-3 cell A:phase contrast images illustrated that miR-9 mimic transfected SKOV-3 cells showed EMT morphological changes;B: Immunofluorescence staining of E-cadherin,Vimentin,β-Catenin (green) in miR-9 mimic or miR control transfected cells |
划痕实验发现SKOV-3-miR-9划痕愈合程度明 显快于SKOV-3,使用TScratch软件分析划痕面细 胞覆盖面积,48 h细胞覆盖面积为93%,对照组为 61%,两者差异有统计学意义(t=3.215,P=0.032), 见图4A。Transwell试验显示,SKOV-3-miR-9细 胞在24 h后穿过上室的细胞均数为120.33个/孔, 对照组为6个/孔,差异有统计学意义(t=13.527, P=0.000),见图4B。
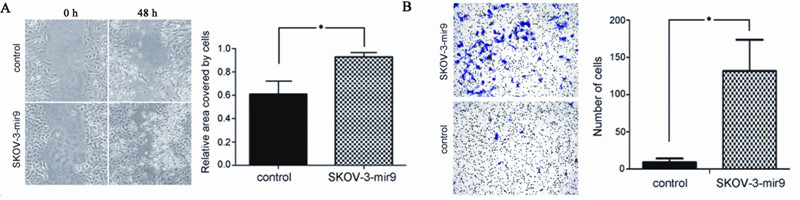 | 图4 上调miR-9促进卵巢癌细胞的运动和侵袭能力 Figure 4 miR-9 upregulation promotes migration and invasion of SKOV-3 cell A: wound healing test of miR-9 mimic or miR control transfected SKOV-3 cells;B: transwell invasion assay of miR-9 mimic or miR control transfected SKOV-3 cells; *: P<0.05 |
在包括卵巢癌在内的很多肿瘤组织,尤其是 在转移灶中,都发现E-cadherin的异常表达,提示 E-cadherin的表达情况与肿瘤转移及远期预后密切 相关[13, 14, 15]。作为EMT的关键分子,E-cadherin异常 表达可能受多种机制调控,如启动子甲基化、基 因突变等,还有研究表明miR-200家族等miRNA也 参与了EMT过程中E-cadherin的调控[16, 17]。因此针 对靶向E-cadherin的miRNA的深入探索,对于揭示 肿瘤转移的分子机制和研究抗肿瘤转移药物靶点 有重要意义。本文证明了miR-9可以通过负向调控 E-cadherin表达,诱导卵巢癌细胞的EMT进程,进 而促进卵巢癌细胞的运动和侵袭能力,并可以进 一步推测,miR-9的表达高低对卵巢癌的转移和预 后具有重要影响。这为卵巢癌EMT过程的信号通 路和分子机制的研究提供了依据,为如何抑制癌 细胞转移的卵巢癌靶向治疗提供了新的思路。
miR-9在多种肿瘤中被证实为肿瘤相关miRNA, 可以影响不同的肿瘤细胞的生长、转移或耐药 等。Iorio等[18]研究发现,与癌旁的正常乳腺组织 相比,乳腺癌组织中存在miR-9的高表达;在人 神经胶质瘤中,也报道高表达的miR-9通过调控 Chromobox 7(CBX7)参与胶质瘤的发生发展 [19]。 然而对miR-9的表达水平与肿瘤的关系,研究者 们也有不一致的看法。Laios等[20]发现,miR-9的 低表达能通过通过调控bcl-2,CLDN等诱导卵巢 癌的化疗耐药。由于miRNA和其靶基因作用关系 网络复杂,一个miRNA可以调控多个靶基因,一 个靶基因可以被多个miRNA调控,形成复杂的反 馈调节关系,因此推测miR-9不仅可以通过调控 E-cadherin进而诱导卵巢癌细胞EMT进程,促进侵 袭转移能力,还有可能通过其他的作用靶点来影 响卵巢癌细胞的生长、耐药等其他恶性生物学行 为。如何更全面地阐明肿瘤相关miRNA在卵巢癌 发生发展中的作用,仍需进一步探索。
| [1] | Colombo N, Van Gorp T, Parma G, et al. Ovarian cancer[J]. Crit Rev Oncol Hematol, 2006, 60(2):159-79. |
| [2] | López-Novoa JM, Nieto MA. Inflammation and EMT: an alliance towards organ fibrosis and cancer progression[J]. EMBO Mol Med, 2009, 1(6-7):303-14. |
| [3] | Thiery JP. Epithelial-mesenchymal transitions in tumour progression[J]. Nat Rev Cancer, 2002,2(6):442-54. |
| [4] | Ahmed N, Thompson EW, Quinn MA. Epithelial-mesenchymal interconversions in normal ovarian surface epithelium and ovarian carcinomas: an exception to the norm[J]. J Cell Physiol, 2007, 213(3):581-8. |
| [5] | Cipollone JA, Graves ML, K?bel M, et al. The anti-adhesive mucin podocalyxin may help initiate the transperitoneal metastasis of high grade serous ovarian carcinoma[J]. Clin Exp Metastasis, 2012, 29(3):239-52. |
| [6] | Shah PP, Kakar SS. Pituitary tumor transforming gene induces epithelial to mesenchymal transition by regulation of Twist, Snail, Slug, and E-cadherin[J]. Cancer Lett, 2011, 311(1):66-76. |
| [7] | Yu L, Li HZ, Lu SM, et al. Down-regulation of TWIST decreases migration and invasion of laryngeal carcinoma Hep-2 cells by regulating the E-cadherin, N-cadherin expression[J]. J Cancer Res Clin Oncol, 2011, 137(10):1487-93. |
| [8] | Davis-Dusenbery BN, Hata A. MicroRNA in cancer: the involvement of aberrant MicroRNA biogenesis regulatory pathways[J]. Genes Cancer, 2010,1(11):1100-14. |
| [9] | Gregory RI, Shiekhattar R. MicroRNA biogenesis and cancer[J]. Cancer Res, 2005, 65(9):3509-12. |
| [10] | Valencia-Sanchez MA, Liu J, Hannon GJ, et al. Control of translation and mRNA degradation by miRNAs and siRNAs[J]. Genes Dev, 2006, 20(5):515-24. |
| [11] | Wang HB, Zhang HJ, Su JM,et al. Epithelial-mesenchymal transition (EMT) and its effect on microRNA expression in lung cancer[J]. Zhonghua Zhong Liu Za Zhi, 2011, 33(8):590-3.[王海兵,张慧君,苏晋梅,等. 肺癌A549细胞上皮-间质转化及其对微小RNA表达的影响[J].中华肿瘤杂志, 2011, 33(8):590-3.] |
| [12] | Bryant JL, Britson J, Balko JM, et al. A microRNA gene expression signature predicts response to erlotinib in epithelial cancer cell lines and targets EMT[J]. Br J Cancer, 2012, 106(1):148-56. |
| [13] | Ho CM, Cheng WF, Lin MC, et al. Prognostic and predictive values of E-cadherin for patients of ovarian clear cell adenocarcinoma[J]. Int J Gynecol Cancer, 2010, 20(9):1490-7. |
| [14] | Huang KJ, Sui LH. The relevance and role of vascular endothelial growth factor C, matrix metalloproteinase-2 and E-cadherin in epithelial ovarian cancer[J]. Med Oncol, 2012, 29(1):318-23. |
| [15] | Koensgen D, Freitag C, Klaman I, et al. Expression and localization of e-cadherin in epithelial ovarian cancer[J]. Anticancer Res, 2010,30(7):2525-30. |
| [16] | Li Y, VandenBoom TG 2nd, Kong D, et al. Up-regulation of miR-200 and let-7 by natural agents leads to the reversal of epithelial-to-mesenchymal transition in gemcitabine-resistant pancreatic cancer cells[J]. Cancer Res, 2009, 69(16):6704-12. |
| [17] | Schickel R, Park SM, Murmann AE,et al. miR-200c regulates induction of apoptosis through CD95 by targeting FAP-1[J]. Mol Cell, 2010, 38(6):908-15. |
| [18] | Iorio MV, Ferracin M, Liu CG, et al. MicroRNA gene expression deregulation in human breast cancer[J]. Cancer Res, 2005, 65(16):7065-70. |
| [19] | Chao TF, Zhang Y, Yan XQ,et al. MiR-9 regulates the expression of CBX7 in human glioma [J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2008, 30(3):268-74.[晁腾飞,张瑜,颜兴起,等. MiR-9在人神经胶质瘤中调节CBX7的表达[J].中国医学科学院学报, 2008, 30(3):268-74.] |
| [20] | Laios A, O’Toole S, Flavin R, et al. Potential role of miR-9 and miR-223 in recurrent ovarian cancer[J]. Mol Cancer, 2008, 7:35. |
 2014, Vol.41
2014, Vol.41



