2.广州中医药大学第一附属医院呼吸内科;
3.中山大学孙逸仙纪念医院南院区急诊科
2. Department of Respiration, First Affiliated Hospital of Guangzhou University of Chinese Medicine;
3. Department of Emergency,Sun Yat-Sen Memorial Hospital, Sun Yat-Sen University
关于恶性胸膜肿瘤导致胸水的原因,常认为 与肿瘤组织的水液通透性增加有关,具体机制尚 未完全明了。水通道蛋白是一组与水通透性有关 的细胞膜转运蛋白,水通道蛋白1 (aquaporin-1, AQP1)是参与肺部水液转运功能蛋白中最为重 要的一种,广泛表达于肺泡Ⅱ型上皮细胞、支气 管黏膜下腺及气管腔上皮细胞顶膜面[1, 2]。它在肺 部的多项生理功能中起着重要的作用,与肿瘤的 发生、发展有密切的关系[3, 4],在肺癌组织内, AQP1 的表达明显增强,应用AQP1抑制剂可以抑 制肺癌的侵袭和转移[5, 6]。一些学者发现,水通道 蛋白参与了肿瘤组织的构建[3],水通道蛋白可以促 进肿瘤的增殖[7, 8]。而检测某种水通道蛋白的水平 可以协助鉴别或诊断一些肿瘤性的疾病[4]。已有研 究发现,AQP1与肺癌细胞对组织的侵袭有关[9], 同时,它与肺腺癌和肺部间皮瘤的发生也有一定 关系[10],一些研究发现:水通道蛋白与非小细胞 肺癌关系密切[10, 11, 12, 13],此外,它还参与了肺部肿瘤 细胞的迁移,对周围组织造成了影响[14],肺腺癌 的发生、发展也与水通道蛋白的关系极为密切。 因此,水通道蛋白与呼吸系统肿瘤有着密切的关系。然而,关于AQP1与胸膜肿瘤关系的研究却鲜 见报道。为揭示在胸膜恶性肿瘤的进展中AQP1的 作用及两者间的关系,我们进行了这一研究,希 x望能为胸膜恶性肿瘤的治疗提供新思路。
1 材料和方法 1.1 动物分组采用C57BL/6J品系小鼠,由广州医学院动物 实验中心提供,鼠龄6~8周,体重约25 g,雌雄不 限。分三组(T6,T8,T10),每组7只,各组设立 正常对照,分别于注射肿瘤细胞6、8、10天后处 死小鼠,肿瘤细胞来源于广州市第一人民医院中 心实验室。
1.2 胸膜恶性肿瘤模型的制备培养Lewi's肺癌细胞,之后加入PBS配制细胞 悬液(浓度调至1×106/ml),乙醚麻醉小鼠后仰卧 位固定,消毒后,采用1 ml注射器和5号针头,吸 取细胞悬液0.05 ml,于小鼠右侧腋前线剑突水平 进针,针头斜向上与胸壁约成30°角,有落空感后 停针注射。对照组小鼠在右侧胸腔接受注入等量 的0.9%氯化钠溶液。
1.3 实验器材低温离心机,核酸-微量蛋白测定仪,电泳 仪,ABI 7500全自动荧光定量PCR仪,A高通量 DNA合成仪,彩色病理图像免疫组织化学测量系 统,CO2培养箱,胎牛血清,DMEM培养液粉剂, DAB试剂盒(DAKO公司),兔抗鼠AQP1 多克隆 抗体(Santa Cruz公司),辣根过氧化物酶标记的 抗兔Envision多聚物(Santa cruz公司)。
1.4 标本采集取胸水:过量麻醉处死小鼠,仰卧位固定 好,沿胸骨中线小心剪开胸壁,避免破坏膈肌, 暴露胸膜腔,记录肿瘤生长情况及胸水性状,以 1 ml注射器收集胸腔内液体并记量。取胸膜组织: 剪下小鼠胸壁,固定于板上,以手术尖刀小心切 割壁层胸膜,分别放于-80℃冰箱及多聚甲醛液体 中保存。
1.5 标本检测 1.5.1 免疫组织化学法测壁层胸膜AQP1水平胸 膜标本经固定、脱水、透明、浸蜡后,进行包 埋、切片,脱蜡至水。经水浴、TBS洗、抗原修 后,顺序加入一抗、二抗,经DAB显色、苏木精 染色后,用二甲苯透明、风干。用中性树胶封片 保存。胸膜上皮细胞内的AQP1阳性显色后,呈现 为亮棕色,颜色深浅与其水平呈正相关,以PBS 代替一抗作为阴性对照,之后采用HPISA210000 彩色病理图像免疫组织化学测量系统进行图像分 析,测量AQP1表达的平均灰度值。
1.5.2 实时荧光定量PCR法测定壁层胸膜AQP1- mRNA在EP管中加入Trizol酶1 ml,加50~100 mg胸膜组织,将组织彻底匀浆溶解,经水浴、氯 仿混匀、冷冻离心后,取液相,加0.5 ml异丙醇, 混匀后静置10 min,冷冻离心后弃上清液,加乙醇 混匀后4℃离心,弃上清液,干燥后加DEPC水浴。 取RNA样品,用紫外分光光度仪分别于A260、 A280处比色,求A260/A280比值。RNA浓度=A260 值×40 μg/ml ×250。采用Invitrogen反转录试剂盒, 以Oligo(dT)18为引物,按照试剂盒要求进行反转 录,之后保存于-20℃备用。根据NCBI Genebank 中的小鼠AQP1基因序列进行引物设计,采用 Primer express 2.0 软件,设计序列如下
M-AQP1(92 bp)
Forward Primer: 5’-CTA CAC TGG CTG CGG TAT CAA C-3’
Reverse Primer: 5’-GCC CCA CCC AGA AAA TCC-3’
内参序列:M-GAPDH(73 bp)
Forward Primer: 5’-CGT GTT CCT ACC CCC AAT GT-3’
Reverse Primer: 5’-TGT CAT CAT ACT TGG CAG GTT TCT-3’
委托达安基因公司合成引物,实时荧光定量 PCR 反应体系在ABI 3900 Real-time PCR 仪上进 行,PCR扩增共40循环,在每个循环的第二个步 骤收集荧光信号,采用比较2-ΔΔCt法。结果按拷贝 数分析,用B表示,即B=拷贝数/μl cDNA。考虑 到各个样本总RNA浓度的差异,最终计算结果按 下列公式换算:A = B(目的基因)/B(内参基 因),A值是统计时最终需要的数值。
1.6 统计学方法全部数据采用SPSS11.0医用统计软件进行分 析,计量资料用均数±标准差表示,组间比较采用t检 验(student’s t-test)。P<0.05为差异有统计学意义。
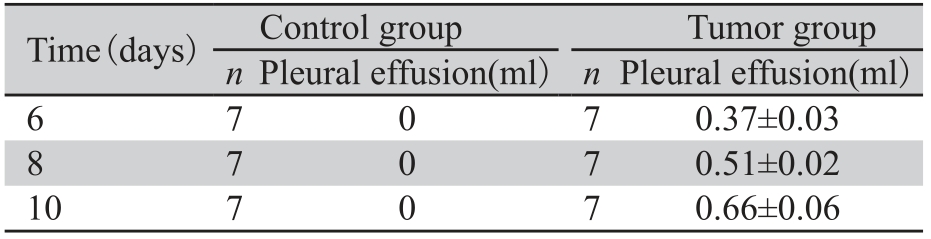
2 结果 2.1 各组小鼠情况各对照组小鼠无死亡,解剖胸腔发现内壁光 滑,未发现胸腔积液;胸膜恶性肿瘤组21只鼠无 死亡,均可见血性胸腔积液,位于右侧胸膜腔, 其中17只可见白色肿瘤结节,见图 1A。壁层胸膜石蜡切片的HE染色可见肿瘤细胞侵袭壁层胸膜, 癌细胞排列紧密,间质结缔组织少,新生毛细血 管丰富,见图 1B。解剖胸腔可见右侧胸膜腔存在 血性胸腔积液,随着肿瘤在胸膜腔内种植时间的 延长,胸水量从6天时的(0.37±0.03)ml增加到10 天时的(0.66±0.06)ml (P=0.04),见表1。
|
图 1 Lewi's lung cancer cell(LLC)注入C57BL/6J小鼠 胸膜腔后8天肉眼观(A)及镜下组织学形态(B) Figure 1Histological changes of pleural cavity by naked eyes(A) and of partial pleural under microscope(B) after LLC cell was injected for 8 days A:the Lewi's lung cancer cells suspension(1×106/L) was injected into C57BL/6J mice’s right pleural cavity for 8 days,bloody pleural fl uid was observed and there was round white visible tumor growth on partial pleura; B: We could observe the growth and infi ltration of tumor cell in partial pleura(HE staining 20×10) |
|
|
表1 5-Fu血药浓度与化疗不良反应的相关情况 Table 1 Correlation between 5-Fu concentration and adverse events |
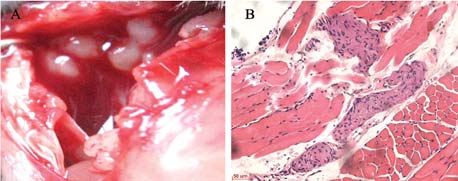
AQP1表达于胸膜壁层间皮细胞,经免疫组 织化学染色并测定平均灰度值,胸膜恶性肿瘤组 小鼠壁层胸膜AQP1表达较对照组明显增强,见 图 2。对照组小鼠的AQP1平均灰度在6、8、10 天分别为(0.20±0.03)、(0.17±0.04)、(0.20 ±0.04),组间差异无统计学意义(P>0.08)。胸 膜恶性肿瘤组小鼠AQP1平均灰度在6、8、10天 分别为(0.42±0.03)、(0.58±0.05)、(0.65± 0.05),各组差异有统计学意义(P=0.03)。胸膜 恶性肿瘤组小鼠AQP1水平较相应天数的对照组小 鼠高,差别有统计学意义(P<0.02),见图 2、3。
|
图 2 壁层胸膜水通道蛋白1的表达 Figure 2The level of AQP1 of partial plural *:compared with T6 group(the Tumor group which was injected LLC cells for 6 days),P<0.05; #:compared with T8 group(the Tumor group which was injected LLC cells for 8 days),P<0.001;a:compared with control group,P<0.01 |

|
图 3 壁层胸膜的免疫组织化学染色结果( ×40) Figure 3Immunohistochemistry staining of partial pleura (×40) A:control group; B:T10 group |
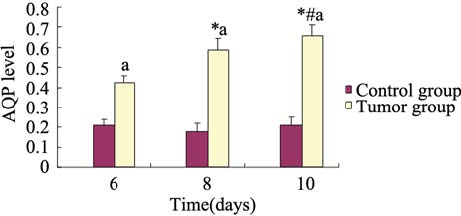
AQP1基因与管家基因的PCR标准曲线斜率 接近,经检验其相关系数r=0.970,两种基因扩 增效率一致。对照组小鼠AQP1-mRNA的相对 值在6、8、10天分别为(1.05±0.12)、(1.19±0.12)、(1.02±0.18),组间差异无统计学 意义(P=0.06)。胸膜恶性肿瘤组小鼠AQP1- mRNA的相对值在6、8、10天分别为3.04±0.27、 3.87±0.28、4.95±0.54,各组差异有统计学意义 (P=0.01)。胸膜恶性肿瘤组小鼠AQP1-mRNA的 相对值较相应天数的对照组小鼠高,差别有统计 学意义(P=0.04),见图 4。
|
图 4 壁层胸膜AQP1-mRNA表达 Figure 4 The level of AQP1-mRNA of partial plural *:P<0.05,vs. T6 group; #:P<0.001,vs. T8 group; a:P<0.01,vs. control group |
经直线相关分析,T6、T8、T10组胸水量 与AQP1的表达存在正相关关系(r=0.97,r=0.92, r=0.98),与AQP1mRNA的表达也存在正相关关系 (r=0.93,r=0.96,r=0.94)。
3 讨论呼吸系统恶性肿瘤在临床上极为常见,随着 我国人口老龄化加剧、生活环境的污染,以及吸 烟人口的增加,呼吸系统肿瘤的发病率急剧增 多,发病率上升极快。然而,在呼吸系统肿瘤 中,胸膜恶性肿瘤相对少见,但其发展迅速,出 现恶性胸腔积液较早,常常造成严重的呼吸困难 和循环障碍,危及生命。因而,积极研究其发生 机制是进一步治疗胸膜恶性肿瘤的前提和基础。 然而,由于胸膜恶性肿瘤的病因、发病机制及病 理变化十分复杂,有多种因素的参与,相关研究 相对较少,尤其是关于发生机制这一方面。
AQP1是第一个被发现的水通道蛋白,广泛 分布于肺部,在其水液转运中起着极其重要的作 用,它与肿瘤的发生有一定的关系。众所周知, 在肿瘤的发生发展过程中,癌细胞增殖、分裂的 速度较正常组织细胞大大加快。同时,为了满足 肿瘤侵袭转移的需要,癌细胞某些酶的活性和表 达也发生了改变,进而使细胞蛋白质、核酸的合 成加强,而所有这些生命活动都离不开水的微环 境和参与。因而,癌细胞比正常细胞更需要水分 子的快速跨膜转运。这是水通道蛋白参与胸膜恶 性肿瘤构建的理论基础。
一些学者已在此方面进行了一定的研究,并 有所发现。在乳腺癌和恶性胶质瘤中,水通道蛋 白1的表达都发生了改变,据此,有人设想可将 其用于肿瘤的协助诊断[4]。水通道蛋白1参与了肺 癌的进展和侵袭,促进了肿瘤的增殖[7, 8, 14] ,而运 用AQPs的抑制剂则可以部分抑制肺癌的侵袭和转 移。水通道蛋白在肿瘤中的作用,已越来越受到 大家的关注。然而,关于胸膜恶性肿瘤与水通道 蛋白关系的研究,却未见报道。
鉴于临床胸膜恶性肿瘤患者标本收集难度较 大,时间较长,我们先进行了动物研究,建立了 胸膜恶性肿瘤的动物模型,在不同时间点检测壁 层胸膜AQP1在蛋白和mRNA水平的表达,发现随 着胸膜恶性肿瘤的进展,肿瘤小鼠的恶性胸腔积 液量增加,同时,壁层胸膜AQP1及其mRNA的表 达明显增加,胸水量与AQP1水平亦呈正相关关 系。根据实验结果,我们认为AQP1参与了胸膜恶性肿瘤的进展。这与既往的研究结果并不矛盾, 并从分子生物学层面,部分揭示了胸膜恶性肿瘤 发生、发展的机制,希望能为进一步研究、治疗 胸膜恶性肿瘤提供一定的帮助。同时也提示我 们:在临床对胸膜恶性肿瘤的治疗中,发掘相应 的AQP1阻断剂、抑制剂来影响其生物学效应,有 可能是治疗胸膜恶性肿瘤的一个新途径。
| [1] | Dender BM,Smith BL,Kuhajda FP,et al. Identifi cation, purifi cationand partial characterization of a novel Mr 28,000 integralmembrane protein from erythrocytes and renal tubules[J]. J BiolChem,1988,263(30):15634-42. |
| [2] | Agre P,Sasaki S,Chrispeels MJ. Aquaporins: a family of waterchannel proteins[J].Am J Physiol,1993,265(3):455-61. |
| [3] | Endo M, Jain RK, Witwer B, et al. Water channel expressionand distribution in mammary carcinomas and glioblastomas[J].Microvasc Res,1999,58(2) :89-98. |
| [4] | Verkman AS. Physiological importance of aquaporin waterchannels[J]. Ann Med,2002,34(3): 192-200. |
| [5] | Xiang Y,Ma B,Li T,et al.Acetazolamide suppresses tumormetastasis and related protein expression in mice bearing Lewislung carcinoma[J]. Acta Pharmacol Sin, 2002, 23(8):745-51. |
| [6] | Ma B, Xiang Y Li T,et al. Inhibitory effect of topiramate on Lewislung carcinoma metastatic and its relation with AQP1 waterchannel[J]. Acta Pharmacol Sin, 2004, 25(1):54-60. |
| [7] | Saadoun S, Papadopoulos MS,Davies DC,et al. Increasedaquaporin 1 water channel expression in human brain tumours[J].Br J Cancer, 2002, 87(6) :621-3. |
| [8] | Saadoun S, Papadopoulos MS,Davies DC,et al. Aquaporin-4expression is increased in oedematous human brain tumours[J].JNeurol Neurosurg Psychiatry, 2002, 72(2) :262-5. |
| [9] | Xie Y, Wen X, Jiang Z, et al. Aquaporin 1 and aquaporin 4 areinvolved in invasion of lung cancer cells[J]. Clin Lab, 2012,58(1-2):75-80. |
| [10] | López-Campos JL, Sánchez Silva R, Gómez Izquierdo L, et al.Overexpression of Aquaporin-1 in lung adenocarcinomas andpleural mesotheliomas[J].Histol Histopathol,2011,26(4):451-9. |
| [11] | Li BL, Jin L, Zhong K,et al.Correlation of aquaporin 3 expressionwith the clinicopathologic characteristics of non-small cell lungcancer[J].Zhongguo Fei Ai Za Zhi,2012,15(7):404-8.[李白翎,金磊,钟铿,等. 水通道蛋白3在非小细胞肺癌中的表达及与临床病理相关性的研究[J].中国肺癌杂志,2012,15(7):404-8.] |
| [12] | Warth A, Muley T, Meister M, et al. Loss of aquaporin-4expression and putative function in non-small cell lung cancer[J].BMC Cancer,2011,11:161. |
| [13] | Jarius S, Warth A, Wandinger KP, et al. Antibodies to aquaporin-4in non-small cell lung cancer: a study on 50 patients [J].NeurolSci, 2010,31(6):871-2. |
| [14] | Machida Y, Ueda Y, Shimasaki M, et al. Relationship ofaquaporin 1, 3, and 5 expression in lung cancer cells to cellulardifferentiation, invasive growth, and metastasis potential[J].HumPathol, 2011,42(5):669-78. |
 2014, Vol.41
2014, Vol.41