2.中山大学药学院微生物与生化药学实验室
2.Department of Microbial and Biochemical Pharmacy, School of Pharmaceutical Science,Sun Yat-sen University
肿瘤和间质之间的相互作用是肿瘤发生侵袭 和转移的重要条件。肿瘤可分泌多种因子诱导间 质细胞活化,而活化的间质细胞又通过分泌细胞 因子和基质蛋白酶等促进肿瘤的增殖、浸润与转 移[1]。此外,相对于肿瘤细胞容易突变产生抗肿瘤 药物的耐药性,间质细胞还具有基因型相对稳定 的特质,因此选择这群细胞表面抗原为靶标,进 而切断间质对肿瘤细胞的支持促进作用,不失为 一种富有前景的肿瘤免疫治疗策略。
成纤维细胞激活蛋白α(fibroblast activation protein α,FAPα)是高表达于肿瘤间质成纤维细 胞表面的特异性标志物。FAPα是一种丝氨酸蛋白 酶,具有胶原酶和二肽酶的活性,通过参与肿瘤-宿主界面基质的降解和重建,对肿瘤的生长、浸 润和转移具有重要意义[2, 3]。近年来,FAPα作为一 种极具潜力的抗肿瘤靶标分子正备受关注。这是 因为:(1) FAPα在90%以上的上皮性肿瘤间质细胞 中恒定表达,正常组织仅限于胚胎及愈合创口; (2) FAPα阳性的间质细胞构成了50%~ 95%肿瘤基 质成分,靶位十分丰富;(3) FAPα阳性间质细胞主 要分布于肿瘤血管周围,这为以FAPα为靶标的肿 瘤免疫治疗能够有效阻断肿瘤组织血液供应提供了有利条件[4, 5]。在前期实验中,通过分子克隆的 方法我们制备了来源于FAPα的多肽FAPτ。本研 究重点探讨FAP?τ的抗肿瘤活性。 1 材料与方法 1.1 实验动物和试剂
SPF级4~6周龄BalB/c雌鼠,购自中山大学实验 动物中心,动物生产许可证[SCSK(粤)2004-0011]。 RPMI 1640,FCS购自美国Gibco公司;PECD8单抗、抗小鼠IFN-γ抗体、FITC-IgG二抗、 细胞固定穿孔试剂均购自美国Beckman Coulter 公司;HRP-二抗购自博士德;氟氏不完全佐剂 (FICA)、IL-2、BSA 购自美国Sigma公司;其余主 要化学试剂均为国产分析纯试剂。 1.2 SDS-PAGE 检测FAPτ纯度
取FAPτ结晶10 μg,3% SDS溶解,12% SDSPAGE分离,经考马斯亮蓝染色后观察其条带。 1.3 小鼠免疫及肿瘤测量
小鼠免疫及肿瘤测量方法见参考文献[6]。 1.3.1 疫苗制备
将FAPτ在PBS中充分研磨,加 入同体积FICA乳化均匀,每只小鼠0.2 ml。PBS对 照组则没有FAPτ,制备方法同上。 1.3.2 实验分组及动物免疫
BalB/c小鼠20只,随 机分为2组,每组10只,分别为:PBS对照组,FAPτ 免疫组。首次免疫FAPτ 每只300 μg,加强免疫使 用半量。各组动物分别于第1、14、21天时进行背部 皮下多点免疫,见图1。第2、3次均为加强免疫。
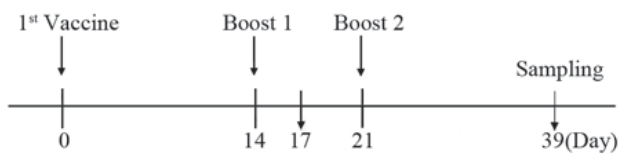 | 图1 小鼠肿瘤接种及免疫时限表Figure 1TTumor implantation and immune time table |
小鼠第二次免疫3天后,于 左侧第四对乳腺脂肪垫处,以105/100 μl的体积接种 4T1肿瘤细胞。当肿瘤长径达到3 mm以上时测其长径 a和短径b,按v=1/2ab 2算出肿瘤体积,绘制肿瘤体积 变化曲线并记录小鼠死亡情况。当小鼠肿瘤体积超过 3 000 mm 3时将小鼠颈椎脱臼法处死,结束实验。 1.4 小鼠血清中FAPτ抗体滴度检测 1.4.1 小鼠血清制备
肿瘤接种后22天,各组小鼠经尾 静脉取血200 μl左右离心,取上层血清,4℃放置备用。 1.4.2 间接ELISA法检测小鼠血清中抗体滴度
以 每孔50 ng FAPτ包被ELISA板,4℃过夜;2% BSA 4℃封闭过夜;被检血清以1∶1000依次倍比 稀释,37℃孵育1 h;HRP标记二抗1∶8 000稀释,室温孵育1 h;每孔0.2 ml TMB溶液室温避光作用 30 min;2 M H2SO4终止反应;酶标仪450 nm处测 定显色反应结果。 1.5 小鼠脾脏淋巴细胞制备及流式细胞仪检测
肿瘤接种后22天,取小鼠脾脏,制成单细胞 悬液,NH4Cl裂解去除红细胞,用含10%FBS的 RPMI1640培养液重悬,CO2 孵箱内培养。FAPτ5 μg/ml体外再次刺激,同时加入IL-2 300 u/ml,72 h 后,收集细胞,并分别孵育以下抗体,PE-CD8单 抗,抗小鼠IFN-γ 抗体,FITC-IgG二抗,行流式细胞 仪检测。 1.6 统计学方法
用统计软件SPSS 13.0对结果进行双尾t检验分 析,P< 0.05为差异有统计学意义。 2 结果 2.1 FAPτ纯度检测
FAPτ行SDS-PAGE分离并经考马斯亮蓝染色后显 示,其纯度达90% 以上,足可用于下一步实验,见图2。
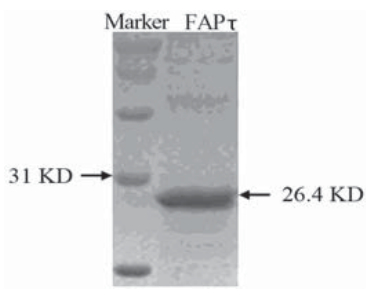 | 图2 FAPτ经SDS-PAGE分离结果示意图Figure 2FAPτ polypeptide detected by SDS-PAGE |
在肿瘤接种后30天内,FAPτ疫苗免疫组小鼠肿瘤 生长速度显著低于PBS对照组,其差异具有统计学意 义(P= 0.027),见图3。小鼠存活率记录曲线显示,FAPτ 疫苗免疫组小鼠存活率较PBS对照组高,见图4。
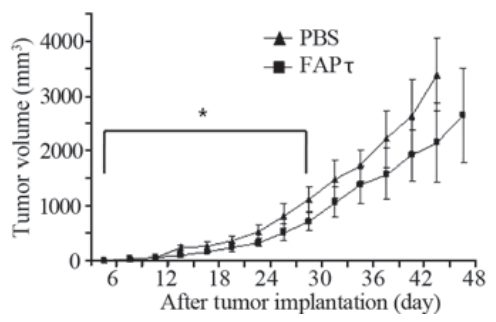 | 图3两组小鼠的肿瘤体积变化图Figure 3Changes of tumor volume of two groups |
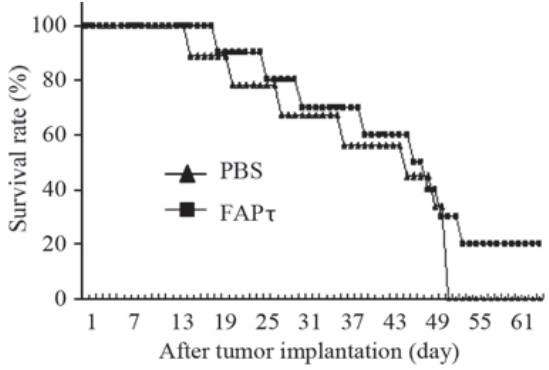 | 图4荷瘤小鼠存活率示意图Figure 4Survival rate of tumor-bearing mice treated during experiment |
结果显示,与PBS对照组相比,FAPτ免疫组 血清检测到较高滴度的抗体产生,见图5。
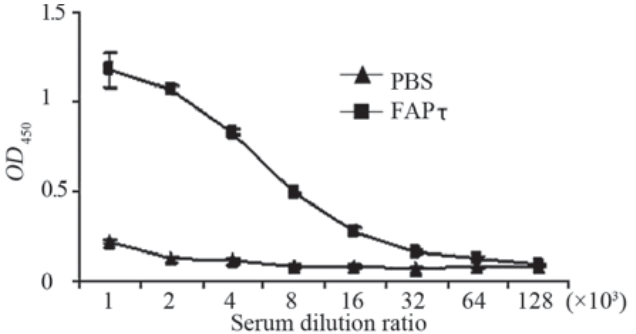 | 图5ELISA检测小鼠血清中FAPτ特异性抗体滴度Figure 5FAPτspecific antibody titer in murine serum detected by ELISA |
结果显示,在FAPτ免疫组小鼠脾脏内检测到 约5.73%的CD8+T细胞表达IFN-γ,而PBS 对照组 约1.33%的CD8+T 细胞表达IFN-γ,见图6。
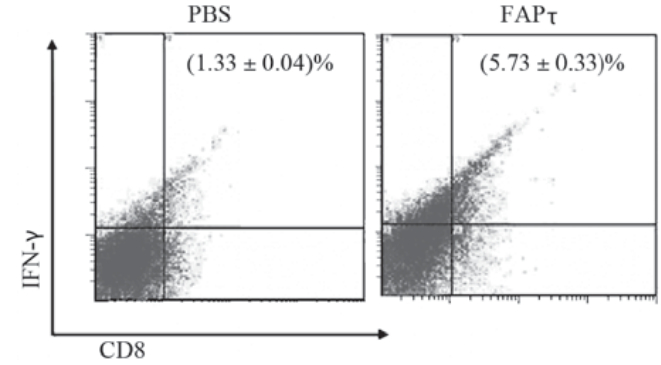 | 图6流式细胞仪检测小鼠脾脏CD8+T细胞内IFN- γ表达水平Figure 6IFN-γ expression in splenic CD8+T cells detected by flow cytometer |
目前以FAPα为基础的肿瘤疫苗大多是选取 FAPα全部氨基酸序列或其膜外蛋白区域的氨基酸 序列,其抗原体积较大,抗原表位过多容易引发 机体的非特异性免疫应答。与大分子蛋白相比,小分子多肽具有诱发高度特异性免疫反应,毒性 小和成本低,制备简易,便于商业化等优势[7]。因此,我们选取了FAPα ?内富含T细胞表位的多肽 FAPτ,研究其抗肿瘤效应。
Lee等[8]证实FAP?α表达于小鼠乳腺癌肿瘤间 质,在细胞株内不表达。本实验室也证实了同样 的结果,因此,选择4Τ1乳腺癌作为肿瘤模型。 实验证实,在小鼠肿瘤接种后6~30天FAPτ 疫苗 能够显著降低小鼠肿瘤生长速度,显示出较强的 抗肿瘤作用;然而,肿瘤接种30天后,FAPτ 疫 苗免疫组小鼠肿瘤生长速度与对照组差异逐渐变 小(图3),究其原因如下:从30天到实验记录 结束,由于小鼠的死亡逐渐增加,致使样本数减 少,每组小鼠间肿瘤体积误差增大;其次,随着 免疫时限的延长,免疫效价逐渐降低,加之FAPα 在4T1乳腺癌内表达丰度不高及4Τ1肿瘤的高侵袭 能力,导致两组间差异变小。
Loeffler等[9]构建了FAPαDNA口服疫苗,该疫 苗显著增加了肿瘤组织对化疗药物的摄取量,抑制 了肿瘤生长并延长了荷瘤小鼠的存活时间。该组[10] 进一步利用4T1乳腺癌小鼠模型证实FAPαDNA疫 苗对肿瘤的生长和转移的抑制作用主要是通过调节 肿瘤免疫微环境中的极性,即促进肿瘤组织内Th2 细胞向Th1细胞的转化来实现的。然而,在肿瘤杀 伤过程中起主导作用的是CD8 +T细胞。肿瘤免疫治 疗策略主要以激活CD8+T细胞免疫应答为中心,特 别是诱生肿瘤特异性的CTL [11]。本研究组制备的抗 原为不溶性颗粒抗原,在体内主要激活CD8+T细 胞,因此,除了体液免疫应答外,我们重点检测了 CD8+T细胞免疫应答,并证实FAPτ?免疫组较对照 组能够显著激活CD8+T细胞应答。
| [1] | Mueller M, Fusenig NE. Friends or foes - bipolar effects of the tumour stroma in cancer [J]. Nat Rev Cancer, 2004, 4(11): 839-49. |
| [2] | Chen WT, Kelly T. Seprase complexes in cellular invasiveness[J]. Cancer Metastasis Rev, 2003, 22(2-3): 259-69. |
| [3] | Acharya PS, Zukas A, Chandan V, et al. Fibroblast activation protein: a serine protease expressed at the remodeling interface in idiopathic pulmonary fibrosis[J]. Hum Pathol, 2006, 37(3): 352-60. |
| [4] | Monsky W, Lin C, Aoyama A, et al. A potential marker protease of invasiveness, seprase, is localized on invadopodia of human malignant melanoma cells[J]. Cancer Res, 1994, 54(21): 5702-10. |
| [5] | Garin-Chesa P,Old LJ,Rettig WJ.Cell surface glycoprotein of reactive stromal fibroblasts as a potential antibody target in human epithelial cancers[J].Proc Natl Acad Sci USA,1990,87(18): 7235-9. |
| [6] | Zeng J, Cai S, Yi Y, et al. Prevention of spontaneous tumor development in a ret transgenic mouse model by ret peptide vaccination with indoleamine 2,3-dioxygenase inhibitor 1-methyl tryptophan[J]. Cancer Res, 2009, 69(9): 3963-70. |
| [7] | Offringa R, van der Burg SH, Ossendorp F, et al. Design and evaluation of antigen-specific vaccination strategies against cancer[J]. Curr Opin Immunol, 2000, 12(5): 576-82. |
| [8] | Lee J, Fassnacht M, Nair S, et al. Tumor immunotherapy targeting fibroblast activation protein, a product expressed in tumorassociated fibroblasts[J]. Cancer Res, 2005, 65(23): 11156-63. |
| [9] | Loeffler M, Krüger JA, Niethammer AG, et al. Targeting tumor-associated fibroblasts improves cancer chemotherapy by increasing intratumoral drug uptake[J]. J Clin Invest, 2006,116(7):1955-62. |
| [10] | Liao D, Luo Y, Markowitz D, et al. Cancer associated fibroblast promote tumor growth and metastasis by modulating the tumor immune microenvironment in a 4T1 murine breast cancer model[J]. PLoS One, 2009,4(11):e7965. |
| [11] | Rosenberg SA, Yang JC, Restifo NP. Cancer immunotherapy: moving beyond current vaccines[J].Nat Med, 2004, 10(9): 909-15. |
 2014, Vol.41
2014, Vol.41
