乳腺肿瘤是女性的常见肿瘤之一,它的存在严重影响着女性的生存质量和寿命。其发病率也在逐年增加,并且呈年轻化趋势。在对40~49岁女性的尸检研究中发现,大约40%都有初期乳腺癌,但是获得临床诊断的却不足2%[1]。对乳腺肿瘤发生发展的研究有助于尽快攻克这一疾病的诊断难题,也有助于提高患者的治疗效果。近年来研究者发现肿瘤微环境在乳腺肿瘤的发生、发展过程中起到了重要的作用,它影响着肿瘤患者的生存寿命及预后,针对肿瘤微环境治疗的研究也成为了近年来的热点。1 乳腺肿瘤的发生发展与肿瘤微环境
肿瘤可以看作是肿瘤细胞与周围环境失衡的病理状态。乳腺肿瘤是由乳腺导管上皮细胞恶性增生形成的。恶性肿瘤是在宿主肿瘤微环境中产生的,在这个微环境中宿主参与了肿瘤细胞的诱导、选择和发展。侵袭转移是恶性肿瘤的一项重要特征,也是肿瘤致死的最主要原因。乳腺肿瘤可通过血行转移、淋巴管转移等多种转移方式转移到对侧乳腺、骨、肺、脑、区域淋巴结等多个脏器。乳腺癌死亡的最常见的原因是转移性疾病,而不是原发肿瘤。对大量侵袭性乳腺癌患者的研究(invasive breast cancer,IBC)发现其对侧乳房发生肿瘤的风险增加2~3倍,而且乳腺癌患者发生其他器官的继发性肿瘤的危险性也很大[2]。这些观察结果支持了原发性乳腺肿瘤的信号可以促进肿瘤的生长或者其他肿瘤的活动,使对侧乳房或其他器官产生检测不到的肿瘤。此外,尸检研究表明转移癌患者在2~3器官中平均有5.6个转移灶[3]。目前还不清楚转移灶为什么会突然地、同步地出现。
必须强调肿瘤微环境在肿瘤行为中有至关重要的作用,并且能够影响肿瘤患者的临床预后。转移被认为是肿瘤与细胞基质相互作用的多阶段过程,这些过程使得肿瘤具有新生血管的能力,使肿瘤细胞更容易迁移和侵袭到转移部位[4]。乳腺肿瘤易发生区域淋巴结,肺,骨和脑等器官的转移[5]。继发部位的微环境在肿瘤细胞转移过程中起到重要作用。肿瘤细胞需要获得一些特性才能够降解细胞外基质,侵袭入血管,通过血管迁移转移到继发部位,最终形成转移癌巢。由Paget做的前期研究首次阐述了“种子和土壤”假说,该假说说明在循环中的微环境因素及机械力共同决定着特定位点的转移播散。在转移过程中,肿瘤细胞从原发肿瘤中脱离出来,侵袭并侵入血管,进入到局部毛细血管并释放到继发组织。这个假说证实了转移细胞的内在属性(基因和表观遗传改变)及宿主微环境是决定肿瘤细胞转移和传播的重要因素[6]。与原发部位的原发性肿瘤的诱导过程相似,在继发部位肿瘤细胞先局部生长,并且与其他的细胞因子(如趋化因子)相结合,产生肿瘤衍生因子RANTES并促进S100A4的释放,后者可以激活T细胞吸附和T细胞产生炎症细胞因子(granulocyte colony stimulating factor,G-CSF)。这些细胞因子反过来吸引髓细胞到转移前的微环境中加速肿瘤的生长。在转移前的微环境中,随着基质细胞和血管内皮细胞在组织实质中定植,新招募的髓细胞为趋化因子、生长因子、基质降解酶和黏附分子提供一个平台,从而加速形成转移性病灶[7]。2 乳腺肿瘤微环境
微环境的组成包括巨噬细胞、肌上皮细胞、血管内皮细胞、免疫细胞、成纤维细胞、脂肪细胞以及一些细胞外基质(extracellular matrix,ECM)分子,他们已被证实在乳腺导管的发生和形态的维持中发挥着重要的作用[8]。这些组成成分的改变均可导致肿瘤的发生。近年来肿瘤微环境被视为是肿瘤的调节剂并得到了广泛的研究。2.1 肿瘤相关成纤维细胞(cancer associated fi broblasts,CAFs)
GRN(glycoprotein granulin)是由多种细胞型表达的一种表皮生长因子,具有促进细胞增殖、迁移、存活的作用还可以调节炎症反应。我们把能够产生GRN蛋白的成纤维细胞定义为肿瘤相关成纤维细胞(CAFs)[9]。已有实验研究揭示了CAFs可以促进上皮细胞的致瘤性改变,然而正常组织衍生出的成纤维细胞则抑制这种转化[10]。在乳腺癌的发生发展过程中正常的成纤维细胞会向CAFs转化。CAFs可以合成基质金属蛋白酶(metalloproteinases,MMPs)用以降解细胞外基质促进肿瘤侵袭,还可以分泌血管内皮生长因子(vascular endothelial growthfactor,VEGF)促进血管生成。CAFs不仅仅在乳腺肿瘤的发生中促进肿瘤细胞的增殖和恶性转化,还能够影响乳腺肿瘤的免疫抑制和免疫监视促进肿瘤细胞的侵袭和转移[11]。在小鼠模型中共同注射人类成纤维细胞和正常组织或侵袭癌细胞,都会促进肿瘤发展成为侵袭癌的过程[12]。2.2 肿瘤相关炎症细胞
促进肿瘤的炎症细胞包括巨噬细胞,肥大细胞、嗜中性粒细胞及T、B淋巴细胞。这些细胞可以分泌包括表皮生长因子(epidermal growth factor,EGF),血管内皮生长因子(VEGF)和成纤维细胞生长因子-2(fibroblast growth factor-2,FGF2)等细胞因子发挥其促肿瘤作用。创伤后的伤口基本都要经历炎症过程,有研究证实肿瘤可发生在患者烧伤或创伤后的瘢痕组织中[13]。此外,研究还证明,患慢性炎症性疾病的患者会因为活化的炎症细胞释放的细胞因子改变了体内的微环境而增加癌症发生的风险[14]。这些证据都表明炎症细胞在肿瘤的发生发展过程中起着重要的作用。
越来越多的证据表明巨噬细胞可促进原发肿瘤发展成为侵袭型肿瘤。这些证据主要有两个来源:(1) 临床相关数据表明在超过80%的病例中巨噬细胞的浸润程度与预后差相关,包括增加淋巴转移和缩短患者生存期[15]。(2) 在小鼠模型中敲除巨噬细胞相关基因导致了肿瘤生长的抑制并且降低了转移灶的形成率[16]。目前的研究表明巨噬细胞与肿瘤的转移部位有关,而且他们不仅仅在原发肿瘤向转移表型发展的过程中有重要作用而且还在转移灶的形成中起重要作用。这类与肿瘤生长密切相关的巨噬细胞被称为肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)。研究表明乳腺肿瘤中的巨噬细胞密度明显高于正常的乳腺组织[17]。在乳腺肿瘤中TAM参与了增殖、侵袭、血管及淋巴管形成的过程。TAM可以表达表皮生长因子(EGF)、血小板源性生长因子(platelet-derivedgrowth factor,PDGF)、转化生长因子(transforminggrowth factor-β1,TGF-β1)、肝细胞生长因子(hepatocyte growth factor,HGF)及碱性成纤维细胞生长因子(basic fi broblast growth factor,bFGF),这些促生长因子可以刺激乳腺肿瘤细胞的增殖。Qian等[18]提出巨噬细胞在乳腺癌细胞的转移外渗及肺转移和生长中有重要作用。此外TAM还表达巨噬细胞趋化性细胞因子CCL2和VEGF的受体(CCR2和VEGFR1);他们可能是在肿瘤招募过程中起重要作用的信号分子。当肿瘤达到特定的大小这些TAM则提供血管生成因子,VEGF-A和血管生成素,促进血管生成和其他炎症细胞的招募。TAM还分泌一些蛋白酶,这些行为可进一步重塑了细胞外基质(ECM)[19],并导致持续性的转移生长。在乳腺癌中,TAM密度与肿瘤血管密度正相关,提示了在人类乳腺肿瘤中TAM具有血管生成活性,临床研究证实巨噬细胞浸润数量与高肿瘤分级、低雌激素孕激素受体状态及肿瘤细胞的高有丝分裂活性等预后不良信号正相关[20]。值得注意的是,我们常用M-CSF(macrophage-colony stimulating factor)和GM-CSF(granulocyte macrophage-colony stimulatingfactor)来区分外周血单核细胞中的M1样或M2样巨噬细胞[21]。有趣的是,M-CSF激活的巨噬细胞可能帮助肿瘤生长,而经GM-CSF治疗的乳腺癌小鼠则通过启动TAM中的抗肿瘤程序抑制肿瘤的生长和转移[22]。因此构成了这样一个概念,似乎在乳腺肿瘤中M1样巨噬细胞是促肿瘤的,而M2样巨噬细胞则具有抗肿瘤活性。信号转导与转录激活子3(signal transducer and activator of transcription 3,STAT3)是一种负性免疫调节因子,TAM可以通过调节STAT3信号通路调节肿瘤的生长,这可能成为新的治疗靶点。肿瘤与宿主巨噬细胞间的旁分泌信号回路参与了侵袭和转移的过程已经被大家所公认,在乳腺肿瘤中主要是通过肿瘤细胞产生的集落刺激因子(colony-stimulating factor,CSF-1)和巨噬细胞产生的表皮生长因子发挥作用[23]。此外,TAM还通过分泌TNF-α诱导NF-κB和JNK在乳腺肿瘤中的活性从而导致侵袭增加[24]。2.3 肥大细胞
从生理角度来看,肥大细胞参与组织重塑,伤口愈合及血管生成[25]。而在急性疾病、慢性过敏性疾病和自身免疫性疾病中它的出现则是病理表现。病理切片标本发现肥大细胞在乳腺纤维囊性增生及小叶增生的患者中明显增多,这表明肥大细胞与乳腺组织的增生相关[26]。在乳腺肿瘤中也可以发现肥大细胞的浸润,并且研究发现肥大细胞与淋巴管形成相关,可以促进乳腺肿瘤的淋巴道转移[27]。临床研究表明肿瘤浸润肥大细胞的数量与微血管密度的增加有关,它可以增加肿瘤的生长和侵袭导致差临床预后,在肥大细胞缺乏的动物模型中发现肿瘤的转移率降低[28]。肥大细胞可以释放一些介质,这些介质关系到肿瘤微环境的重塑,从而促进肿瘤转移。事实上,肥大细胞同样也可以产生诸如类胰蛋白酶、类糜蛋白酶、MMP9和组织蛋白酶等蛋白酶类,他们通过水解趋化因子和细胞因子及降解细胞外基质(ECM)来促进炎症反应和调节免疫反应。乳腺癌患者血清中的类胰蛋白酶浓度是正常人的4倍以上[29],这与乳腺癌患者的大量肥大细胞浸润有关。其他由肥大细胞释放的介质还有血管活性因子(组胺、IL-8、VEGF、前列腺素D和P物质),它们可以降低内皮屏障[30],促进血管生成因子的生成(VEGF、PDGF、MMP9 和 PGE2)并诱导血管生成。另外,肥大细胞还通过分泌促抗炎和免疫抑制的细胞因子和趋化因子对肿瘤微环境中抗炎和免疫抑制环境的形成起作用。对于肥大细胞与乳腺癌的发生发展关系的具体机制还有待进一步研究。2.4 细胞外基质(ECM)
细胞外基质(ECM)是由细胞分泌到细胞外间质中的大分子物质,主要是一些多糖和蛋白,或蛋白聚糖。可将其归为四类:胶原、非胶原糖蛋白、氨基聚糖、蛋白聚糖及弹性蛋白。虽然长期以来ECM都被视为一个稳定的结构,在维持组织形态的稳定中发挥主要作用,近来的研究表明它有着令人惊讶的动态性和灵活性并影响着细胞行为的许多方面[31]。ECM由多种调节机制来确保其稳态,通过与它相关的产生、降解和重塑的方式来保持正常的组织发展和功能。各种干扰都会使这些调节机制失调并使ECM紊乱,出现ECM的数量,组成或者形态的异常,从而导致微环境中细胞异常行为的发生并最终导致器官稳态和功能的失调,导致组织纤维化和肿瘤等疾病的发生[32]。肿瘤细胞需要降解ECM才能完成它的生长、侵袭和转移[33]。ECM主要是通过蛋白水解酶进行降解的,包括丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶及基质金属蛋白酶(MMPs)。
乳腺肿瘤的发生发展与肿瘤细胞表面的糖复合物糖链的变化密切相关。在体内外实验中均证实了乳腺肿瘤细胞的侵袭转移与糖蛋白β1,6分支N-糖链含量呈正相关[34]。糖链抗原15-3(carbohydrate antigen 153,CA153)是蛋白(mucin)的基因产物,现已被广泛用于对乳腺癌的监测。CA153对乳腺癌的早期诊断贡献不大,但是在乳腺癌骨转移的患者血清中却明显增高。对乳腺浸润性导管癌患者的病理标本进行免疫组织化学研究发现它们的层粘连蛋白受体(lamininreceptor,LN-R)的表达明显上调[35]。LN-R主要通过MAPK信号通路促进细胞外基质的降解,进而加速肿瘤的侵袭与转移。整合素是一类在细胞表面表达的受体,它主要参与细胞间信号的传递并可作为细胞与ECM间的桥梁。整合素连接蛋白激酶(integrin linked kined,ILK)是一种酪氨酸激酶,可以通过与整合素相互作用影响细胞骨架的形成,在乳腺癌中ILK表达增加,从而抑制了细胞骨架的形成,促进肿瘤的侵袭转移[36]。在乳腺癌中整合素还可以诱导基质金属蛋白酶(MMPs)的合成及PRO-MMP-1复合物的形成[37],有利于降解细胞外基质。临床研究表明,整合素α2β1和α5β1在低分化乳腺癌中低表达,整合素αvβ3在转移性乳腺癌中高表达,而整合素α6β4的高表达则意味着乳腺癌预后不良。由此可见,整合素可能成为监测乳腺癌发展及判断预后的新标志物。3 与乳腺肿瘤发生发展相关的细胞因子与信号通路
细胞因子是低分子量糖蛋白,它可以快速合成并常被各种健康及疾病细胞在受到刺激后分泌(主要是单核吞噬细胞和活化的T淋巴细胞)。在多细胞生物体中,细胞因子是细胞间的介质,能调节细胞的存活、生长、分化,同时也是细胞功能的效应器。在肿瘤微环境中细胞产生的额外的细胞因子调节肿瘤增殖、侵袭和转移;这些细胞因子包括IGF、PDGF、Wnt、Notch配体、Hedgehog配体及MMPs等[38]。
一些炎症趋化因子可以激活肿瘤干细胞的自我更新,然后促进肿瘤生长和转移[39]。人类乳腺癌细胞中,IL-1、 IL-6、 IL-8、 IL-10、IL-12、IL-18的表达水平与疾病的恶性程度及侵袭转移力密切相关[40]。近年来,许多体内和体外实验研究已经对细胞因子在肿瘤中的作用做出了解释。一些细胞因子(IL-1、IL-6、IL-11、TGFβ) 可激活其他细胞因子(IL-12、IL-18、IFNs)抑制乳腺癌的扩增和侵袭。许多临床试验增加了药代动力学特征和细胞因子的抗肿瘤活性研究。目前为止,IL-2和IFNα在晚期恶性黑色素瘤和肾癌的治疗中的作用都已有明确的报道。在晚期乳腺癌治疗中,IL-2、IFNα、IFNβ、IFNγ、IL-6和IL-12已被使用。激活免疫细胞反应最初锚定在用IL-2、IFNγ、IL-6、IL-12处理,IFNα和IFNβ用来诱导或降低激素不依赖性和克服他莫西芬抵抗作用[41]。
信号通路通过突变信号或多种基因的高活性的变化对肿瘤细胞的增殖和生长起重要作用,也是肿瘤代谢的最基本的调节剂。PI3K/AKT通路是乳腺癌中最常见的突变通路,它控制着细胞生长和分化等重要方面并与新陈代谢密切相关。该通路可以增强肿瘤细胞的糖代谢过程进而促进肿瘤的生长[42]。其他与乳腺癌相关的信号通路还有Wnt信号通路、TGF-β通路、STAT3信号通路、NF-κB信号通路等[43],见图1。
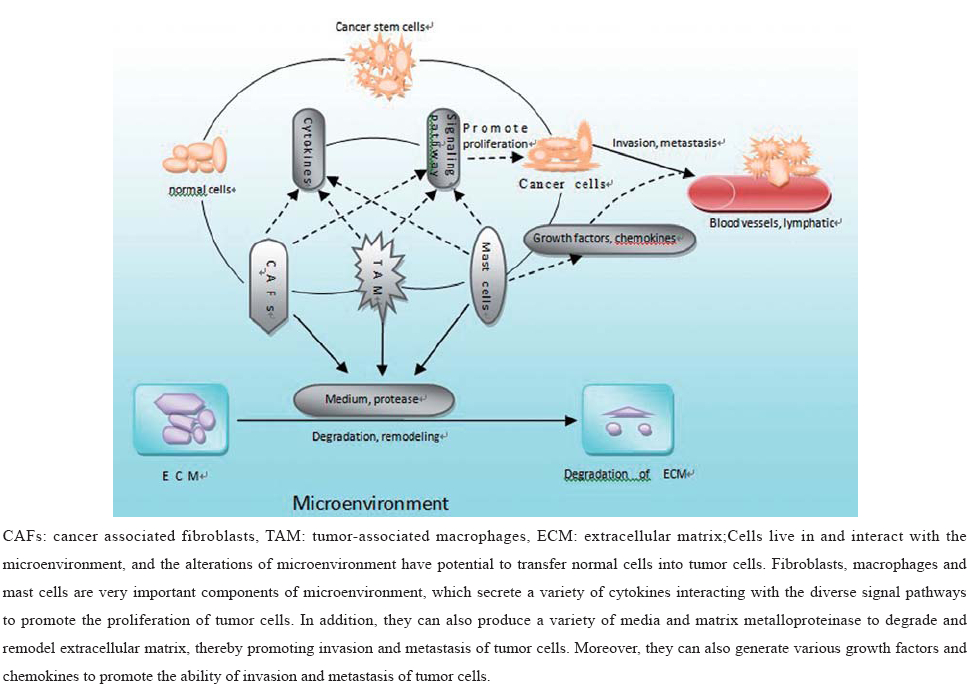 | 图1 肿瘤微环境与肿瘤侵袭转移的关系Figure 1 Relationship between tumor microenvironment and tumor invasion and metastasis |
近年来的研究已经提出了有关肿瘤微环境的全面性新见解,为肿瘤治疗提供了一个新的治疗靶点。目前,三种类型的肿瘤微环境靶点治疗正在临床实践中:芳香酶抑制剂(该靶点是主要表达芳香酶的基质成分)、血管生成调节剂(包括抗VEGF受体拮抗剂)、和HER家族受体的抑制剂(如曲妥珠单抗,能抑制被基质细胞产生的生长因子引发的上皮细胞受体信号)。
总之,进一步研究肿瘤细胞与肿瘤微环境相互作用的机制将会使人们进一步了解肿瘤微环境在肿瘤细胞生长、侵袭和转移中的作用,为提出新的肿瘤治疗策略提供重要理论依据。
| [1] | Merrimen JL, Jones G, Walker D,et al. Multifocal high gradeprostatic intraepithelial neoplasia is a significant risk factor forprostatic adenocarcinoma [J]. J Urol,2009,182(2):485-90. |
| [2] | Schonfeld SJ, Curtis RE, Anderson WF, et al. The risk of asecond primary lung cancer after a first invasive breast canceraccording to estrogen receptor status[J]. Cancer Causes Control,2012,23(10):1721-8. |
| [3] | Klein CA. Parallel progression of primary tumours andmetastases[J]. Nat Rev Cancer,2009,9(4):302-12. |
| [4] | Christofori G. New signals from the invasive front [J]. Nature2006,441(7092):444-50. |
| [5] | Noël A, Gilles C, Foidart JM.Invasion and metastaticdissemination in breast cancer: mechanisms[J]. Rev Med Liege,2011,66(5-6):274-8. |
| [6] | Langley RR, Fidler IJ. The seed and soil hypothesis revisited--the role of tumor-stroma interactions in metastasis to differentorgans[J]. Int J Cancer,2011,128(11):2527-35. |
| [7] | Hiratsuka S, Watanabe A, Aburatani H, et al. Tumourmediatedupregulation of chemoattractants and recruitmentof myeloid cells predetermines lung metastasis[J]. Nat CellBiol,2006,8(12):1369-75. |
| [8] | Maller O, Martinson H, Schedin P. Extracellular matrixcomposition reveals complex and dynamic stromal-epithelialinteractions in the mammary gland[J].J Mammary Gland BiolNeoplasia,2010,15(3):301-18. |
| [9] | Elkabets M, Gifford AM, Scheel C,et al. Human tumors instigategranulin-expressing hematopoietic cells that promote malignancyby activating stromal fibroblasts in mice [J].J Clin Invest,2011,121(2):784-99. |
| [10] | Siletz A, Kniazeva E, Jeruss JS, et al. Transcription factornetworks in invasion-promoting breast carcinoma-associatedfi broblasts[J]. Cancer Microenviron,2013,6(1):91-107. |
| [11] | Kalluri R, Zeisberg M. Fibroblasts in cancer[J]. Nat Rev Cancer,2006,6(5):392-401. |
| [12] | Hu M, Yao J, Carroll DK, et al. Regulation of in situ to invasivebreast carcinoma transition[J]. Cancer Cell,2008,13(5):394-406. |
| [13] | Huang CY, Feng CH, Hsiao YC, et al. Burn scar carcinoma[J].JDermatolog Treat,2010,21(6):350-6. |
| [14] | Tlsty TD, Coussens LM. Tumor stroma and regulation of cancerdevelopment[J]. Annu Rev Pathol,2006,1:119-50. |
| [15] | Lewis CE, Pollard JW. Distinct role of macrophages in differenttumor microenvironments[J]. Cancer Res,2006,66(2):605-12. |
| [16] | Morandi A, Barbetti V, Riverso M,et al. The colony-stimulatingfactor-1 (CSF-1) receptor sustains ERK1/2 activation andproliferation in breast cancer cell lines[J]. PLoS One,2011,6(11):e27450. |
| [17] | Sun ZK,Liu SC,Yao ZX. STAT3 activation of tumor-associatedmacrophages is associated with various cytokines and prognosticfactors in breast cancer[J]. Zhong Liu, 2009,29(1):65-8.[孙正魁,刘胜春, 姚榛祥. 乳腺癌中肿瘤相关巨噬细胞STAT3激活与多种细胞因子及预后因素有关[J]. 肿瘤, 2009,29(1):65-8.] |
| [18] | Qian B, Deng Y, Im JH, et al. A distinct macrophage populationmediates metastatic breast cancer cell extravasation, establishmentand growth[J]. PLoS One, 2009,4(8):e6562. |
| [19] | Wang R, Zhang J, Chen S, et al. Tumor-associated macrophagesprovide a suitable microenvironment for non-small lung cancerinvasion and progression[J]. Lung Cancer, 2011,74(2):188-96. |
| [20] | Bolat F, Kayaselcuk F, Nursal TZ, et al. Microvessel density,VEGF expression, and tumor-associated macrophages in breasttumors: correlations with prognostic parameters[J].J Exp ClinCancer Res, 2006,25(3):365-72. |
| [21] | Puig-Kröger A, Sierra-Filardi E, Domínguez-Soto A, et al. Folatereceptor beta is expressed by tumor-associated macrophages and constitutes a marker for M2 anti-inflammatory/regulatorymacrophages [J].Cancer Res, 2009,69(24):9395-403. |
| [22] | Eubank TD, Roberts RD, Khan M,et al. Granulocyte macrophagecolony-stimulating factor inhibits breast cancer growth andmetastasis by invoking an anti-angiogenic program in tumoreducatedmacrophages[J]. Cancer Res, 2009,69(5):2133-40. |
| [23] | Green CE, Liu T, Montel V,et al. Chemoattractant signalingbetween tumor cells and macrophages regulates cancer cellmigration, metastasis and neovascularization[J]. PLoS One,2009,4(8):e6713. |
| [24] | Hagemann T, Wilson J, Kulbe H, et al. Macrophages induceinvasiveness of epithelial cancer cells via NF-kappa B andJNK[J].J Immunol, 2005,175(2):1197-205. |
| [25] | Weller K, Foitzik K, Paus R, et al. Mast cells are requiredfor normal healing of skin wounds in mice[J]. FASEB J,2006,20(13):2366-8. |
| [26] | Xiang M, Gu Y, Zhao F, et al. Mast cell tryptase promotes breastcancer migration and invasion[J]. Oncol Rep, 2010,23(3):615-9. |
| [27] | Li Q ,Yang M ,Cao GM. Study of the relationship betweenthe expression of Mass Cells and lymph node metastases andlymphangiogenesis in invasive ductal carcinoma[J]. Hainan YiXue, 2012,23(9):7-9.[黎晴, 杨梅, 曹桂明. 肥大细胞与乳腺浸润性导管癌淋巴结转移及淋巴管生成的关系探讨[J]. 海南医学,2012,23(9):7-9.] |
| [28] | Della Rovere F, Granata A, Monaco M,et al. Phagocytosis ofcancer cells by mast cells in breast cancer[J]. Anticancer Res,2009,29(8):3157-61. |
| [29] | Samoszuk M, Corwin MA. Mast cell inhibitor cromolyn increasesblood clotting and hypoxia in murine breast cancer[J]. Int JCancer, 2003,107(1):159-63. |
| [30] | Crivellato E, Nico B, Ribatti D. Mast cells and tumourangiogenesis: new insight from experimental carcinogenesis[J].Cancer Lett, 2008,269(1):1-6. |
| [31] | Hynes RO. The extracellular matrix: not just pretty fibrils[J].Science,2009,326(5957):1216-9. |
| [32] | Cox TR, Erler JT. Remodeling and homeostasis of theextracellular matrix: implications for fibrotic diseases andcancer[J]. Dis Model Mech, 2011,4(2):165-78. |
| [33] | Liang X. EMT: new signals from the invasive front[J]. OralOncol, 2011,47(8):686-7. |
| [34] | Handerson T, Camp R, Harigopal M, et al. Beta1,6-branchedoligosaccharides are increased in lymph node metastases andpredict poor outcome in breast carcinoma[J]. Clin Cancer Res,2005,11(8):2969-73. |
| [35] | Zhou YH, Liu XZ, Zhou SF. The Relationship of LN-R and uPAin Invasive Ductal Breast Cancer [J]. Zhongguo Lin Chuang YiXue, 2009,16(5):676-8. [周云海, 刘学忠, 周士福. 层粘连蛋白受体、尿激酶型纤溶酶原激活物在乳腺浸润性导管癌中的表达及其相关性[J]. 中国临床医学, 2009,16(5):676-8]. |
| [36] | Oloumi A, Maidan M, Lock FE, et al. Cooperative signalingbetween Wnt1 and integrin-linked kinase induces acceleratedbreast tumor development [J]. Breast Cancer Res 2010,12(3):R38. |
| [37] | Foubert P, Varner JA. Integrins in tumor angiogenesis andlymphangiogenesis[J]. Methods Mol Biol, 2012,757:471-86. |
| [38] | Dittrich A, Quaiser T, Khouri C,et al. Model-driven experimentalanalysis of the function of SHP-2 in IL-6-induced Jak/STATsignaling [J]. Mol Biosyst,2012,8(8):2119-34. |
| [39] | Ginestier C, Liu S, Diebel ME, et al. CXCR1 blockadeselectively targets human breast cancer stem cells in vitro and inxenografts[J].J Clin Invest, 2010,120(2):485-97. |
| [40] | Srabović N, Mujagić Z, Mujanović -Mustedanagić J,et al.Interleukin 18 expression in the primary breast cancer tumourtissue[J]. Med Glas(Zenica),2011,8(1):109-15. |
| [41] | Wang K, Grivennikov SI, Karin M. Implications of anti-cytokinetherapy in colorectal cancer and autoimmune diseases[J]. AnnRheum Dis, 2012, 72 Suppl 2:ii100-3. |
| [42] | McAuliffe PF, Meric-Bernstam F, Mills GB,et al. Deciphering therole of PI3K/Akt/mTOR pathway in breast cancer biology andpathogenesis[J]. Clin Breast Cancer, 2010,10 Suppl 3:S59-65. |
| [43] | Liu M, Sakamaki T, Casimiro MC, et al. The canonicalNF-kappaB pathway governs mammary tumorigenesis intransgenic mice and tumor stem cell expansion[J]. Cancer Res,2010,70(24):10464-73. |
 2014, Vol.41
2014, Vol.41



