2.放疗科
2.Department of Radiotherapy
靶区和危及器官的勾画是脑肿瘤三维适形 放疗的首要且重要环节。有研究表明[1, 2, 3, 4],若单 纯依据CT图像较难定义临床靶区(clinical target volume,CTV)和大体肿瘤靶区(gross target volume,GTV),从而影响放疗疗效;而MR图 像对脑肿瘤的确定较CT具有独特优势尤其是对靠 近颅底的病变,但因缺少电子密度信息,无法直 接用于剂量计算,故在放疗计划的制定上受到限 制。若将两者结合,进行图像配准、融合,可提 高靶区和危及器官勾画的精确性。由于CT和MR 成像原理的不同,常用于脑肿瘤放疗图像配准的 体外标志在以上两种模态下成像需作更换,导致 坐标的位移,而影响配准精度和靶区勾画的准确 性。为克服上述不足,本研究自制双模外标志并 用于脑肿瘤放疗CT-MR图像配准,配准结果均达 三维适形放疗的临床需求。 1 资料与方法 1.1 设备
CT和MR分别采用Philips Mx8000 Quad多层螺旋CT及Philips Eclipse 1.5 T 超导型磁共振成像 仪;部分病例采用GE lightspeed VCT 128层CT 及SIEMENS verio 3.0T超导型磁共振成像仪。图 像配准采用Varian工作站(Eclipse External Beam Planning 6.5)。 1.2 双模外标志的制作 1.2.1 稀释液及混合液的配制[5]
(1)Gd-DTPA 稀释液筛选:取Gd-DTPA静脉注射液0.05、0.10、 0.25、0.5、1和2 ml,分别加纯净水配制成80 ml稀 释液(浓度分别为0.232、0.464、1.61、2.32、4.64 和9.27 mg/ml)6瓶;取上述稀释液各10ml分装6 瓶并依次标签,设10 ml 纯净水对照。将7瓶溶液 放入正交头线圈内行T1WI、T2WI和FLAIR成像。 (2)混合液筛选:选择信号强度在T1WI序列中 最高者与碘海醇按4:1、5:1、6:1、7:1和8:1的 比例,分别配制成5瓶10ml混合溶液并依次标签, 设立10 ml 纯净水对照。将不同比例的混合液行 MR、CT两种模态成像。将以上实验重复3次。 1.2.2 双模外标志所具备的条件
对于MR图像, 一般采用T1WI的增强图像作为待配准的浮动图像 (CT图像为模板图像),T2WI和FLAIR图像可作 为CTV、GTV勾画的参考。因此,作为图像配准 的体外标志应在T1WI上信号强度呈高信号并清楚 可辨,在T2WI和FLAIR图像也应呈较高信号也较 易识别;在CT图像中,体外标志应呈高密度,CT 值近似骨组织(因密度太高易形成伪影,较低又 不易识别)。 1.2.3 双模外标志的体模评估
将符合要求的混 合液密封于直径为2 mm,长度为30~40 mm的细 塑料管中,作体模检测;然后按放疗计划设计要 求,交叉固定在定位热塑面罩的模拟校准线上作 临床初步应用。交叉点为放疗专用常规模拟定位 机所确定的等中心体外定位参考点,共4点,即3 个共面点和1个非共面点。 1.3 临床应用 1.3.1 一般资料
脑肿瘤患者15例,其中男11 例,女4例。脑转移瘤9例,脑肿瘤术后6例。将佩 戴定位热塑面罩的患者按放疗计划要求,分别行 CT、MR扫描,将数据经网络传至Varian工作站作 放疗计划。 1.3.2 图像配准
在Varian工作站上行Match points 配准。首先将体外标志包括3个共面点和1个非共 面点从图像系列中识别出来,确定用于配准的相 应坐标,然后利用对应点计算出最佳变换并检测 基础配准平均误差和最大误差,经微调后使图像 达精确配准。 1.4 数据测量和分析
(1)数据测量:在每一成 像序列的3个连续层面上分别取3个大小为25mm 2的 感兴趣区测量;(2)数据分析:采用SPSS16.0 统 计软件包进行数据处理。数据用平均值±标准差表 示。 2 结果
不同浓度Gd-DTPA稀释液在3种成像序列中 信号强度改变,见图1;各比例混合液的信号强 度改变,见图2;浓度为1.61 mg/ml稀释液与碘海 醇按4 :1、5 :1、6:1、7 :1、8 :1混合的混合液 在CT上扫描,所测CT值分别为(1233.22±6.17) Hu、(961.95±8.53)Hu、(841.99±2.03)Hu、 (720.13±3.88)Hu、(592.64±2.82)Hu。
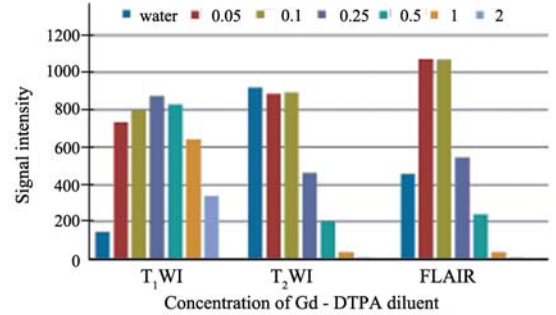 |
图1 Gd-DTPA稀释液信号强度随成像序列改变情况 Figure 1 Changes of signal intensity of Gd-DTPA diluents in imaging sequences |
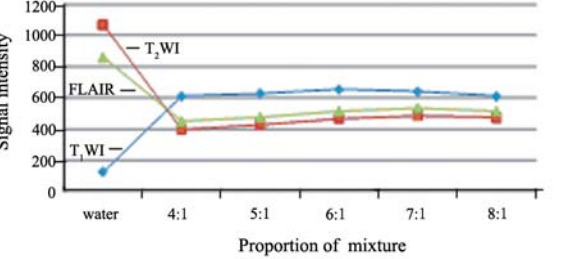 |
图2 各比例混合液信号强度随成像序列改变情况 Figure 2 Signal intensities of intermixture with different proportions |
由上述图可知,0.25ml Gd-DTPA静脉注射液 所配浓度为1.61 mg/ml稀释液在T1WI上信号强度达 (874.44±5.72),较其他浓度高,而在T2WI和FLAIR 上也呈较高信号;该浓度的稀释液与碘海醇按6:1 混合后,在T1WI上信号强度为(654.80±9.81),高 于其他比例混合液,在T2WI和FLAIR上也呈较高 信号。上述比例的混合液在CT上呈现高密度,其 CT达(841.99±2.03) Hu。浓度为1.61 mg/ml稀释液 与碘海醇按6:1混合的混合液,比照双模外标志所具备的条件,可选其制作双模外标志。
将筛选出的混合液密封于细塑料管中作体模 检测,在CT、MR两种模态下成像均能清楚显示, 见图3。15例脑肿瘤患者CT-MRI图像配准结果, 见表1,配准平均误差为(1.35 ± 0.22) mm,最大误 差平均为(1.36 ± 0.09) mm,完全符合头部肿瘤 误差< 2 mm的临床要求。
 |
图3 双模外标志体模测试 Figure 3 Phantom test of dual-mode external markers |
|
|
表1 15例患者CT-MRI图像配准结果 Table 1 CT-MRI image registration results of 15 patients with brain tumor |
在脑肿瘤的三维适形放疗过程中,靶区和危 及器官轮廓的勾画是实施放疗的首要且重要环 节。通过勾画的轮廓,可以显示肿瘤和危及器官 的三维立体形状和体积,再通过三维剂量计算模 型的计算和剂量评估,以达治疗方案的最优化和 放疗疗效最大化的目的。
由于CT图像对不同X线吸收特征或电子密度 的组织结构具有一定的分辨能力,且放射剂量在 体内的分布与组织的电子密度直接相关,因此, 目前放疗计划系统均是基于CT图像的CT值进行精 确计算的。然而,CT图像对软组织或具有相似电 子密度的组织区分能力有限,对病变边界的显示 欠佳,若单纯依据CT图像较难定义CTV和GTV。 对脑肿瘤,常因肿瘤占位效应及水肿区域所致正 常解剖结构的改变,更增加了CTV和GTV的不 确定性。MR图像的成像原理不同于CT,可明确 区分具有相似电子密度的不同软组织结构,对脑 肿瘤和水肿区域的界定尤具优势,但因缺乏电子 密度信息,无法直接用于剂量计算,故在放疗计 划的制定上受到限制。若将两者结合,进行图像 配准、融合,可提高靶区和危及器官勾画的精确 性。闫婧等[1]对25例脑瘤患者分别使用CT和MRI 进行三维适形放疗定位,结果在显示病灶数目 上,有23例显示病灶数目相同,2例显示病灶数目 不同;在GTV的判定上,两者均存在差异,其中 CT较MRI所勾画GTV增大者l0例,缩小者15例。 经以MRI确定的靶区作为GTV,以CT图像提供的 CT值进行剂量计算,制定放疗计划,放疗结束后 完全缓解(CR)2例、部分缓解(PR)14例。李 丹明等[2] 采用CT和MRI图像融合对9例颅内胶质瘤 术后放疗临床靶区(CTV)的研究显示,9例患者 中8例融合界面勾画的CTV比CT图像的CTV减小 13.85%~73.59%,1例体积增大10.35%。总之, CT与MRI的配准、融合,可明显提高脑肿瘤或肿 瘤术后放疗CTV、GTV的准确性、适形放疗的精 度和放疗疗效。 3.2 图像配准的基础
图像配准是实现图像融合的前提。图像配准 就是通过寻找某种空间变换,使两幅图像的对应 点达到空间位置和解剖结构上的完全一致。配准 的结果应使两幅图像上所有的解剖点或至少是所 有具有诊断意义的点及感兴趣的点都达到匹配。 图像配准方法基本上可分为两类[3, 6]:基于体素相 似性的方法和基于特征的方法。前者不需提取图 像间对应的解剖特征,通过优化目标函数来计算 所有体素灰度值对的对应性。后者既可以是患者本身解剖特征的内部点,也可以是人工标识的外 部点。体外标志属外部点法,它适用于任何模态 图像的配准,是精确配准的基础。有学者[7]将10% 泛影葡胺和甘油用作CT、MR图像配准的外标志, 也有报道[8]将硫酸铜溶液密封于用有机玻璃制成的 小正方体中作为配准外标志,由于CT和MR成像原 理的差异,在以上两种模态下成像需作更换,导 致坐标的位移,而影响图像配准的精度和靶区勾 画的准确性。因此,设计在3种MRI序列及CT上均 能清楚识别的坐标标志即双模外标志是本研究的 目的之一。 3.3 双模外标志的设计与临床初步应用
众所周知,MR信号强度的高低不仅取决于质 子的密度,而且还与参与成像物质的弛豫时间相 关。当质子密度一定时,T1或T2的长短就决定信 号强度。Gd-DTPA是广泛用于临床的MR顺磁性 对比剂,对T1和T2的影响因浓度而异,信号强度 也随浓度的高低而不同[5, 9]。低浓度时,Gd-DTPA 的主要是缩短T1,因而在T1WI上呈现高信号。在 较高浓度时,对缩短T2占主导,致使信号强度下 降,在T2WI上呈现低信号。由于用于待配准的浮 动图像一般采用T1WI的增强MR图像(CT图像为 模板图像),T2WI和FLAIR图像作为勾画CTV、 GTV的参考。因此,筛选在T1WI上较其他浓度信 号强度高的Gd-DTPA稀释液便成为体外标志设计 的关键。笔者在预实验的基础上,以0.25 ml 为中 心,取Gd-DTPA静脉注射液0.05、0.10、0.25、 0.5、1和2 ml,加纯净水配制成浓度分别为0.232、 0.464、1.61、2.32、4.64和9.27mg/ml的稀释液, 依据各浓度稀释液在T1WI、T2WI和FLAIR上信号 强度,筛选出浓度为1.61mg/ml Gd-DTPA稀释液符 合在MR成像序列中均呈高信号的要求,尤其是在 T1WI上(见图1)。CT值的高低主要反映了参与 成像物质密度,且CT对高密度的物质较为敏感因此,将Gd-DTPA稀释液与CT对比剂如碘海醇按 恰当的比例混合,可实现体外标志在T1WI上呈高 信号并清楚可辨,在T2WI和FLAIR图像也呈较高 信号较易识别,在CT图像上呈高密度的设想(见 图2,表1)。本研究结果表明,1.61mg/ml GdDTPA稀释液与碘海醇按6∶1混合可满足图像配准 体外标志的选择标准;将该比例混合液密封于细 塑料管中作为双模外标志经体模检测,在3种MR 成像序列及CT上均能清楚显示(见图3)。
在临床应用上,图像配准、融合的效果评价 方法有信息熵、互信息、均方值、峰值信噪比和 平均梯度等[10, 11]。但是对于不同的用途,难以给 出一个通用评价流程和标准。在基于特征的配准 方法中,配准误差或配准精度分析几乎都以影像 解剖结构上的多个刚性标记点作为参考,其配准 和评价过程较为繁杂,加上两种模态成像体位的 改变、扫描角度的不同等因素,增加了临床实际 操作的难度和不便。笔者将双模外标志固定于定 位热塑面罩上,在两种模态的成像中无需更换, 所有患者在相应模态下成像均保持与放疗体位一 致;在配准过程上,只需将外标志的3个共面点和 1个非共面点从图像系列中识别出来即可,避免 因对影像解剖结构的主观认识不足造成的配准误 差,有效提高了临床操作配准的准确性和效率。 本研究结果显示,在15例脑肿瘤放疗图像配准中 采用双模外标志,初次配准的平均误差为(1.35 ± 0.22)mm,最大误差平均为(1.36 ± 0.09)mm,与李 丹明等[2, 12]采用标点法进行CT和MRI图像配准精 度基本一致,完全符合头部肿瘤误差<2 mm的临 床要求;在初次配准的基础上经微调,可达到两 种模态图像的位置一致,角度一致,大小一致, 配准结果均达脑肿瘤三维适形放疗的需求(见图4, 5, 6)。
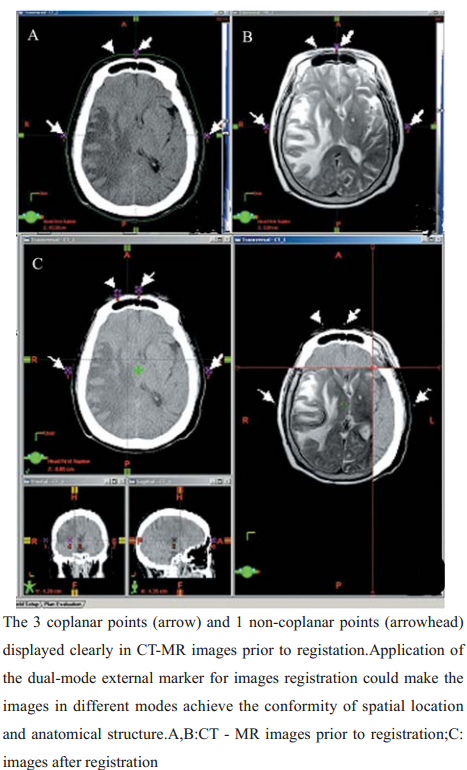 |
图4 脑肿瘤放疗图像配准 Figure 4 Images registration for brain tumor radiotherapy erapy |
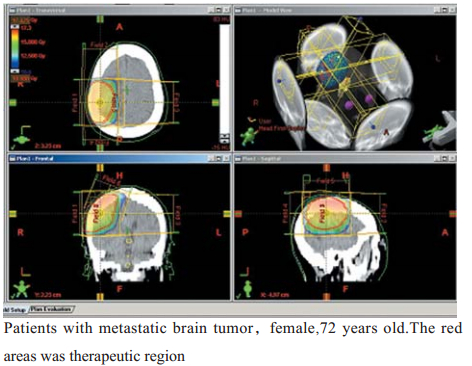 |
图5 CT模式下射野路径图:剂量图和REV(room eye view)图 Figure 5 Beam path diagrams in CT mode:dose distributions and REV(room eye view) |
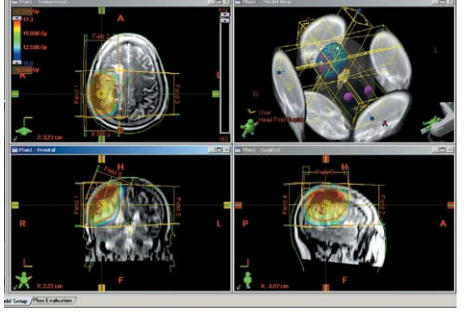 |
图6 MRI模式下射野路径图(图5同一病例) Figure 6 Beam path diagrams in MRI mode(The same case of figure5) |
| [1] | Yan J,Lu J,Li BS,et al.CT and MRI image fuse in three-dimensional conformal radiotherapy for cranial carcinoma[J].Zhonghua Zhong Liu Za Zhi,2007,29(12):935-7.[闫婧,卢洁,李宝生,等.CT与MRI图像融合在颅内肿瘤三维适形放疗中的应用[J].中华肿瘤杂志,2007,29(12):935-7.] |
| [2] | Li DM,Wu XH,Zhu XX.Impact of MRI-CT image registration on target delineation of postoperative radiotherapy for Gliomas[J].Ai Zheng,2008,27(5):544-8.[李丹明,武新虎,朱锡旭.MRI-CT图像融合对脑胶质瘤术后放疗靶区的影响[J].癌症,2008,27(5):544-8.] |
| [3] | Paulino AC,Thorstad WL,Fox T.Role of fusion in radiotherapy treatment planning[J].Semin Nucl Med,2003,33(3):238-43. |
| [4] | Zhang ZX,Chen JS,Chen X,et al.Improvement of MRCP quality by oral administration of diluted Gd-DTPA[J].Lin Chuang Fang She Xue Za Zhi,2004,23(9):777-80.[张照喜,陈建生,陈宪,等.口服静脉用钆喷酸葡胺稀释液改善MRCP质量的研究[J].临床放射学杂志,2004,23(9):777-80.] |
| [5] | Sui MR,Hu JF,Tang HY,et al.Medical image registration methods and application[J].Lin Chuang Yi Xue Gong Cheng,2009,16(5):96-7.[隋美蓉,胡俊峰,唐鹤云,等.医学图像配准方法及其应用[J].临床医学工程,2009,16(5):96-7.] |
| [6] | Li SX,Guan L,Zhuang TG,et al.Rigid registration and fuse between SPECT and MRI/CT based on external fiducial alignment[J].Zhongguo Yi Liao Qi Xie Za Zhi,2001,25(4):192-5.[李世星,管梁,庄天戈,等.基于外部基准框架的SPECT与MRI/CT的刚性配准及融合[J].中国医疗器械杂志,2001,25(4):192-5.] |
| [7] | Zhou ZH,Chen SP,Tao DC,et al.Automatic registration of markers in medical image[J].Zhongguo Sheng Wu Yi Xue Gong Cheng Xue Bao,2003,22(5):438-42.[周振环,陈思平,陶笃纯,等.医学图像标志点的自动配准[J].中国生物医学工程学报,2003,22(5):438-42.] |
| [8] | Liu DX,Yu Q.MR Imaging Fascicule[M].Wuhan:Hubei Science and Technology Press,1999:121-5.[刘定西,于群.MR成像分册[M].武汉:湖北科学技术出版社,1999:121-5.] |
| [9] | Wang LY,Tao L,Wang HN.The research on evaluate measure of CT and MRI image fusion[J].Sheng Wu Yi Xue Gong Cheng Yan Jiu,2006,25(4):247-50.[王林艳,陶玲,王惠南.CT与MRI图像融合的评价方法研究[J].生物医学工程研究,2006,25(4):247-50.] |
| [10] | Cao WJ,Li G,Mu XF.Role of CT/MRI registration in head and neck cancer radiotherapy[J].Zhong Liu Fang Zhi Yan Jiu,2013,40(7):709-13.[曹文娟,黎功,穆晓峰.CT/MRI配准在头颈肿瘤放疗中的应用[J].肿瘤防治研究,2013,40(7):709-13.] |
| [11] | Li DM,Zhu XX,Wu XH,et al.Analysis of MRI-CT image registration accuracy by Tris-Axes landmark[J].Yi Xue Yan Jiu Sheng Xue Bao,2008,21(12):1278-81,1284.[李丹明,朱锡旭,武新虎,等.标点法MRI-CT图像融合的融合精度分析[J].医学研究生学报,2008,21(12):1278-81,1284.] |
 2014, Vol.41
2014, Vol.41


