2. 复旦大学遗传学研究所
2. State Key Laboratory of Genetic Engineering, Institute of Genetics, School of Life Sciences, Fudan University
DNA甲基化是重要的转录调控表观遗传机制[1] ,人类DNA甲基化所需的甲基基团主要从一碳单位代谢(one-carbon metabolism)获得,甲基组分摄入不足,可引起全基因组低甲基化和特异基因甲基化模式异常。全基因组甲基化降低是恶性肿瘤发生或发展中的普遍事件,在多种肿瘤中都发现基因组甲基化水平显著低于正常组织,全基因组甲基化水平已成为某些复杂疾病预防、诊治和预后的重要指标。LINE-1(long interspersed nucleotide elements)是人类基因组的长散在重复序列,约有50万拷贝,占人类基因组的17%,为自主复制反转录转座的病毒超家族,具有转座的潜在功能[2]。Alu是人类基因组中除LINE-1以外最主要的中度重复序列,约有100万拷贝,约占基因组的11%。Alu家族也具有转座潜能,但需借助LINE-1家族编码的反转录酶和核酸内切酶的功能[3]。LINE-1和Alu占有基因组三分之一以上的CpG甲基化位点,其甲基化水平体现了全基因组甲基化状况,因此,这些重复序列的甲基化状态通常用作全基因组甲基化水平评价的替代指标[4]。此外,维护LINE-1和Alu中CpG位点的正常甲基化可降低其反转录活性对基因组的潜在威胁[5],是基因组稳定性的一种重要维持机制。因此,探讨甲基化合物对LINE-1和Alu甲基化状态的影响,能够从表观遗传学角度为全基因组的稳定性维护提供科学依据。
叶酸(folate)是一碳单位代谢的主要组分,其代谢主要涉及DNA合成和DNA甲基化两个生化过程,是维持基因组稳定的重要微营养物质。最高氧化态叶酸(folic acid ,FA),通常作为膳食、营养加强或培养液的组分;5-甲基四氢叶酸(5-methyltetrahydrofolate,5-MeTHF)是FA的最高还原态,为人体内活性叶酸的主要存在形式。外源叶酸进入人体后,需要被还原和甲基化形成5-MeTHF后,参与合成甲基供体S-腺苷甲硫氨酸(SAM)。叶酸缺乏引起的基因组、肿瘤相关基因DNA序列甲基化模式的改变与很多肿瘤发生相关联[6, 7, 8],血清叶酸水平、基因组甲基化水平已经成为临床上评估疾病和肿瘤发生风险的重要参考依据[9, 10, 11, 12]。
本研究通过比较FA和5-MeTHF对人成淋巴细胞Alu和LINE-1序列甲基化的效应,了解不同氧化态的叶酸对人淋巴细胞基因组DNA甲基化的影响,从而为维持DNA正常甲基化和基因组稳定性的营养干预、复杂疾病预防和诊断提供依据。1 材料与方法1.1 材料与试剂
人成淋巴细胞系GM12593源自NIGMS人类遗传突变细胞库,由澳大利亚CSIRO Fenech教授惠赠。
FA、5-MeTHF、L-谷氨酰胺购于美国Sigma公司,透析胎牛血清(Hyclone,新西兰),青霉素和链霉素(中国哈药集团制药总厂),EZ DNA methylation kit(Zymo 公司,美国),Sanprep柱式DNA胶回收试剂盒(中国上海生工生物工程技术服务有限公司),克隆测序所用IPTG、X-gal、DMT、氨苄青霉素、Trans1-T1抗噬菌体化学感受态细胞和pEASYTM-T1克隆载体(北京全式金生物技术有限公司)。1.2 方法1.2.1 细胞干预培养设计
根据叶酸的生理浓度(20~40 nmol/L)及其在离体条件下维护人淋巴细胞基因组结构稳定性的最适浓度[13, 14, 15],实验将标准RPMI1640中叶酸的2 260 nmol/L设置为30、60、120 nmol/L FA或5-MeTHF;为了保证干预过程不受甲基代谢辅助途径的干扰,实验根据叶酸代谢特点,将胆碱浓度设为“0”;为防止过量的甲硫氨酸促进SAM合成和抑制亚甲基四氢叶酸还原酶(MTHFR),实验将标准培养液甲硫氨酸浓度(101 μm/L)控制在生理浓度(50 μm/L)[16],培养液其他组分浓度与标准RPMI1640一致。1.2.2 细胞干预培养
按(5~10)×105/m1的密度接种细胞在含8%透析胎牛血清、不同浓度FA或5-MeTHF的培养液中,于37℃、5% CO2培养箱中培养,每3天活细胞计数并更换相应培养液,20天后提取基因组DNA,每个干预浓度重复三次。1.2.3 甲基化分析
按照试剂盒操作说明对提取的基因组DNA进行亚硫酸氢钠修饰、PCR扩增、目的产物回收、克隆,通过X-Gal/IPTG蓝白斑筛选技术挑选阳性克隆(白色菌落),每个干预组挑取10个阳性克隆,PCR扩增后测序(北京六合华大广州分公司),结果与标准共有序列比对,根据计算目标序列中甲基化CpG位点占总CpG位点的百分比,分析甲基化水平[4]。1.3 统计学方法
EditSeq和SeqMan软件统计测序后Alu和LINE-ⅠCpG位点甲基化情况;SPSS15.0 one-way ANOVA分析不同培养条件下Alu和LINE-1甲基化水平的差异;Independent-sample T test 比较同等浓度下FA和5-MeTHF对Alu和LINE-1甲基化水平的干预效应;GraphPad Prism 5统计软件作图,以P<0.05为差异有统计学意义。 2 结果
不同浓度FA和5-MeTHF对GM12593细胞基因组Alu和LINE-1甲基化水平的影响见表1,Alu和LINE-1甲基化水平随着FA或5-MeTHF浓度的升高而增加,其中120 nmol/L组两序列甲基化水平均显著高于30和60 nmol/L组(P=0.008,0.007,0.01,0.001),目标序列在30和60 nmol/L时甲基化水平差异均无统计学意义。
|
|
表1 不同氧化态叶酸干预后GM12593细胞Alu和LINE-I甲基化水平的改变 Table 1 Methylation levels of Alu and LINE-I in GM12593 intervened by different oxidative states of folate |
在相同浓度下,5-MeTHF干预后,Alu序列甲基化水平比FA组略显升高,但差异无统计学意义,见图1;但5-MeTHF组,LINE-1甲基化水平显著高于FA组(P﹤0.01或0.05),见 图2。
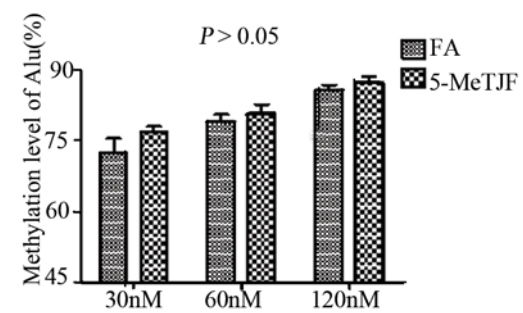 |
图1FA和5-MeTHF对GM12593 Alu甲基化水平影响的比较 Figure 1Comparison of the effects of FA and 5-MeTHF on the methylation levels of Alu in GM12593 cells |
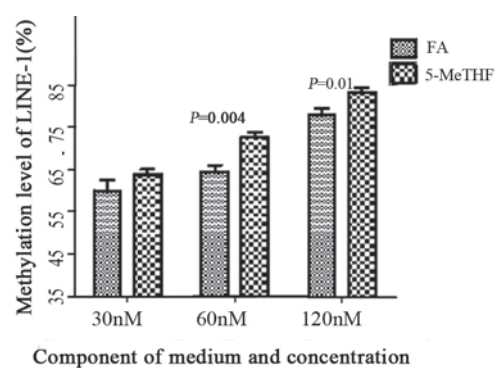 |
图2FA和5-MeTHF对GM12593 LINE-1甲基化水平影响 的比较 Figure 2Comparison of the effects of FA and 5-MeTHF on the methylation levels of LINE-1 in GM12593 cells |
DNA甲基化是基因表达、维持基因组DNA完整性与稳定性、染色体修饰以及突变发生的关键表观遗传学因素。无论是全基因组或者特异基因甲基化调节和模式的异常,均往往与包括肿瘤在内的多种复杂疾病相关。Alu、LINE-1是人类基因组中重要的中度重复序列,基因组大约三分之一的甲基化都发生在这些序列的CpG位点中,其甲基化水平已经用于评估全基因组甲基化状况[4];另一方面,由于甲基化可以抑制Alu、LINE-1序列的转录活性,而全基因组甲基化水平降低则可能激活其反转录活性,对基因组稳定性造成潜在威胁。在某些肿瘤细胞中,Alu、LINE-1序列CpG位点因低甲基化而被激活,几乎所有的恶性肿瘤细胞中,LINE-1均有不同程度的低甲基化现象[17]。
一碳单位相关组分摄入或者代谢异常对DNA甲基化修饰具有举足轻重的作用,其中SAM是细胞内的甲基供体,参与DNA、RNA、蛋白质、神经传递体和磷脂等80多个甲基化反应。膳食叶酸,尤其是营养添加类叶酸主要为FA,摄入体内通过亚甲基四氢叶酸还原酶(MTHFR)转化为还原型叶酸5-MeTHF,再经甲硫氨酸合酶(MS)合成甲硫氨酸,最终形成SAM。因此,FA或5-MeTHF缺乏可不同程度地导致SAM库存减少,影响DNA的甲基化水平;叶酸缺乏还可引起SAM与其代谢产物S-半胱氨酸(S-adenosylhomocysteine,SAH)比例失衡以及DNA甲基转移酶表达异常,导致DNA甲基化异常[18, 19]。本研究发现,二种氧化态叶酸在120 nmol/L时,均使Alu和LINE-1序列甲基化水平显著高于相应氧化态叶酸30和60 nmol/L组,提示叶酸缺乏可显著降低基因组DNA甲基化水平,从而影响基因组DNA的完整性和稳定性,该结果与以往所得到的叶酸促进基因组结构稳定性的研究吻合[13, 14, 15]。
5-MeTHF是携带甲基基团,具有生理活性的高度还原态的叶酸形式,直接为SAM合成途径提供甲基,保证甲基化反应的甲基供给。因此,从代谢途径的角度(图1),5-MeTHF比FA更接近甲基化过程,从而应该能更有效地维持DNA甲基化状态。研究结果证实了该假设,即5-MeTHF对DNA甲基化水平的影响效应强于FA。
我们以往的研究显示,由于淋巴细胞对FA和5-MeTHF吸收效率和生物利用度差异,也由于FA更直接地涉及DNA合成与损伤修复部分的代谢,FA维持基因组结构稳定性的效应强于5-MeTHF[12]。然而,从DNA甲基化反应中甲基供体的角度,FA的甲基化效能低于5-MeTHF。此外,本研究将叶酸代谢网络甲基化部分的辅助途径封闭,即无胆碱状态,凸显了FA和5-MeTHF在干预过程中作为单一甲基变量的作用差异,更为客观地解析了FA和5-MeTHF对基因组结构稳定性与DNA甲基化的效应。120 nmol/L FA或5-MeTHF可提高体外培养健康人成淋巴细胞系基因组DNA的甲基化水平,利于基因组稳定性的维持,5-MeTHF维持基因组DNA甲基化状态可能比FA更有效。提示适量补充叶酸,保证体内有效叶酸的浓度可保证基因组DNA正常甲基化模式,对维持基因组健康有重要意义。
| [1] | Kim KC, Friso S, Choi SW. DNA methylation: an epigenetic mechanism connecting folate to healthy embryonic development and aging[J]. J Nutr Biochem, 2009, 20(12): 917-26. |
| [2] | Sassaman DM, Dombroski BA, Moran JV, et al. Many human L1 elements are capable of retrotransposition[J]. Nat Genet, 1997, 16(1): 37-43. |
| [3] | Mathias SL, Scott AF, Kazazian HH Jr, et a1. Reverse transcriptase encoded by a human transposable element[J]. Science, 1991, 254(5039): 1808-10. |
| [4] | Yang AS, Estécio MR, Doshi K, et al. A simple method for estimating global DNA methylation using bisulfite PCR of repetitive DNA elements[J]. Nucleic Acids Res, 2004, 32(3): e38. |
| [5] | Dewannieux M, Esnault C, Heidmann T. LINE-mediated retrotransposition of marked Alu sequences[J]. Nat Genet, 2003, 35(1): 41-8. |
| [6] | Freudenheim JL, Graham S, Marshall JR, et al. Folate intake and carcinogenesis of the colon and rectum[J]. Int J Epidemiol, 1991, 20(2): 368-74. |
| [7] | Kim YI. Role of folate in colon cancer development and progression[J]. J Nutr, 2003, 133(11 Suppl 1): 3731S-9S. |
| [8] | Ames BN. Micronutrient deficiencies. A major cause of DNA damage[J]. Ann N Y Acad Sci, 1999, 889: 87-106. |
| [9] | Bollati V, Galimberti D, Pergoli L, et al. DNA methylation in repetitive elements and Alzheimer disease[J]. Brain Behav Immun, 2011, 25(6): 1078-83. |
| [10] | Suter CM, Martin DI, Ward RL. Hypomethylation of L1 retrotransposons in colorectal cancer and adjacent normal tissue[J]. Int J Colorectal Dis, 2004, 19(2): 95-101. |
| [11] | Stempak JM, Sohn KJ, Chiang EP, et al. Cell and stage of transformation-specific effects of folate deficiency on methionine cycle intermediates and DNA methylation in an in vitro model[J]. Carcinogenesis, 2005, 26(5): 981-90. |
| [12] | Lichtenstein AV, Kisseljova NP. DNA methylation and carcinogenesis[J]. Biochemistry (Mosc), 2001, 66(3): 235-55. |
| [13] | Fenech M. The role of folic acid and Vitamin B12 in genomic stability of human cells[J]. Mutat Res, 2001, 475(1-2): 57-67. |
| [14] | Wang X, Fenech M. A comparison of folic acid and 5-methyltetrahydrofolate for prevention of DNA damage and cell death in human lymphocytes in vitro[J]. Mutagenesis, 2003, 18(1): 81-6. |
| [15] | Wang X, Thomas P, Xue J, et al. Folate deficiency induces aneuploidy in human lymphocytes in vitro-evidence using cytokinesis-blocked cells and probes specific for chromosome 17 and 21[J]. Mutat Res, 2004, 551(1-2), 167-80. |
| [16] | Kimura M, Umegaki K, Higuchi M, et al. Methylenetetrahydrofolate reductase C677T polymorphism, folic acid and riboflavin are important determinants of genome stability in cultured human lymphocytes[J]. J Nutr, 2004, 134(1): 48-56. |
| [17] | Estécio MR, Gharibyan V, Shen L, et al. LINE-1 hypomethylation in cancer is highly variable and inversely correlated with microsatellite instability[J]. PLoS One, 2007, 2(5): e399. |
| [18] | Tuck-Muller CM, Narayan A, Tsien F, et al. DNA hypomethylation and unusual chromosome instability in cell lines from ICF syndrome patients[J]. Cytogenet Cell Genet, 2000, 89(1-2): 121-8. |
| [19] | Crott J, Fenech M. Preliminary study of the genotoxic potential of homocysteine in human lymphocytes in vitro[J]. Mutagenesis, 2001, 16(3):213-7. |
 2014, Vol.41
2014, Vol.41