2. 医药研究所
2. Institute of Medicine
异常糖基化是恶性肿瘤转移的重要机制之一,末端唾液酸化和高分支糖链的增加[1]是肿瘤实验模型N-连接型糖基化异常的两大特征,尤其是sLeX及其衍生物的表达与肿瘤转移密切相关[2]。唾液酸-岩藻糖化聚糖sialyl LewisX(sLeX)作为E-,P-,L-选择素核心识别表位,不仅介导淋巴细胞归巢而且介导与血管内皮细胞之间的黏附[3, 4],与肿瘤预后不良及转移率增加有关[5]。现已证实α1,3-岩藻糖基转移酶Ⅶ(FUT7)对于催化sLeX的合成非常重要[6]。为探讨FUT7在乳腺癌细胞迁移侵袭能力中的作用,我们通过构建FUT7基因的真核表达载体,转染并获得过表达外源FUT7的MDA-MB-231细胞,分析FUT7对乳腺癌细胞黏附和迁移能力的影响,现报告如下。1 材料与方法1.1 材料
人乳腺癌细胞MDA-MB-231购自上海中科院细胞库;人脐静脉内皮细胞(Human Umbilical Endothelial Cells,HUVECs)购自美国ATCC细胞库;LipofectamineTM2000、Trizol购自Invitrogen公司;RT-PCR试剂盒购自大连宝生物工程有限公司;FUT7羊抗人多克隆抗体、HRP标记的羊抗鼠IgG购自Santa公司;抗sLeX单克隆抗体购自CHEMICON公司。1.2 方法1.2.1 真核表达载体pEGFP-C1-FUT7构建
目的基因FUT7从cDNA文库中调取,设计特异性引物:上游5'-CCG GCCACCATGAATAATGCTGGGCACGGC-3',下游5'-CCGGAATTCGGATGCTG GTGGTTTGATTTCG-3',PCR扩增,经1.0 %琼脂糖凝胶电泳鉴定。Xho I、EcoR I双酶切目的基因FUT7及pEGFP-C1空载体,T4 DNA酶连接,转化DH5α感受态大肠杆菌,送Invitrogen测序鉴定。Qiagen质粒提取试剂盒抽提质粒DNA。1.2.2 pEGFP-C1-FUT7转染人乳腺癌细胞MDAMB-231
MDA-MB-231细胞按4×105个/孔接种于6孔板内,至细胞密度为80 %时换无血清无双抗培养液,脂质体LipofectamineTM2000介导空质粒及重组质粒转染细胞,按试剂说明书进行操作。转染24 h后,G418抗性筛选,分离阳性克隆,扩大培养,获稳转细胞克隆。1.2.3 RT-PCR检测外源FUT7mRNA表达
收集稳定转染FUT7基因的MDAMB-231细胞,Trizol提取细胞总RNA,进行反转录。以β-actin为内参照,半定量PCR鉴定FUT7基因。FUT7引物序列为:上游5'-GCC CAGTACCGCTTCTACCT-3',下游5'-GCCTGAAACCAACCCTCA A-3',扩增片段为368 bp;β-actin引物序列为:上游5'-GTGGACATCCCAAAGAC-3',下游5'-GAAAGGGTGTAACGCAACT-3',扩增片段为303 bp。1.5 %琼脂糖凝胶电泳检测PCR产物。1.2.4 Western blot法检测FUT7和sLeX蛋白表达
裂解细胞,提取总蛋白。经SDS-PAGE电泳分离后转移至PVDF膜上,封闭液中室温孵育2 h,加入FUT7/sLeX一抗(1:500),4℃过夜;TBST漂洗3次;HRP标记的二抗(1:5 000)室温孵育2 h,TBST漂洗3次,ECL显色,暗室X线片曝光成像,凝胶成像系统拍照,分析。β-actin作为内参蛋白。 1.2.5 细胞黏附能力检测
将HUVECs接种于96孔板生长至单层,10 μg/L TNF-α37℃孵育4 h,每孔加入Calcein-AM标记的肿瘤细胞,37℃、120 r/min旋转孵育30 minPBS轻轻洗去未结合的肿瘤细胞。加入100 μl PBS,酶标仪520 nm处检测荧光强度(fluorescence intensity,FI),计算肿瘤细胞黏附率,以只有内皮细胞孔作空白对照。每组设3个复孔,计算平均值。肿瘤细胞黏附率=(实验组平均FI值-空白对照组平均FI值)/(对照组平均FI值-空白对照组平均FI值)×100 %。1.2.6 细胞迁移能力检测
将HUVECs以2×104个/孔接种于Transwell小室的上室面,培养至完全汇合。实验前4 h加入10 μg/L TNF-α活化。收集各组细胞,荧光染料DiI孵育2 h,PBS洗3次,每孔中加入2×105cells/200 μl的肿瘤细胞。下室加入600 μl含10% FBS的完全培养液,37℃5% CO2培养7 h。擦去上室面未穿膜的细胞,4%多聚甲醛固定30 min后,PBS洗3次,风干,倒置荧光显微镜观察。每组设4个复孔,对穿过单层HUVECs的细胞每孔随机选5个区域,200倍下计数上、中、下、左、右5个视野中的细胞数,计算平均值。1.3 统计学方法
应用SPSS 13.0统计软件进行数据处理,所有数据以均数±标准差(x±s)表示。 组间差异的显著性分析用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。2 结果2.1 转染后MDA-MB-231细胞外源FUT7mRNA的表达
琼脂糖凝胶电泳扩增转染后各组细胞外源FUT7mRNA表达产物,结果可见368 bp处有目的基因表达,见图1,以目的基因与β-actin灰度值的比值来反映FUT7mRNA的相对表达量。分析结果表明,稳转重组质粒组(FUT7/231组)细胞FUT7mRNA水平与未转染组(231组)及稳转空载体组(C1/231组)相比,表达量明显增高(P<0.01)。
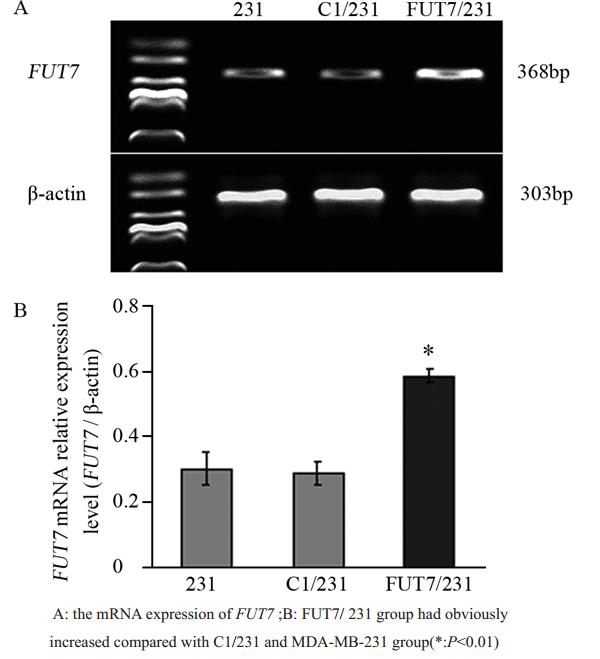 |
图1RT-PCR检测MDA-MB-231细胞外源FUT7 mRNA的表达 Figure 1The mRNA expressions of exogenous FUT7 gene were determined by RT-PCR |
Western blot定量分析表明,与未转染组相比,稳转组细胞的FUT7蛋白表达量明显增 加(P<0.01),而稳转空质粒组则无明显变化 (P>0.05),表明EGFP-FUT7融合蛋白已在转染细 胞中表达,见图2;并且稳转组细胞sLeX蛋白表达量 明显高于未转染组和转染空质粒组(P<0.01)。
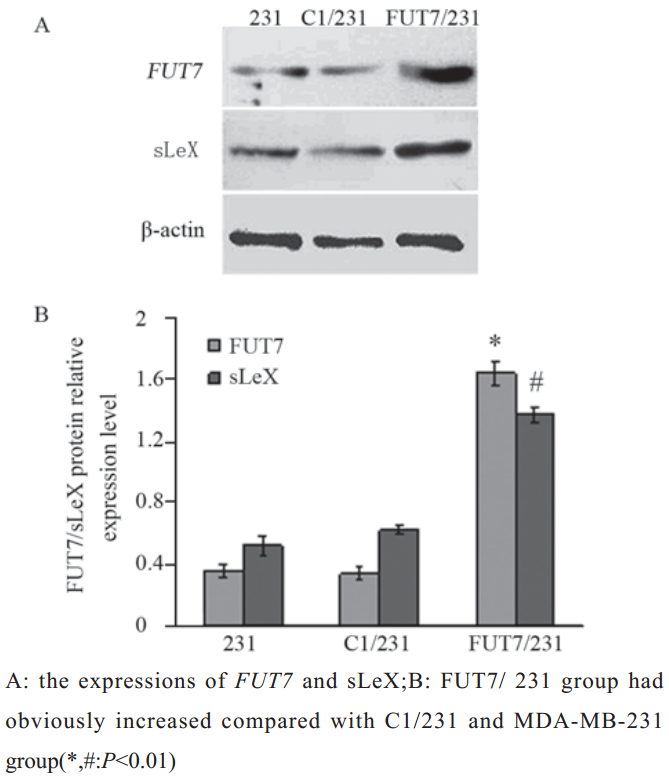 |
图2Western blot法分析FUT7和sLeX蛋白表达 Figure 2The expressions of FUT7and sLeX were analyzed by Western blot |
荧光显微镜可见231组细胞黏附率为55.29%,C1/231组黏附率为55.69 %,FUT7/231组对TNF-α刺激的HUVECs黏附率上升为73.99 %,见图3。说明外源性FUT7的表达促进了MDA-MB-231细胞与HUVECs的黏附。2.4 过表达FUT7对乳腺癌细胞迁移能力的影响
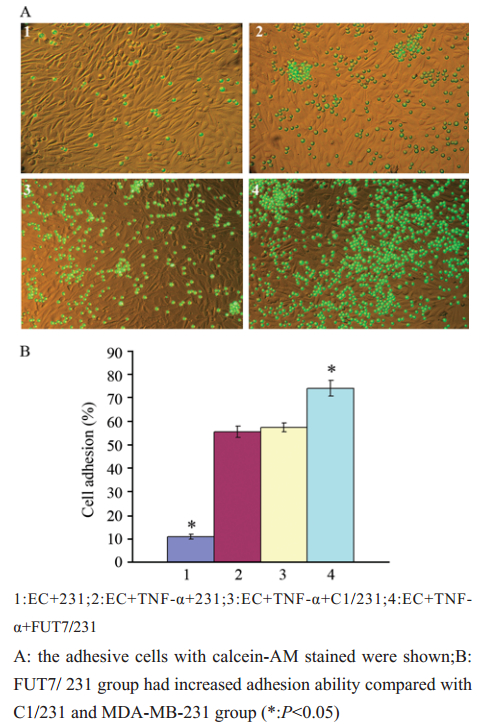 |
图3过表达FUT7对乳腺癌细胞黏附能力的影响 Figure 3Effect of overexpression of FUT7 on the abilities of adhesion in breast cancer |
荧光染料DiI标记各组细胞后,转染FUT7后肿瘤细胞迁移HUVECs能力的变化,见图4。结果显示,FUT7/ 231组细胞迁移活化HUVECs的能力增强,迁移细胞数为26.53±0.76,与C1/231组及MDA-MB-231组分别为(20.53±0.42、19.2±0.53)相比差异有统计学意义(P<0.05)。表明过表达FUT7可增强MDA-MB-231细胞的迁移能力。
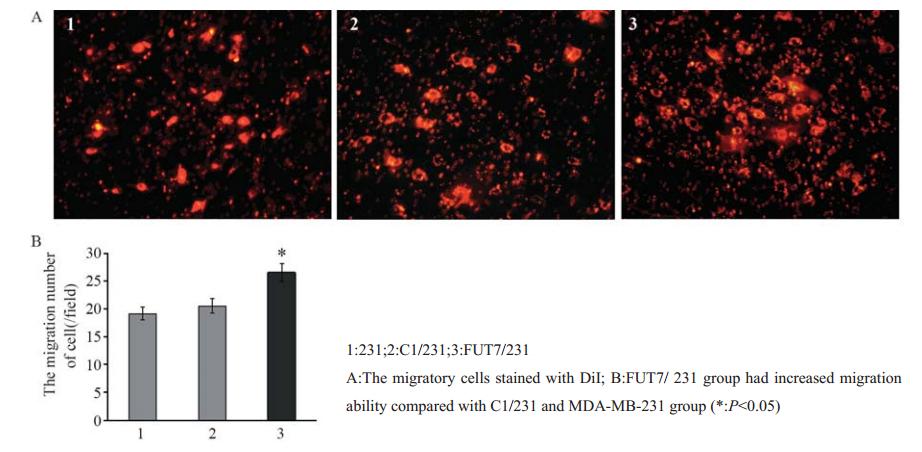 |
图4过表达FUT7对乳腺癌细胞迁移能力的影响 Figure 4Effect of overexpression of FUT7 on the abilities of migration in breast cancer |
研究表明,黏附、迁移和侵袭等肿瘤细胞的恶性行为与细胞表面特定的糖链结构或糖基有关[5]。在肿瘤转移过程中,肿瘤细胞与血管内皮细胞的相互黏附是导致肿瘤器官特异性转移的最复杂、最重要的环节,而血管内皮细胞E-selectin与其配体肿瘤细胞表面的sLeX介导的初始黏附在很大程度上决定了转移的器官选择性[7]。目前普遍认为,很多肿瘤细胞都分泌sLeX[8],并参与介导肿瘤的血道转移,sLeX阳性也是肿瘤具有较高侵袭性的一个生物学特征。FUT7是一种终末糖基转移酶,仅催化唾液酸化的Lewis抗原岩藻糖基化生成sLeX,使糖链的加工终止,糖链的结构不再改变,是研究单个糖基功能的良好工具。
在许多上皮性肿瘤的发生过程中,由于岩藻糖基转移酶基因表达失常,导致细胞表面聚糖结构发生变化,其中之一就是形成含有唾液酸和Fuc基团的抗原决定簇,如sLeX[9]。研究显示FUT7及其产物通过对细胞黏附、迁移和侵袭的影响而对肝癌细胞H7721的转移能力起至关重要的作用[9]。本研究发现过表达外源FUT7后FUT7表达明显增加,并催化sLeX合成增加,从而增强sLeX介导的MDA-MB-231细胞与内皮细胞的黏附能力。Zhang等[10]用糖苷外切酶除去肝细胞H7721表面葡聚糖的唾液酸和岩藻糖残基可使细胞迁移分别降低44% 和11%;而由FUT7过表达引起的sLeX表达上调可以导致细胞迁移能力增强[11],这个发现与我们实验结果相类似。但这种迁移内皮细胞能力的增强是直接由FUT7的上调表达介导,还是继发于激活趋化因子与相应的受体结合引发的下游信号改 变,我们尚不清楚,对此有待于进一步研究。
| [1] | Seales EC, Jurado GA, Brunson BA, et al. Hypersialylation of β1 integrins,observed in colon adenocarcinoma, may contribute to cancer progression by up-regulationg cell motility[J].Cancer Res,2005, 65(11): 4645-52. |
| [2] | Liu F, Zhang Y, Zhang XY, et al. Transfection of the nm23-H1 gene into human hepatocarcinoma cell line inhibits the expression of sialyl Lewis X, alpha1,3 fucosyltransferase VII , and metastatic potential[J]. J Cancer Res Clin Oncol, 2002, 128(4): 189-96. |
| [3] | Lowe JB. Glycan-dependent leukocyte adhersion and recruitment in inflammation[J]. Curr Opin Cell Biol, 2003, 15(5): 531-8. |
| [4] | Takigawa T, Tsurushima H, Suzuki K, et al. Cilostazol suppression of arterial intimal hyperplasia is associated with decreased expression of sialyl Lewis X homing receptors on mononuclear cells and E-selectin in endothelial cells[J]. J Vasc Surg, 2012, 55(2): 506-16. |
| [5] | Raes G, Ghassabeh GH, Brys L, et al. The metastatic T-cell hybridoma antigen/P-selectin glycoprotein ligand 1 is required for hematogenous metastasis of lymphomas[J]. Int J Cancer, 2007, 121(12): 2646-52. |
| [6] | Wagers AJ, Stoolman LM, Kannagi R, et al. Expression of leukocyte fucosyltransferases regulates binding to E-selectin: relationship to previously implicated carbohydrate epitopes[J]. J Immunol, 1997, 159(4): 1917-29. |
| [7] | Tantivejkul K, Kalikin LM,Pienta KJ.Dynamic process of prostate cancer metastasis to bone[J]. J Cell Biochem, 2004, 91(4): 706-17. |
| [8] | Qi HL, Zhang Y, Ma J, et al. Insulin/protein kinase B signalling pathway upregulates metastasis-related phenotypes and molecules in H7721 human hepatocarcinoma cell line[J]. Eur J Biochem, 2003, 270(18): 3795-805. |
| [9] | Magnani JL.The discovery,biology,and drug development of sialyl Lea and sialyl Lex[J].Arch Biochem Biophys, 2004, 426(2): 122-31. |
| [10] | Zhang Y, Zhang XY, Liu F,et al.The roles of terminal sugar residues of surface glycans in the metastatic potential of human hepatocarcinoma[J]. J Cancer Res Clin Oncol,2002, 128(11): 617-20. |
| [11] | Wang QY, Zhang Y, Shen ZH,et al. alpha 1,3 fucosyltransferaseVII up-regulates the mRNA of alpha5 integrin and its biological function[J]. J Cell Biochem, 2008, 104(6): 2078-90 |
 2014, Vol.41
2014, Vol.41



