2. 广西民族医院普外科;
3.广西中医药大学生化教研室
2. Department of General Surgery,Guangxi Nationality Hospital;
3. Department of Biochemistry, Guangxi University of Chinese Medicine
近年来,基于肿瘤特异性细胞毒性T淋巴细胞 方法[1]和血清学筛选的SEREX方法[2, 3, 4]的建立和应 用,目前己发现了许多具有开发免疫治疗前景的 肿瘤相关抗原,其中癌-睾丸(cancer-testis,CT) 抗原被认为是最具有开发前景的抗原,这是因为 CT抗原家族成员具有一个共同特性,即在广泛肿 瘤组织中有不同频率的表达,而在正常组织除睾 丸及卵巢的生殖细胞(卵母细胞)外,均呈低或 者不表达[5]。由于睾丸等生殖细胞处于免疫豁免 区,它不表达主要组织相容性复合体-Ⅰ(major histocompayibility complex-Ⅰ,MHC-Ⅰ)类分子, 虽有基因的转录但并不导致抗原的表达,故认为 CT抗原是一类广谱的肿瘤特异性抗原,也是最有 吸引力、最具开发前景的肿瘤抗原家族之一[6]。 近年来国外已将其中一些CT抗原应用于临床,如用黑色素瘤抗原编码基因(melanoma antigenencoding gene,MAGE)的抗原肽对黑色素瘤进行 免疫治疗,已收到了可喜的疗效[7]。GAGE作为CT 抗原的一种,于1995年首次被鉴定[2],目前己陆续 发现它在多种肿瘤中有着不同频率的表达。前期 研究表明GAGE基因在肝细胞癌中有较高频率的表 达[8]。为探讨GAGE蛋白在肝癌临床免疫治疗中应 用的可行性,本实验从QGY-7701肝癌细胞株扩增 GAGE-1片段,将该片段编码的蛋白进行原核表达 和分离纯化,制备较高纯度的GAGE-1融合蛋白, 为深入研究GAGE蛋白在肝癌免疫治疗中的应用提 供基本的实验依据。 1 材料和方法 1. 1 主要试剂及标本
Trizol购自Gibco BRL公司,SuperscriptTM反 转录试剂盒、限制性内切酶EcoRⅠ、NotⅠ、T4 连接酶为MBI公司产品,Taq DNA聚合酶购自 Promega公司,原核表达载体PGEX-6P-1及宿主菌 TB1为NEB产品;人肝癌QGY-7701细胞株购于中 国医学科学院上海细胞所;pGEM-T vector system 为Promega 公司产品;GST柱试剂为NEB( New England Biolabs) 产品;PCR 产物纯化试剂盒为天 为时代科技公司产品;DH5ɑ、BL21(DE3)细菌由 上海生工提供。其他常规试剂均为进口分装或国 产分析纯。 1.2 RT-PCR和PCR产物的克隆和测序
用Trizol抽提人肝癌细胞株QGY-7701中 GAGE-1表达阳性标本的总RNA,按SuperscriptTM 反转录试剂盒说明书的操作步骤,合成cDNA的 第一链,PCR扩增GAGE-1 5’端片段。GAGE-1基 因扩增正义序列:5′- AGA CGC TAC GTA GAG CCT- 3′,反义序列:5′-CCA TCA GGA CCA TCT TCA -3′,分别带有EcoRⅠ和NotⅠ酶切位 点。PCR反应条件:94℃预变性5 min后,开始以 下循环:94℃1 min→52℃1 min →72℃2 min,共 30个循环,反应终末于72℃延长8 min,4℃停止反 应。反应完毕取10 μl PCR产物行1.5%非变性琼脂 糖凝胶电泳分析,1.5%琼脂糖分离PCR扩增的特 异性片段,按试剂盒说明书纯化产物,将目的基 因亚克隆至T载体Pmd 18中,经氨卞青霉素Amp抗 性筛选阳性克隆,双酶切及PCR证实是否有相应 大小的外源片段插入,最后经上海生物工程有限 公司测序进一步证实。 1.3 pGEX-T-GAGE-1重组表达载体的构建和序列测定
EcoRⅠ和NotⅠ双酶切重组T载体和原核表达 载体pGEX-T(+),T4 DNA连接酶16℃过夜连 接,将GAGE-1片段定向克隆到pGEX-T(+)上, 连接产物转化感受态BL21(DE3)菌,Amp平板 筛选阳性克隆,经双酶切、PCR和测序鉴定,将 构建的重组质粒取名pGEX-6P-1-GAGE-1。 1.4 GAGE-1融合蛋白的诱导表达
挑取单个经重组质粒转化的菌落接种LB 培养液(含Amp150 mg/L),30℃剧烈振荡 培养至A600=0.5,加入终浓度为0.2 mMol/L 的诱导剂异丙基硫代半乳糖苷(isopropyl thiogalactoside,IPTG),30℃诱导3 h,离心收集诱 导前后菌体沉淀,SDS-PAGE电泳分析。 1.5 GAGE-1融合蛋白的大量表达及纯化
在预期相对分子量位置有高表达蛋白质条 带出现以后,用上述方法大量诱导目的蛋白的 表达。菌体用PBS重悬,超声裂解,低温离心。 上清用0.5 μm滤膜过滤后经GST纯化,先用A液 (20 mM Tris+150 mM NaCl pH8.0)充分平衡GST 柱,将离心后得到的上清过GST柱,上样后再用 A液淋洗至平衡,然后进行B液(20 mM Tris+150 mM NaCl+10 mM GSH pH8.0)洗脱,将得到的 洗脱液进一步经过superdexG75精制液(无热原1 ×PBS)洗脱,将预期相对分子量位置的洗脱液进 行SDS-PAGE电泳,凝胶薄层扫描分析蛋白纯度, Bradford方法定量分析蛋白浓度,-70℃保存。 2 结果 2.1 GAGE-1cDNA的获取及序列测定
PCR扩增产物经琼脂糖凝胶电泳显示大小约 251 bp的特异性单一条带,经测序分析完全正确, 与GenBank数据库(gi:914898 )对比,序列完全一 致,见图1。 2.2 pGEX-6P-1-GAGE-1表达载体的鉴定
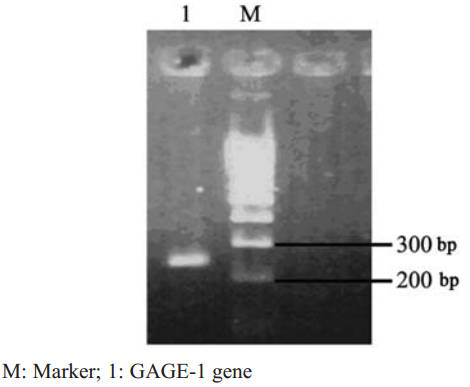 |
图1 GAGE-1基因RT-PCR扩增产物电泳图 Figure 1 The electropherogram of GAGE-1 gene by RT-PCR |
用限制性内切酶EcoRⅠ和NotⅠ双酶切将目的 基因从重组T载体克隆至原核表达载体pGEX-6P-1 (+)中,经双酶切和PCR鉴定,可见得到两条与预 期相对分子质量相符合的条带,载体和目的基因的 相对分子质量分别为4.9 Kb及0.251 Kb,见图2。 2.3 目的蛋白的表达和纯化
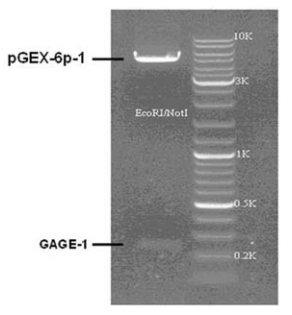 |
图 2 GpGEX-6P-1 /GAGE-1重组质粒PCR和酶切分析 Figure 2 PCR and restriction analysis of pGEX-6P-1/ GAGE-1 recombinant plasmid |
转化重组质粒的大肠杆菌经IPTG诱导,裂解 后进行SDS-PAGE分析,得到一条分子量约35.7 kD 的条带,符合除去GST 蛋白(约26 kD)后251 bp片 段所编码的氨基酸的相对分子质量9.7 kD,见图3~6,蛋白纯度达90%以上。将上一步得到的洗脱 液经过SuperdexG75精制,只有一个峰,分瓶收样 (F1-F5),F1和F2是峰尖以前的部分,比较干净, 其余部分舍弃。将收集的F1和F2进行电泳,结果 得到了比较纯的条带,见图6。
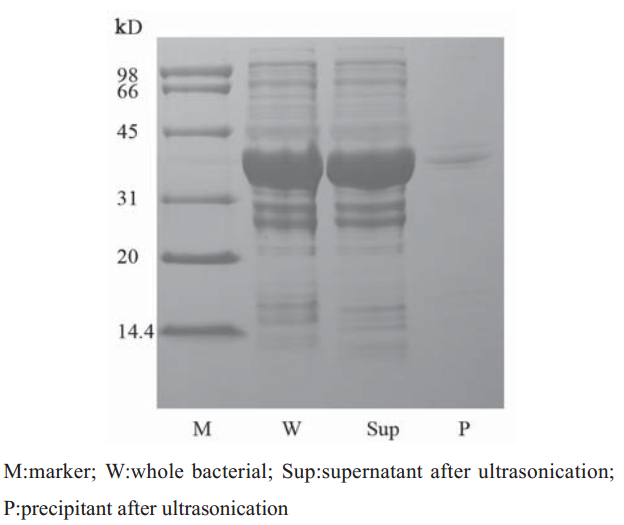 |
图 3 重组质粒破菌后过柱前电泳图 Figure 3 The electropherogram of recombinant plasmid broken bacteria prior to the column transiting |
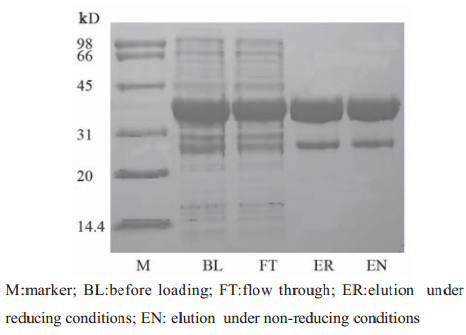 |
图 4 重组质粒破菌后过GST柱纯化电泳图 Figure 4 The electropherogram of recombinant plasmid purified by GST |
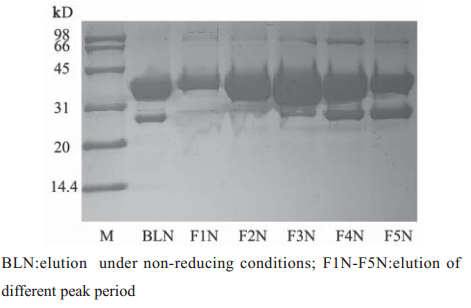 |
图 5 洗脱液经过SuperdexG75精制后电泳图 Figure 5 The electropherogram of the eluent purified by SuperdexG75 |
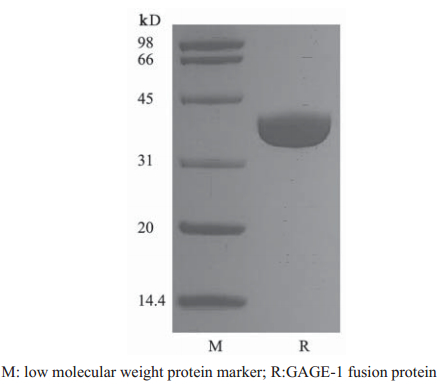 |
图 6 GAGE-1融合蛋白亲和层析纯化后电泳图 Figure 6 The electropherogram of GAGE-1 fusion protein purification by affinity chromatography |
近年来,随分子生物学、免疫学、基因工程 技术等多学科的交叉发展,以及多种肿瘤抗原的陆续发现,肿瘤免疫治疗已经成为国际上肿瘤治 疗的热点之一 。肿瘤免疫治疗的关键是找到肿瘤 相关或肿瘤特异性抗原。GAGE基因属于癌-睾丸 抗原之一,于1995年首次被鉴定[2]以来已陆续发 现GAGE基因至少包含十几个以上的家族成员。 GAGE基因的功能目前还不明确,但已证实其在多 种肿瘤中有不同频率的表达。GAGE蛋白因可引起 机体产生细胞和体液免疫,被认为是目前免疫原 性较强的肿瘤抗原之一而备受关注[9]。
本研究运用GAGE-1引物从人肝癌细胞株 QGY-7701中扩增GAGE-1 5'端251 bp片段,接着将 GAGE基因克隆至原核表达载体pGEX-6P-1中,酶 切及测序鉴定正确后转化BL21(DE3)表达菌, 通过IPTG诱导表达,经GST柱纯化,最终获得GSTGAGE-1融合蛋白。本实验发现,初次过GST柱的 蛋白杂带较多,可能是由于GST-GAGE-1融合蛋白 少部分发生了降解,从而产生了分子量介于GST 和GAGE-1之间的降解产物。为了得到比较纯化的 GST-GAGE-1融合蛋白,实验进一步将非还原型洗 脱液通过SuperdexG75精制,然后分瓶收集不同峰 段的洗脱液,发现F1和F2是峰尖以前的部分,比较 干净,其余部分舍弃,接着将收集的F1和F2进行电 泳分析,得到比较纯化的GST-GAGE-1融合蛋白。
实验选用BL21(DE3)大肠杆菌作为宿主细 胞对目的基因进行原核表达,主要是考虑BL21 (DE3)缺乏纯化过程中降解蛋白的lon蛋白酶和 ompT外膜蛋白酶,所表达的目的蛋白有较高的稳 定性。表达出来的蛋白经多次优化后,仍以不溶 性的包涵体形式存在,为使其恢复生物学活性, 继而采用透析法复性,将变性的蛋白质经过透 析,通过逐渐降低外透液浓度,缓慢去除变性剂 使目的蛋白恢复到正常的折叠结构[10]。本实验所 表达的蛋白含GST标签,通过GST亲和层析可以方 便得到较高纯度的融合蛋白。
前期研究表明GAGE基因在广西肝细胞癌中有 较高频率的表达,且在一些AFP阴性肝癌中出现 GAGE阳性表达的现象[8],但GAGE是否参与肝癌 细胞的增殖、转移、凋亡等过程,目前尚未见报 道。由于反义核酸、突变体及载体的制备相对困 难,技术也较为复杂,使GAGE在临床诊断和治疗 的实际应用价值还难以实现。因此,利用基因工 程的方法在BL21(DE3)大肠杆菌中进行诱导表 达,制备并纯化出GAGE-1融合蛋白有一定的研究 和应用价值。本研究将进一步验证纯化的GAGE-1 融合蛋白的免疫原性,并进一步探讨通过添加免 疫佐剂等方法来提高GAGE-1蛋白的临床疗效。此 外,还拟将GAGE-1融合蛋白作为肝癌相关抗原致 敏树突状细胞,继而观察后者诱导的特异性CTL 对肝癌细胞的杀伤作用。故本实验表达的融合蛋 白为进一步研究GAGE-1抗原在肝癌免疫治疗中的 作用奠定了实验基础。
| [1] | Boon T, Coulie PG, Van den Eynde B. Tumor antigens recognized by T cells[J].Immunol Today,1997,18(6):267-8. |
| [2] | Sahin U, Tureci O, Schimitt H, et al.Human neoplasms elicit multiple specific immune responses in the autologous host[J].Proc Natl Acad Sci U S A,1995,92(25):11810-3. |
| [3] | Sahin U, Tureci O, Pfreundschhuh M. Serological identification of human tumor antigens[J].Curr Opin lmmunol, 1997, 9(5):709-16. |
| [4] | J?ger D,Stockert E,GüreAO,et al.Identification of tissue specific putative transcription factou in breast tissue by serological screening of breast cancer library[J].Cancer Res,2001,61(5):2055-61. |
| [5] | Zhao FL,Li LZ,Luo GR,et al.Tumor with Cancer-testis antigen GAGE[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2009,25(6):565-7.[赵飞兰,李立志,罗国容,等.癌-睾丸抗原GAGE 与肿瘤[J]. 细胞与分子免疫学杂志,2009,25(6):565-7.] |
| [6] | Wang F, Fan R, Xie XX. Cancer-testis antigen: the new target for nervous system tumor's immunotherapy[J].Zhong Liu Fang Zhi Yan Jiu,2007,34(2):154-6.[王峰, 范蓉, 谢小薰. CT抗原—神经系 统肿瘤免疫治疗的新靶向[J]. 肿瘤防治研究,2007,34(2):154-6.] |
| [7] | Marchand M, van Baren N, Weynants P, et al. Tumor regressions observed in patients with metastatic melanoma treated with an antigenic peptide encoded by gene MAGE-3 and presented by HLA-A1[J].Int J Cancer,1999, 80(2):219-30. |
| [8] | Zhao FL,He SJ,Li P,et al. mRNA expression and clinical significance of cancer-testis antigen GAGE gene in hepatocellular carcinoma[J]. Zhonghua Gan Zang Bing Za Zhi,2006,14(8): 605-6.[赵飞兰,何少健,黎鹏,等.癌-睾丸抗原GAGE基因mRNA 在肝细胞癌的表达及临床意义[J].中华肝脏病杂志, 2006,14(8): 605-6.] |
| [9] | Eichmüller S,Usener D,Thiel D,et al. Tumor-specific antigens in cutaneous T-cell lymphoma:expression and sero-reactivity[J].Int J Cancer,2003,104(4):482-7. |
| [10] | Zhang WM,Xiao G,Zhang M,et al. The prokaryotic expression, purification and preliminary application of human NY-ESO-1 gene[J].Zhongguo Zhong Liu Lin Chuang, 2005,32(11): 631-4.[张文敏,肖刚,张萌,等.人NY-ESO-1基因的原核表达、纯 化和初步应用[J].中国肿瘤临床,2005,32(11):631-4.] |
 2014, Vol.41
2014, Vol.41

