2.河北省磁县医院消化内 科;
3.新乡医学院癌症研究中心;
4.三全医学院
2.Department of Gastroenterology, Cixian Hospital;
3.Cancer Research Center, Xinxiang Medical University;
4.San Quan Medical College
淋巴结转移对食管癌患者生存期有明显影 响,转移阳性患者生存期明显差于转移阴性的患 者[1, 2],淋巴结转移已被认为是判断食管癌患者生 存期的重要指标之一。但是,高低发区食管癌患 者淋巴结转移的影响因素及其与生存期的关系尚 不清楚。本研究旨在通过分析食管癌高、低发区 食管癌患者的生存期及淋巴结转移影响因素,探 讨淋巴结转移及其影响因素对高、低发区食管癌 患者生存期的影响,并对新版食管癌TNM分期标 准将淋巴结转移个数(N1:1~2个区域淋巴结转 移,N2:3~6个区域淋巴结转移,N3:>6个区域 淋巴结转移)作为评定标准进行评价,加深对食 管癌关键预后影响因素的了解。 1 资料与方法 1.1 研究人群
14 132例有病理诊断和淋巴结转移记录食管癌 患者(90%以上的患者均抽取空腹静脉血样)来自 食管癌重点开放实验室生物样品资料库,确诊时 间在1973—2011年间,其中高发区患者8 995例, 低发区5 137例,高低发区患者比例为1.8:1;淋巴 结转移阳性患者5 930例,转移阴性患者8 202例, 比例为0.7:1;男性8 870例,女性5 262例,男女比 例为1.7:1,平均诊断年龄为(59.5±8.5)岁,其中男 性为(59.3±8.5)岁,女性为(59.9±8.4)岁。 1.2 人群随访
采用入户或电话问卷调查,对上述患者进行 生存随访,末次随访时间为2013年3月。成功随访 13 605例,随访率为96%。所有随访的患者中非食 管癌死亡的患者39人,其中3人死于肠梗阻,7人 死于意外事故,20人死于心脑血管疾病,9人死于 自杀。 1.3 相关标准定义 1.3.1 淋巴结转移阳性标准
至少检出一个阳性食 管癌组织转移淋巴结,判断为淋巴结转移阳性。 1.3.2 高低发区标准
依据中国食管癌流行病学 调查结果,调整年龄与死亡率,死亡率在50/10万 以上的地区为高发区。区域划分参照《食管癌》[3] 一书。 1.4 统计学方法
采用SPSS18.0对数据进行处理,高、低发区食 管癌患者不同性别、年龄、病理特征淋巴结转移阳 性率和N分级差异采用卡方检验;二元Logistic回归 分析筛选影响淋巴结转移的相关因素;生存时间按 年计算,Kaplan-Meier法和Log rank分析单因素条 件下患者生存状况,Cox风险比例模型筛选影响生 存期的独立因素,检验水准为α<0.05。 2 结果 2.1 淋巴结切除数目及转移数量对高、低发区食 管癌患者生存期的影响
淋巴结切除总数分为以下3组:1~5个、6~11 个和12个及以上,随着淋巴结切除总数的增加, 患者生存期渐差(χ2 =32.5,P=8.6E-8),两两比 较,切除1~5个组的患者明显优于切除6~11个组及 12个及以上组的患者,切除6~11个组的患者明显 优于切除12个及以上组的患者(P=0.002)。
淋巴结转移阳性食管癌患者的生存期 明显差于淋巴结转移阴性患者(χ2 =737.7, P=1.9E-162),见图1A。随着淋巴结转移个数 的增加食管癌患者生存期明显降低,N1、N2 和N3级食管癌患者生存期依次降低且差异明显 (χ2 =89.3,P=4.2E-20),见图1B。
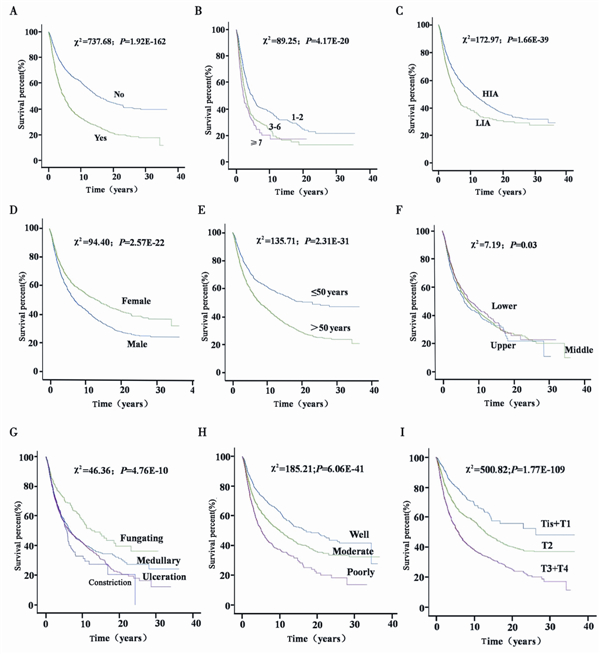 | A:lymph node metastasis; B:the number of positive lymph nodes; C:high- and low- incidence area; D:male and female; E:age at diagnosis; F:tumor locations; G:Tumor gross types; H:differentiation; I:T stage 图1 食管癌患者各临床特征的生存曲线 Fig.1 Overall survival curves of various clinical characteristic in esophageal cancer patients |
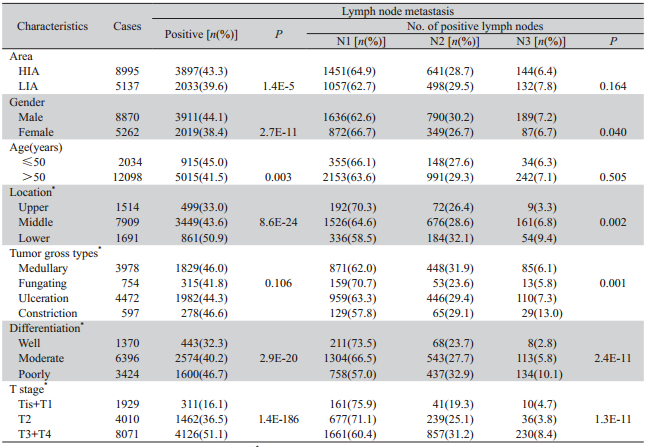
高发区食管癌患者淋巴结转移阳性率明显高 于低发区(χ2 =18.9,P=1.4E-5),高发区N1级患 者高于低发区而N2和N3级患者低于低发区(N1: 64.9% vs.62.7%;N2:28.7% vs.29.5%;N3:6.4% vs.7.8%;χ2 =3.6,P=0.2),但两者间差异无统计学 意义。男性患者淋巴结转移阳性率明显高于女性 (χ2 =44.4,P=2.7E-11),男性N1级患者明显低于 女性,而N2和N3级患者则高于女性(N1:62.6% vs. 66.7%;N2:30.2% vs.26.7%;N3:7.2% vs.6.7%; χ2 =6.4,P=0.04)。青年食管癌患者(≤50)淋巴结 转移阳性率明显高于中老年患者(>50)(χ2 =8.9, P=0.003),青、中、老年N1、N2和N3级患者比例 差异无统计学意义(χ2 =1.4,P=0.5),见表1。
上、中、下段食管癌患者淋巴结转移阳性率 依次升高且差异显著(33.0% vs. 43.6% vs. 50.9%; χ2 =106.2,P=8.6E-24),N2和N3级患者的比例 依次升高(χ2 =17.4,P=0.002)。中晚期食管癌 4种大体类型(髓质型、蕈伞型、溃疡型和缩窄 型)淋巴结转移阳性率无统计学意义(χ2 =6.1, P=0.1),蕈伞型N1级患者所占比例高于其他三 种类型(62.0% vs.70.7 % vs.63.3 % vs.57.8%), 缩窄型N3级患者所占比例高于其他3型(6.1% vs. 5.8% vs.7.3% vs.13.0%)。随着分化程度的降低 食管癌患者淋巴结转移阳性率依次升高(32.3% vs.40.2% vs.46.7%,χ2 =90.0,P=2.9E-20), N2和N3级患者所占比例依次升高(χ2 =55.6, P=2.4E-11)。随着浸润程度的加深食管癌患者 淋巴结转移阳性率依次升高(Tis+T1 vs.T2 vs. T3+T4:16.1% vs.36.5% vs.51.1%;χ2 =855.8, P=1.4E-186),且N2和N3级患者所占比例依次升 高(χ2 =56.8,P=1.3E-11),见表1。
|
|
表1 食管癌患者临床特征与淋巴结转移关系 Table 1 Relationship between clinical features and lymph node metastasis in patients with esophageal cancer |
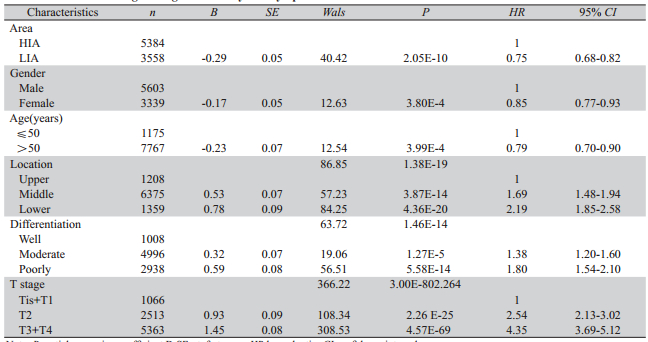
二元Logistic 回归分析(P进入=0.05,P剔除 =0.10),各项资料均齐全的8 942例病例最终进入 分析模型,结果显示:高低发区、性别、诊断年 龄、肿瘤部位、分化程度和肿瘤浸润程度均与淋 巴结转移有关,其中高发区、男性和诊断年龄≤ 50是淋巴结转移的危险因素,中下段食管癌淋巴 结转移风险值较上段高,随着分化程度的降低和 浸润程度的加深淋巴结转移风险值依次升高,见 表2。
|
|
表2 淋巴结转移的多因素Logistic回归分析 Table 2 Multivariate Logistic regression analysis of lymph node metastasis |
高发区食管癌患者生存期明显优于低发区患 者(χ2 =173.0,P=1.7E-39),见图1C,女性食 管癌患者生存期明显优于男性患者(χ2 =94.4, P=2.6E-22),见图1D,青年食管癌患者(≤50) 生存期明显高于中老年患者(>50)(χ2 =135.7, P=2.3E-31),见图1E,下段食管癌患者生存 期优于中段和上段患者,上段患者生存期最差 (χ2 =7.2,P=0.03),见图1F,中晚期食管癌4种 大体类型(髓质型、蕈伞型、溃疡型和缩窄型) 蕈伞型生存期优于其他三种类型,缩窄型生存期 最差(χ2 =46.4,P=4.8E-10),见图1G,随着分 化程度降低和浸润程度加深食管癌患者生存期依 次降低,高分化食管癌患者生存期明显优于中低 分化患者(χ2 =185.2,P=6.1E-41),见图1H, Tis+T1食管癌患者生存期明显优于T2和T3+T4级患 者(χ2 =500.8,P=1.8E-109),见图1I。
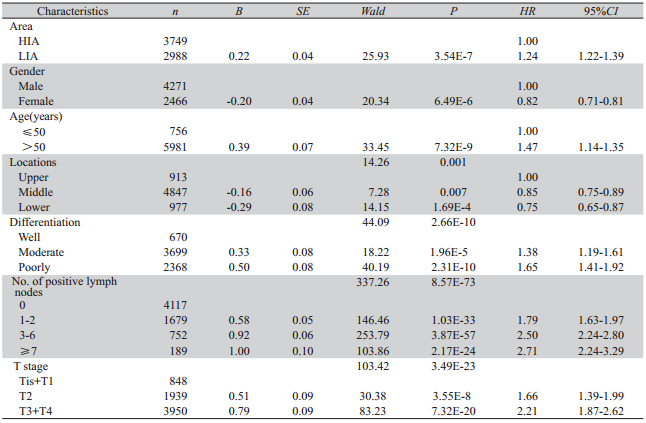
多因素Cox风险比例模型分析(P进入=0.05,P剔除 =0.10),各项资料均齐全的6 737例病例最终进入分 析模型,结果显示:性别、高、低发区、诊断年 龄、肿瘤部位、淋巴结转移、分化程度和肿瘤浸 润程度均是影响食管癌患者生存期的独立因素, 其中女性、高发区、诊断年龄≤50岁和无淋巴结 转移是食管癌生存期长的保护因素,而分化程度 降低、淋巴结转移增多和浸润程度加深是食管癌 生存期差的危险因素,见表3。
|
|
表3 食管癌患者生存期的多因素Cox风险比例回归模型检验 Table 3 Survival of patients with esophageal cancer detected by multivariate Cox proportional hazards regression model |
淋巴结转移是食管癌关键预后指标之一。本 研究发现,淋巴结阳性转移的食管癌患者生存期 明显差于转移阴性的患者。淋巴结转移是肿瘤恶 性程度的一种表现形式。本研究发现高发区食管 癌患者淋巴结转移阳性率高于低发区患者,但是 生存期明显优于低发区患者。高发区居民对疾病 早诊早治的意识,诊疗水平和政府的重视程度等 因素并不能完全解释高发区患者生存期优于低发 区患者,环境因素本身也可能是导致这种差异的 重要原因之一,进一步了解这一机制对食管癌的 治疗具有重要意义。青年食管癌患者淋巴结转移 阳性率高于中老年患者,然而生存期却显著优于 中老年患者。这可能与青年患者机体耐受力和免 疫力优于中老年患者,中老年患者易罹患其他疾 病有关,患病后患者的心理差异也可能是一重要 原因。本研究发现下段食管癌淋巴结转移阳性率 明显高于中段和上段,在转移数量上,下段2个 以上淋巴结转移的患者所占比例明显高于中段和 上段患者,提示下段食管癌最易发生淋巴结肿瘤 转移,然而下段食管癌患者生存期优于中段和上 段患者,多因素分析肿瘤部位是淋巴结转移和生 存期的独立影响因素,这可能是下段食管癌手术 操作较中上段容易,淋巴结清扫较中上段彻底有 关。由于研究资料中缺少肿瘤转移的区域淋巴结 位置,本研究尚未对食管癌最易发生肿瘤转移的 引流区淋巴结进行分析,这也是我们下一步工作 需继续完善的地方。
本研究发现中晚期食管癌4种大体类型淋巴 结转移阳性率相似,但各类型淋巴结转移数量有 差异,蕈伞型N1级患者所占比例高于其他三种类 型,而缩窄型N3级患者所占比例高于其他三种类 型。4种大体类型中蕈伞型患者生存期明显优于其 他三种,缩窄型生存期最差。多因素分析食管癌 肿瘤大体类型不是影响淋巴结转移和生存期的独 立因素。
随着肿瘤分化程度的降低和浸润程度的加 深,淋巴结转移阳性率明显升高,N2和N3级患者 所占的比例也依次升高,患者的生存期明显依次 降低。多因素分析肿瘤分化程度和浸润深度是影 响淋巴结转移和患者生存期的独立因素。
近年来,淋巴结转移数目对食管癌生存期的 影响受到越来越多的关注。大量研究发现,食管 癌患者预后与淋巴结转移数目负相关[2, 4, 5, 6, 7]。本研 究根据食管癌新版TNM分期N分期标准将食管癌 患者按淋巴结转移个数分为N1、N2、N3三组, 食管癌患者生存期依次明显下降。将淋巴结转移 数目加入TNM分期建议确有必要性。淋巴结转移 的数目与外科手术和病理医师的检查密切相关。 目前,临床上对于食管癌手术清扫淋巴结部位和 数目尚无统一的标准,病理医师在对手术标本进 行检查时由于考虑到患者的经济状况等原因,转 移的淋巴结存在漏诊和漏检的情况,很难对患者 预后做出准确判断。在我国食管癌的治疗以手术 治疗为主,规范淋巴结清扫的部位和数目尤为重 要。结肠癌研究中增加淋巴结切除数量可以增加 阳性淋巴结比率,但是存在一个恰当的点[8]。淋巴 结属于机体免疫屏障,过多的切除淋巴结势必会 破坏这种免疫屏障,本研究,淋巴结切除总数越 多患者生存期越差,动物实验也发现切除荷瘤小 鼠的区域淋巴结,肿瘤发生明显的生长[9]。笔者认 为一定程度上增加淋巴结切除数量有利于食管癌 患者预后,至少切除多少淋巴结不影响食管癌患 者预后而阳性淋巴结检出率最高,是我们研究组 正在进行的研究工作。
本研究还发现,性别是影响食管癌淋巴结转 移和生存期的独立因素。女性食管癌患者淋巴结 转移阳性率显著低于男性患者,2个以上淋巴结转 移的患者所占比例明显低于男性。女性食管癌患 者生存期显著优于男性。性别间的这种差异提示 女性患者自身可能存一种食管癌抵抗因素。本研 究组前期研究和其他实验室研究均提示,雌激素 可能是食管癌发生的重要保护因素之一[10, 11]。
综上所述,淋巴结转移和转移数量是影响食 管癌患者生存预后的独立因素,而性别、年龄、 高、低发区、肿瘤部位、肿瘤分化程度和浸润深 度也是影响淋巴结转移和生存的独立因素,进一 步探讨和制定食管癌手术淋巴结清扫数量和部 位,对食管癌的治疗具有重要意义。
| [1] | Zhang HL,Chen LQ,Liu RL,et al.The number of lymph node metastases influences survival and International Union Against Cancer tumor-node-metastasis classification for esophageal squamous cell carcinoma [J].Dis Esophagus, 2010, 23 (1):53-8. |
| [2] | Kawahara K,Maekawa T,Okabayashi K,et al.The number of lymph node metastases influences survival in esophageal cancer [J].J Surg Oncol,1998,67 (3):160-3. |
| [3] | Henan Medical College.Esophageal cancer[M]. Beijing:People’s Health Publishing House,1983:36. [河南医学院.食管癌[M]. 北京:人民卫生出版社,1983:36.] |
| [4] | Rizk N, Venkatraman E, Park B, et al. The prognostic importance of the number of involved lymph nodes in esophageal cancer: implications for revisions of the American Joint Committee on Cancer staging system [J]. J Thorac Cardiovasc Surg, 2006, 132 (6):1374-81. |
| [5] | Tachibana M, Kinugasa S, Yoshimura H, et al. Clinical outcomes of extended esophagectomy with three-field lymph node dissection for esophageal squamous cell carcinoma [J]. Am J Surg, 2005, 189 (1):98-109. |
| [6] | Kimura H,Konishi K,Arakawa H,et al.Number of lymph node metastases influences survival in patients with thoracic esophageal carcinoma: therapeutic value of radiation treatment for recurrence[J]. Dis Esophagus,1999,12 (3):205-8. |
| [7] | Greenstein AJ,Litle VR,Swanson SJ,et al.Prognostic significance of the number of lymph node metastases in esophageal cancer[J]. J Am Coll Surg,2008,206 (2):239-46. |
| [8] | Baxter NN,Ricciardi R,Simunovic M,et al.An evaluation of the relationship between lymph node number and staging in pT3 colon cancer using population-based data[J].Dis Colon Rectum, 2010, 53 (1):65-70. |
| [9] | Kanayama H, Izumi A, Osaki Y, et al. Effect of regional or distant lymph node removal and of splenectomy on immunologic responses in Ehrlich tumor-bearing mice[J]. Jpn J Surg, 1982, 12 (5):381-6. |
| [10] | Wang QM, Qi YJ, Jiang Q,et al. Relevance of serum estradiol and estrogen receptor beta expression from a high-incidence area for esophageal squamous cell carcinoma in China[J]. Med Oncol, 2011, 28 (1):188-93. |
| [11] | Bodelon C,Anderson GL,Rossing MA, et al.Hormonal factors and risks of esophageal squamous cell carcinoma and adenocarcinoma in postmenopausal women[J]. Cancer Prev Res (Phila),2011,4 (6):840-50 |
 2014, Vol. 41
2014, Vol. 41