2. 南通大学附属医院心胸外科
2. Department of Cardiothoracic Surgery, Affi liated Hospital of Nantong University
肺癌是一种严重威胁人类健康的疾病,已成 为我国首位肿瘤死亡病因[1, 2],探索和研究肺癌 诊断和治疗的新方法与新策略,是一项紧急的任 务,藉此提高肺癌患者生存率,改善预后[3, 4]。 microRNAs(miRNAs)是近年来肿瘤领域的研究热 点[5]。现已发现miRNA在肿瘤的发生发展中发挥 关键作用[6]。miRNA-182是2003年发现的miRNA 家族的成员,有24个碱基序列,其与肿瘤增殖和 凋亡密切相关,行使着“癌基因”功能[7, 8]。在多种 肿瘤患者中,可以检测到异常表达的miR-182,但 miR-182与肺癌的关系少有报道。
本研究检测miR-182在肺癌细胞中的表达情 况,并观察miR-182对靶基因PFN1表达以及对肺 癌细胞生物学特性的影响,为肺癌治疗提供新方 法和新策略。 1 材料与方法 1.1 主要试剂
人肺癌细胞株A549、95-D以及正常支气管 上皮细胞HBE 购自中国科学院细胞库。胎牛血 清、DMEM 培养液、F12K培养液、RPMI1640培 养液、L-谷氨酰胺、Lipofectamine 2000购自美国 Invitrogen公司。
TaqMan miRNA Isolation Kit、TaqMan microRNA Assay kit和TaqMan microRNA Assay and TaqMan Universal PCR Master Mix 购自于Applied Biosystems公司。miR-182抑制剂(miRIDIAN microRNA Hairpin inhibibitor)和阴性对照(a nontargeting sequence)购自Dharmacon公司。
胰蛋白酶、磷酸盐缓冲液( P B S ) 、 MTT [3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-diphenytetrazoliumromide] 购自美国Sigma-Aldrich公 司。细胞培养板或培养皿、Transwell 侵袭小室 购自Corning公司。Matrigel胶购自BD Bioscience 公司。Annexin Ⅴ和碘化丙啶(propidium iodide, PI)购自Roche公司。兔抗人PFN1多克隆抗体和小 鼠抗人β-actin单克隆抗体购自英国Abcam公司。二 抗为IRDye 800 conjugated affi nity purifi ed goat antimouse IgG和IRDye 800 conjugated affinity purified goat anti-rabbit IgG购自Odyssey公司。蛋白抽提及 定量试剂盒购自Bio-Rad公司。pGL3-Lueiferase载 体、荧光素酶检测试剂盒购自美国Promega公司。 1.2 方法 1.2.1 人肺癌细胞株的培养
HBE细胞用含10% 胎牛血清的DMEM 培养 液,在37℃、5%CO2饱和湿度条件下进行培养。 A549细胞培养于含2 mM L-谷氨酰胺和10%胎牛 血清的F12K培养液中,在37℃、5% CO2饱和湿度 条件下进行培养。95-D(高转移肺癌细胞)细胞 培养于含10%胎牛血清的RPMI1640培养液中,在 37℃、5% CO2饱和湿度条件下进行培养。倒置显 微镜下观察细胞生长状态,细胞生长呈70%~80% 融合时,以0.25%胰蛋白酶消化传代,隔日换液, 每3~4天传代1次。收集对数生长期细胞进行实 验。 1.2.2 qRT-PCR法检测miR-182在肺癌细胞中的表 达情况
收集体外培养的A549、95-D和HBE细胞, 以TaqMan miRNA分离试剂盒提取RNA,采用 TaqMan microRNA Assay和TaqMan Universal PCR Master Mix来检测miR-182的表达,以U6作为内 参基因。所有反应均设立3个复孔。记录每个反 应管中标本的CT 值, 实验结果采用qRT-PCR中 的相对定量法进行分析, 以2-ΔΔCT表示肺癌细胞 中miR-182表达量相对于HBE细胞表达量的变化 倍数,其中ΔΔCT=(CTmiR-182-CTU6)Lung cancer cell- (CTmiR-182-CTU6)HBE。 1.2.3 检测肺癌细胞中转染miR-182抑制剂对 miR-182表达的影响
正常培养的95-D细胞,以3×105个/毫升均 匀接种于6孔培养板,每孔体积1 000 μl。待细 胞贴壁后,按Lipofectamine 2000转染说明书进 行miR-182抑制剂(miR-203 inhibitor)和阴性对 照(negative control)的转染。同时设正常对照组 (untransfected)。转染48 h。以TaqMan miRNA分离 试剂盒分别提取各组细胞的RNA,采用qRT-PCR 方法检测各组细胞中miR-182表达变化。 1.2.4 MTT法检测miR-182对细胞活力的影响
正常培养的95-D细胞, 以3×105个/ 毫升 均匀接种于96孔培养板,每孔体积100 μl。按 Lipofectamine 2000转染说明书进行miR-182抑制剂 和阴性对照的转染。同时设正常对照组。转染48 h 后,每孔加 100 μl MTT(0.5 mg/ml)溶液,放入 37℃、5% CO2培养箱中培养4h。每孔加入100 μl 20% SDS(助溶剂50%二甲基甲酰胺),37℃作用 24 h。酶标仪(美国Bio-Tek公司)于570nm处测 定OD值。在每个实验组设10个复孔,实验重复3 次。 1.2.5 流式细胞仪检测miR-182对细胞增殖的影响
正常培养的95-D细胞,以3×105个/毫升均 匀接种于6孔培养板,每孔体积1 000 μ l。按 Lipofectamine 2 000转染说明书进行miR-182抑制剂 和阴性对照的转染。同时设正常对照组。转染48 h后,PBS清洗细胞1~2次,胰蛋白酶消化细胞, PBS清洗细胞2次后,离心收集细胞,加入PI染 液,4℃避光标记30 min,筛网过滤后,流式细胞 仪分析(美国BD公司)检测,FCM cellQuest软件 计数细胞,Macquit软件分析数据。 1.2.6 流式细胞仪检测miR-182对细胞凋亡的影响
细胞转染miR-182抑制剂和阴性对照 48 h后, PBS清洗细胞1~2次,加入Annexin Ⅴ-FITC和PI染 液,室温避光标记15 min,筛网过滤后,流式细胞 仪分析(美国BD公司)检测,FCM cellQuest软件 计数细胞,Macquit软件分析数据。 1.2.7 Transwell侵袭小室检测miR-182对细胞迁移 的影响
正常培养的95-D细胞,以3×105个/毫升均 匀接种于6孔培养板,每孔体积1 000 μ l。按 Lipofectamine 2000转染说明书进行miR-182抑制剂 和阴性对照的转染。同时设正常对照组。将转染 24 h后95-D细胞接种于Transwell侵袭小室,正常条 件培养24 h后,PBS清洗细胞1~2次,0.1%结晶紫 染色。Leica显微镜下计数穿过Transwell聚碳酸酯 膜的细胞数。穿过Transwell聚碳酸酯膜的细胞为 侵袭的细胞,随机观察8个视野。 1.2.8 荧光素酶报告基因系统检测PFN1基因
构建荧光素酶质粒:化学合成包含有与相应 miR-182互补结合的靶基因PFN1 3’-UTR序列片 段,将包含预测miR-182结合位点的PFN1 3’-UTR 的片段克隆进pGL3-Lueiferase载体的XbaⅠ位点。
正常培养的95-D细胞,以3×105个/毫升均匀接 种于6孔培养板,每孔体积1 000 μl。共转染包含 PFN1 3’-UTR的荧光素酶质粒,以及miR-182抑制 剂或阴性对照。同时设正常对照组。转染48 h后 收集细胞并使用荧光素酶试剂盒检测,酶标仪读 数。
相同的转染方法,转染48 h后,收集各组细胞 蛋白,采用Western blot 法测定细胞中PFN1蛋白表 达。
6孔细胞培养板,每孔加入1 ml的RIPA 裂解液 [150 mM NaCl,1% NP40,0.5% sodium deoxycholate, 0.1% SDS,50 mM Tris (pH 7.9),10 mM NaF,10 mM PMSF and 1×protease inhibitors (Complete cocktail tablets,Roche)],将细胞裂解液转移至1.5 ml离心 管,16 000g离心30 min,取上清液,用BCA法测 上清蛋白浓度。灌制5%的浓缩胶和15%的分离 胶,每泳道加总蛋白量50 μg,进行电泳分离,经 湿转印到PVDF 膜上(Bio-Rad公司,美国),在含 有5%脱脂奶粉的TBST(10 mM Tris–HCl,pH7.5, 150 mM NaCl,和0.1% Tween-20)溶液中常温封闭 1 h,然后分别加入兔抗人PFN1多克隆抗体(1:500 稀释)及小鼠抗人β-actin单克隆抗体(1:1 000稀释), 4℃孵育过夜,然后加入IRDye 800相应标记的二 抗(1:2000稀释于PBS), 4℃孵育过夜,TBST 洗涤,Odyssey红外成像系统(Rockland公司)扫 描。PFN1的相对含量用PFN1/β-actin灰度比值表 示,灰度采用QuantityOne软件(Bio-Rad公司,美 国)分析。 1.3 统计学方法
采用SPSS17.0 统计分析软件对实验数据进行统 计学处理,两组比较采用t检验,两组以上数据比较 用方差分析。以P<0.05表示差异有统计学意义。 2 结果 2.1 miR-182在人肺癌细胞中的表达情况
qRT-PCR的结果显示:miR-203在肺癌细胞系 A549、95-D中的表达显著高于其在HBE细胞中的 表达(P<0.01),见图 1A。
 |
图 1miR-182的表达检测及对细胞活力的影响 Figure 1The expression of miR-182 and effects of miR-182 on cell viability A: the expression of miR-182 in lung cancer cells A549,95-D and normal human bronchial epithelial cell (HBE),**:P<0.01 versus HBE group; B: the miR-182 inhibitor affected the expression of miR-182 in lung cancer cell 95-D,**:P<0.01 versus untransfected group; C: the MTT assay results indicated the role for miR-182 on the viability of 95-D cells,*:P<0.05 versus untransfected group |
前一个研究结果显示:miR-182在高转移性 肺癌细胞95-D中表达水平最高,因此以下就选择 95-D细胞进行进一步研究。通过在95-D 细胞中转 染miR-182抑制剂,抑制miR-182表达。qRT-PCR 的结果显示:miR-182抑制剂转染组中miR-182的 表达显著低于正常对照组(untransfected)(P<0.01)。 结果见图 1B。 2.3 miR-182对细胞活力的影响
MTT分析结果显示:miR-182抑制剂转染组中 细胞活力低于正常对照组(untransfected)(P<0.05)。 结果见图 1C。结果说明,抑制miR-182的表达降低 了细胞活力。 2.4 miR-182对细胞增殖的影响
增殖指数(proliferation index,PI)=(S+G2M)/ (G0G1+S+G2M)。流式细胞仪分析结果显示: miR-182抑制剂转染组中细胞增殖指数低于正常对 照组(untransfected)(P<0.05),见图 2A。
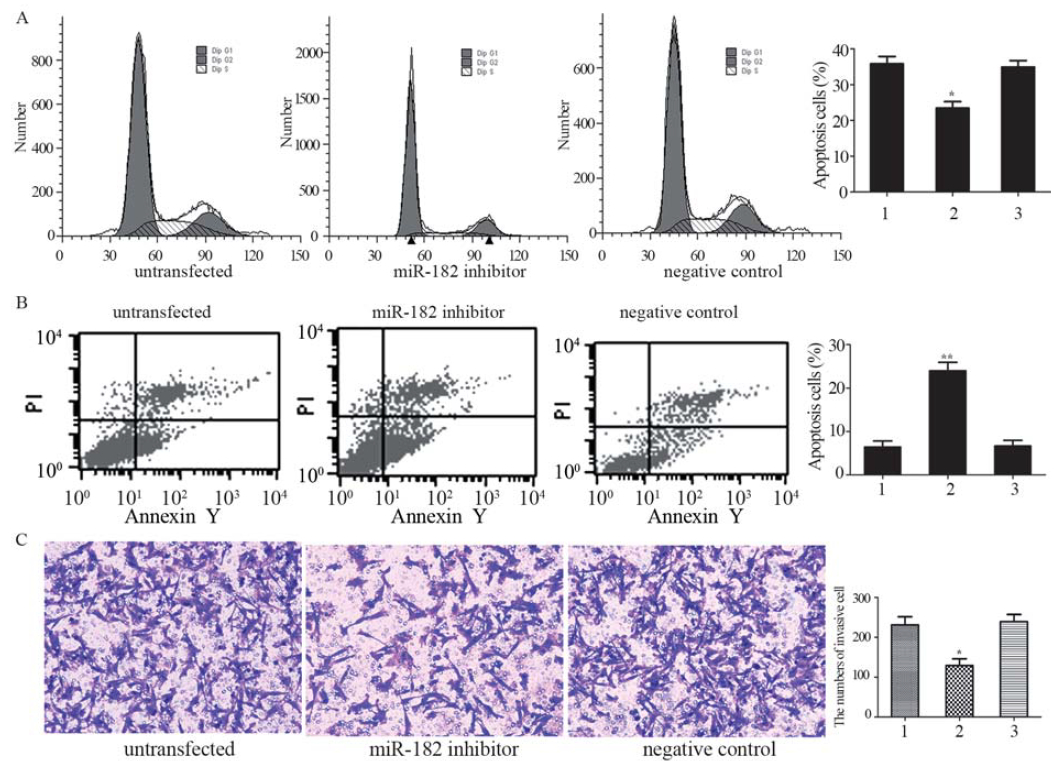 |
图 2miR-182对细胞增殖、凋亡和迁移的影响 Figure 2Effects of miR-182 on cell proliferation,apoptosis and migration A: the flow cytometry assay suggests a role of miR-182 in cell proliferation of 95-D cell,*:P<0.05 versus untransfected group; B: the role for miR-182 in apoptosis suggested by fl ow cytometry results,**:P<0.01 versus untransfected group?? C: Transwell chamber assay revealed the role of miR-182 in cell migration,*:P<0.05 versus untransfected group;1:untransfected;2:miR-182 inhibitor;3:negative control |
流式细胞仪分析结果显示:miR-182抑制剂 转染组中凋亡细胞百分比显著高于正常对照组 (untransfected)(P<0.01),见图 2B。结果说明,抑制 miR-182表达促进了细胞凋亡。 2.6 miR-182对细胞侵袭的影响
95-D细胞转染miR-182抑制剂和阴性对照 48h后,Transwell侵袭小室检测各组细胞侵袭 能力的变化。结果显示:转染miR-182抑制剂 后,穿过Transwell小室的95-D细胞数明显降低 (P<0.05)。说明了抑制miR-182表达,抑制了 95-D细胞的侵袭,见图 2C。 2.7 荧光素酶报告基因系统检测结果
为了验证miR-182的预测靶点位于PFN1 3’-UTR,我们构建包含PFN1 3’-UTR的荧光素酶 质粒并将其与miR-182抑制剂和阴性对照共转染 95-D细胞。结果表明与正常对照组(untransfected) 相比,miR-抑制剂转染组中质粒的荧光素酶活性 明显降低(P<0.05),见图 3。结果表明miR-182 直接作用于PFN1 3’-UTR的预计靶位点。Western blot检测结果显示:miR-182抑制 剂转染组中PFN1蛋白的表达显著高于正常对照 组(untransfected)(P<0.05),见图 3。结果说明, miR-182的表达抑制了PFN1蛋白的表达。
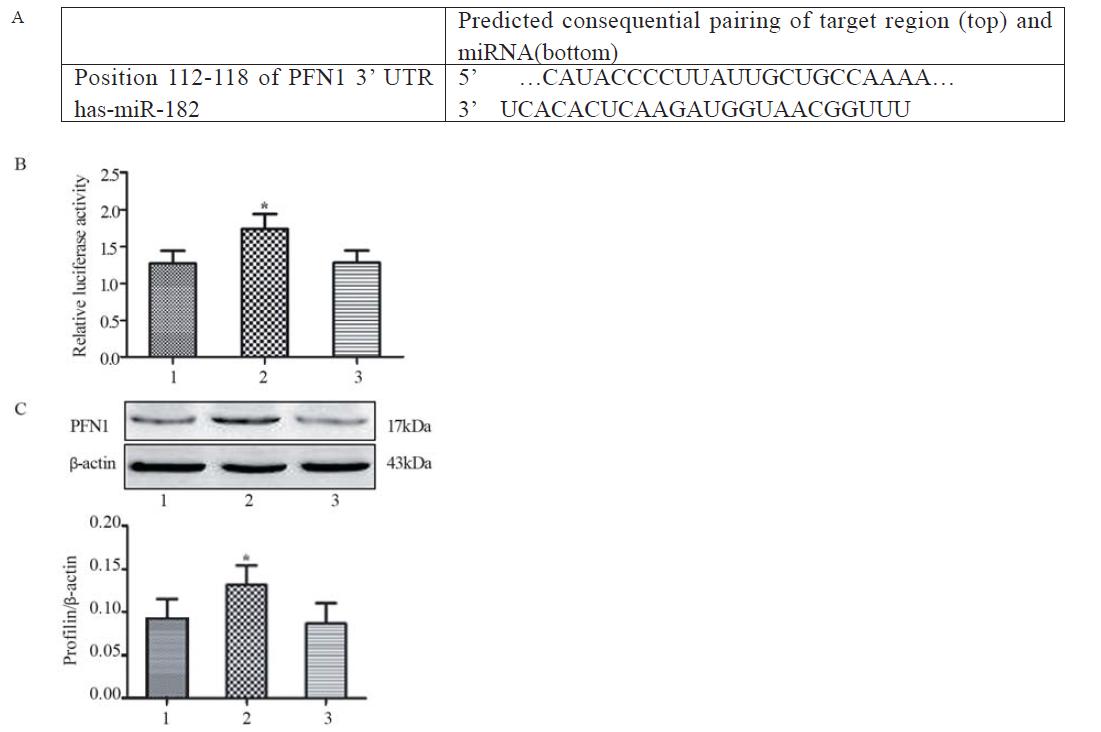 |
图 3荧光素酶报告基因系统检测miR-182的靶基因及PFN 蛋白表达的检测 Figure 3The target gene of miR-182 and the expression of PFN1 protein were tested luciferase reporter gene system A: the putative miR-182 target site within the PFN1 3’-UTR was depicted; B: the statistical result of relative luciferase activity; C: Western blot depicted PFN1 protein expression in each group of 95-D cell,*P<0.05 versus untransfected group;1:untransfected;2:miR-182 inhibitor;3:negative control |
以往的研究表明miRNA在肿瘤发生发展中 起重要作用[9]。研究表明在肿瘤发生发展过程中 miRNAs出现异常表达[10]。在癌症发生发展中能直 接促进肿瘤形成的miRNAs,发挥着类似致癌基因 功能因而被称为致癌miRNAs,如Xu等[11]研究发 现,miR-96在结肠癌中表达上调,并与结肠癌的 肝转移相关。与此相反,在肿瘤中呈低表达或表 达缺如的miRNAs,通常发挥类似肿瘤抑制基因 功能而被称为抑癌miRNAs。Bueno等[12]研究发现 miR-203具有肿瘤抑制功能,为特定的造血系统恶 性肿瘤的治疗提供新途径。
研究发现miR-182行使着癌基因的作用,其与 DNA损伤修复相关、调控着细胞的凋亡和增殖, 已发现其相应靶基因有FOXO1、RGS17、MITF、 FOXO3[13, 14]。在多种肿瘤中如子宫内膜癌、结肠 癌、前列腺癌、卵巢癌、恶性间皮瘤和在血液疾 病中(如淋巴瘤、骨髓纤维化等患者血液中), 均可以检测到异常上调的miR-182[15, 16]。本研究 qRT-PCR结果显示:miR-182在肺癌细胞中的表达 显著高于其在正常人支气管上皮细胞HBE中的表 达(P<0.01),提示miR-182在肺癌中表达上调, 可能发挥着癌基因的作用。
miR-182调控着细胞的凋亡和增殖,参与调 节多条细胞内信号通路[17]。Weeraratne等[18]研究发 现,miR-182调控着成神经管细胞瘤的存活、增殖 和迁移。Kong等[19]研究结果显示:miR-182通过调 节靶基因cAMP-responsive element-binding protein 1 (CREB1)而抑制人胃腺癌细胞的生长。Poell等[20]研 究发现,miR-182可抑制人黑色素瘤细胞的活性。 在本研究中,利用MTT法、流式细胞仪分析法和 Transwell侵袭小室检测了miR-182对95-D细胞的影 响,结果显示:抑制了miR-182的表达,抑制了肺 癌细胞的活力、增殖和侵袭,促进了凋亡。
PFN1是真核细胞中广泛存在的12~15kD的小 分子蛋白质,与actin单体结合为1:1的profilin-actin 复合体调节信号依赖的actin聚合作用[21]。研究[22] 指出,PFN1参与多种细胞功能,包括细胞黏附和 运动,以及依赖于actin结合蛋白的细胞形态的构 成和维持。Zou等[23]研究结果显示:过表达PFN1 可抑制MDA-MB-231细胞的增殖。在本研究中, 通过荧光素酶报告基因系统证实PFN1是miR-182 的靶基因;Western blot结果显示:抑制了miR-182 的表达促进了PFN1蛋白的表达。因此我们推断, miR-182可能通过调节PFN1蛋白的表达,而影响 肺癌细胞的活力、增殖、侵袭和凋亡。
综上所述,miR-182在肺癌细胞中表达上调, miR-182可负性调节PFN1蛋白的表达,并抑制肺 癌细胞增殖和侵袭。抑制miR-182表达或过表达 PFN1基因的治疗策略有望使肺癌患者受益。
| [1] | Gower AC, Steiling K, Brothers JF 2nd, et al. Transcriptomic studies of the airway field of injury associated with smokingrelated lung disease[J]. Proc Am Thorac Soc, 2011, 8(2): 173-9. |
| [2] | Au WW, Su D, Yuan J. Cigarette smoking in China: public health, science, and policy[J]. Rev Environ Health, 2012, 27(1): 43-9. |
| [3] | Wu X, Chen H, Wang X. Can lung cancer stem cells be targeted for therapies? [J]. Cancer Treat Rev, 2012, 38(6): 580-8. |
| [4] | Wang Q, Wang S, Wang H, et al. MicroRNAs: novel biomarkers for lung cancer diagnosis, prediction and treatment[J]. Exp Biol Med (Maywood), 2012, 237(3): 227-35. |
| [5] | He B, Yin B, Wang B, et al. MicroRNAs in esophageal cancer (Review)[J]. Mol Med Rep, 2012, 6(3): 459-65. |
| [6] | Calin GA, Dumitru CD, Shimizu M, et al. Frequent deletions and down-regulation of micro- RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia[J]. Proc Natl Acad Sci U S A, 2002, 99(24): 15524-9. |
| [7] | Saus E, Soria V, Escaramís G, et al. Genetic variants and abnormal processing of pre-miR-182, a circadian clock modulator, in major depression patients with late insomnia[J]. Hum Mol Genet, 2010, 19(20): 4017-25. |
| [8] | Cai Y, Yu X, Hu S, et al. A brief review on the mechanisms of miRNA regulation[J]. Genomics Proteomics Bioinformatics, 2009, 7(4): 147-54. |
| [9] | Fabbri M, Bottoni A, Shimizu M, et al. Association of a microRNA/TP53 feedback circuitry with pathogenesis and outcome of B-cell chronic lymphocytic leukemia[J]. JAMA, 2011, 305(1): 59-67. |
| [10] | Zhang J, Ma L. MicroRNA control of epithelial-mesenchymal transition and metastasis[J]. Cancer Metastasis Rev, 2012, 31(3-4): 653-62. |
| [11] | Xu XM, Qian JC, Deng ZL, et al. Expression of miR-21, miR-31, miR-96 and miR-135b is correlated with the clinical parameters of colorectal cancer[J]. Oncol Lett, 2012, 4(2): 339-45. |
| [12] | Bueno MJ, Pérez de Castro I, Gómez de Cedrón M, et al. Genetic and epigenetic silencing of microRNA-203 enhances ABL1 and BCR-ABL1 oncogene expression[J]. Cancer Cell, 2008, 13(6): 496-506. |
| [13] | Xie L, Ushmorov A, Leith?user F, et al. FOXO1 is a tumor suppressor in classical Hodgkin lymphoma[J]. Blood, 2012, 119(15): 3503-11. |
| [14] | Sun Y, Fang R, Li C, et al. Hsa-mir-182 suppresses lung tumorigenesis through down regulation of RGS17 expression in vitro[J]. Biochem Biophys Res Commun, 2010, 396(2): 501-7. |
| [15] | Guan P, Yin Z, Li X, et al. Meta-analysis of human lung cancer microRNA expression profi ling studies comparing cancer tissues with normal tissues[J]. J Exp Clin Cancer Res, 2012, 31: 54. |
| [16] | Liu Z, Liu J, Segura MF, et al. MiR-182 overexpression in tumourigenesis of high-grade serous ovarian carcinoma[J]. J Pathol, 2012, 228(2): 204-15. |
| [17] | Alshalalfa M, Bader GD, Goldenberg A, et al. Detecting microRNAs of high influence on protein functional interaction networks: a prostate cancer case study[J]. BMC Syst Biol, 2012, 6:112. |
| [18] | Weeraratne SD, Amani V, Teider N, et al. Pleiotropic effects of miR-183-96-182 converge to regulate cell survival, proliferation and migration in medulloblastoma[J]. Acta Neuropathol, 2012, 123(4): 539-52. |
| [19] | Kong WQ, Bai R, Liu T, et al. MicroRNA-182 targets cAMPresponsive element-binding protein 1 and suppresses cell growth in human gastric adenocarcinoma[J]. FEBS J, 2012, 279(7): 1252-60. |
| [20] | Poell JB, van Haastert RJ, de Gunst T, et al. A functional screen identifies specific microRNAs capable of inhibiting human melanoma cell viability[J]. PLoS One, 2012, 7(8): e43569. |
| [21] | Rawe VY, Payne C, Schatten G. Profi lin and actin-related proteins regulate microfilament dynamics during early mammalian embryogenesis[J]. Hum Reprod, 2006, 21(5): 1143-53. |
| [22] | Sagot I, Rodal AA, Moseley J, et al. An actin nucleation mechanism mediated by Bni1 and profi lin[J]. Nat Cell Biol, 2002, 4(8): 626-31. |
| [23] | Zou L, Ding Z, Roy P. Profilin-1 overexpression inhibits proliferation of MDA-MB-231 breast cancer cells partly through p27kip1 upregulation[J]. J Cell Physiol, 2010, 223(3): 623 -9. |
 2014, Vol.41
2014, Vol.41


