CCL18是一种CC型的趋化因子,最早在肺 组织中被鉴定出来,来源于肺间质的巨噬细胞, 与肺纤维化相关[1],可以促进淋巴细胞[2]和树突 状细胞趋化。随着巨噬细胞在肿瘤环境中功能的 研究进展[3],CCL18被确定为肿瘤相关巨噬细胞 (TAM)的标志,大量的研究报道TAM与肿瘤 的进展相关,与肿瘤患者的预后呈负相关。但因 为在CCL18所作用的靶细胞上没有发现CCL18的 受体,阻碍了CCL18作为一种TAM的标志,在肿 瘤微环境中的作用及作用机制的研究。我们前期 系统研究了乳腺癌微环境中TAM来源的CCL18 对乳腺癌细胞的作用,在乳腺癌细胞表面鉴定出 CCL18的受体是PITPNM3,证明CCL18促进乳腺 癌浸润迁移[4]。本文进一步研究CCL18促进迁移的 机制,证明CCL18与乳腺癌SK-3rd细胞的表面受体 结合,引起细胞骨架的聚集,从而促进乳腺癌的 迁移,为靶向CCL18的乳腺癌治疗进一步提供实 验依据。 1 材料与方法 1.1 材料
利用从ATCC购买的乳腺癌SKBR3细胞系,经 过在化疗的压力下多次在小鼠乳腺癌脂肪垫下形成 移植瘤,构建SK-3rd细胞系;MDA-MB-231细胞购 自ATCC公司;Transwell培养板购于Cornimg公司; beta-actin抗体购于Cell signal 公司;CCL18抗体和 蛋白购于R&D 公司;CCL20购于美国Peprotechinc 公司;纤粘连蛋白购于美国Roche公司。
激光共聚焦显微镜购于德国Carl Zeiss 公司; 去卷积显微镜购于美国Applied Precision公司。 1.2 细胞培养
在完全培养液(含10%胎牛血清的DMEM)中培养SK-3rd和MDA-MB-231细胞。 1.3 免疫荧光
为了确定CCL18作用于乳腺癌细胞的部位, 我们在腔室玻片中用无血清培养液培养SK-3rd细 胞10 min,PBS洗涤后,用多聚甲醛固定15 min, PBST洗涤,用含有CCL18蛋白(20 ng/ml)的 PBS溶液,在4℃孵育乳腺癌细胞3 h,同时SK- 3rd细胞用人血白蛋白(ALB)溶液孵育为阴性 对照,PBST洗涤,室温下用封闭液(PBST加入 2%BSA)封闭1h。除去封闭液后,在PBST中加入 羊抗人CCL18一抗,4℃过夜。PBST洗涤后,加入 生物素标记的二抗室温孵育30 min,PBST洗涤, 再加入cy3标记的抗生物素的抗体室温孵育30 min, PBST洗涤,加入FITC标记的鬼笔环肽,室温孵育 30 min。移去腔室玻片的腔室,用重组的CCL18蛋 白孵育已经固定的乳腺癌细胞,然后用CCL18抗 体、荧光标记定位CCL18的结合部位,在激光共 聚焦显微镜下观察拍照。
在固定之前用CCL18、CCL20处理MDAMB- 231细胞10 min,然后多聚甲醛固定15 min, 用FITC标记的鬼笔环肽室温孵育30 min,加入含 有DAPI的抗粹灭剂后封片。在激光共聚焦显微镜 下拍片观察CCL18所引起的细胞骨架变化。 1.4 动态观察活细胞迁移实验
用纤粘连蛋白(40μg/ml,Fn)包被四联 板,4℃过夜后,把表达GFP的慢病毒载体转染入 MDA-MB-231细胞,用不依赖二氧化碳的培养液 (GIBCO 18045)悬浮细胞。按每孔5 000个细胞 加入四联板中,实验组加入CCL18蛋白(20 ng/ ml),以加入CCL20(20 ng/ml)和不加任何趋 化因子组为对照。经因子处理4 h后,用去卷积 显微镜上定位细胞并连续观察,每分钟拍摄一张 图片,共观察4 h,拍摄图片240张。独立实验重 复3次。 2 结果 2.1 CCL18与乳腺癌细胞膜表面的蛋白结合
结果表明:用CCL18处理乳腺癌SK-3rd细胞, CCL18抗体可以检测到结合在乳腺癌细胞膜表面的 CCL18蛋白;而CCL18抗体的同型IgG不能检测到 结合在细胞膜上的CCL18蛋白;对非相关蛋白人血 清白蛋白(ALB)处理的SK-3rd细胞,CCL18的抗 体不能在细胞膜上检测到CCL18蛋白,说明CCL18 抗体可以定位细胞膜上的CCL18结合蛋白,CCL18 可以与乳腺癌细胞表面蛋白结合,见图1。
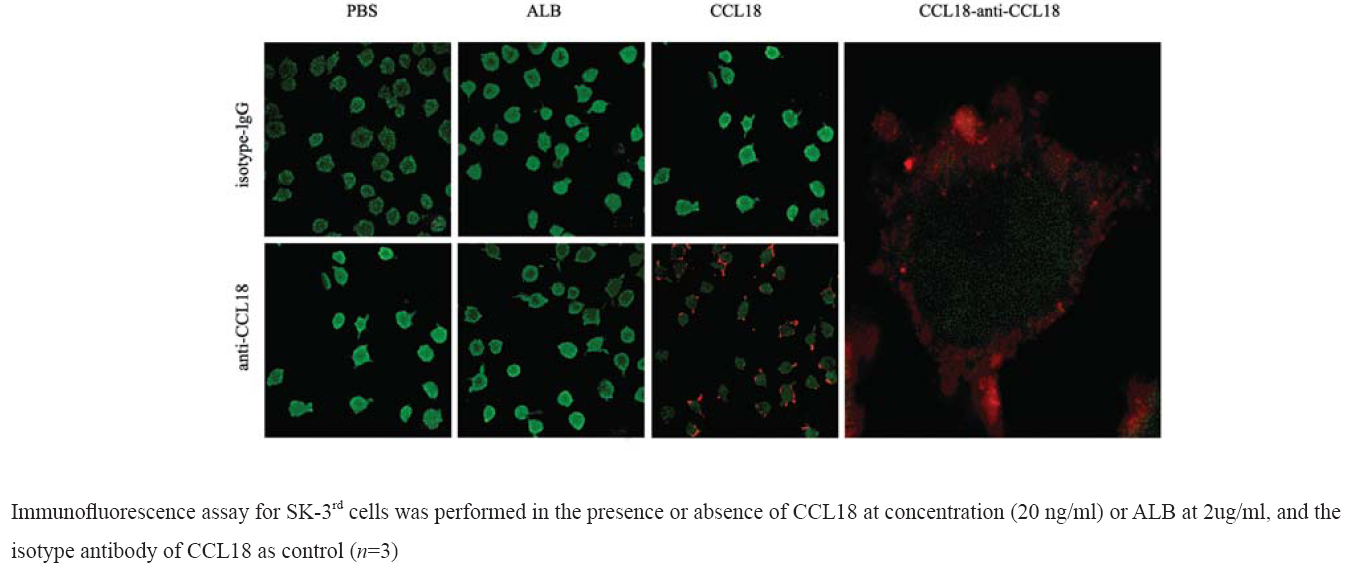 |
图1 CCL18与乳腺癌SK-3rd细胞膜表面受体结合的免疫荧光结果 Figure 1 Immunofl uorescence assay result of CCL18 binding to the membrane receptor of breast cancer cells SK-3rd |
CCL18处理乳腺癌MDA-MB-231细胞后, 细胞形成片状伪足,细胞骨架在细胞迁移的 前缘聚集,提示细胞的运动能力增强。而用 CCL18同源趋化因子CCL20处理细胞不能引起 细胞骨架的变化,说明CCL18与乳腺癌细胞表 面蛋白结合不是简单的结合,而是配体与受体 的结合,把CCL18的受体定位在乳腺癌细胞膜 表面,见图2。
 |
图2 CCL18引起乳腺癌细胞骨架聚集免疫荧光检测结果 Figure 2 Immunofl uorescence assay result of CCL18 binding to the membrane receptor of breast cancer cells MDA-MB-231 |
结果每组获得图片240张,观察到CCL18作 用4 h明显引起细胞的位移,而CCL20处理的细 胞和未处理的细胞经过4 h的观察没有明显的移 动。把每组0 h图片与4 h最后一张图片对比,证 明CCL18促进乳腺癌细胞在细胞外基质纤粘连 蛋白(Fn)上的迁移,见图3。
 |
图3 CCL18对乳腺癌MDA-MB-231细胞迁移作用动态观察结果 Figure 3 Dynamic observation on viable breast cancer cells MDA-MB-231 migration promoted by CCL18 |
趋化因子是可溶性的8~14 kDa小分子量蛋 白,根据氨基端两个保守半胱氨酸的位置把趋 化因子分为CXC、CC、CX3C和C型趋化因子[5]。趋 化因子的受体是G蛋白耦联的七次跨膜蛋白,G 蛋白由α、β、γ三个亚基组成,现在发现的有20 种α亚基,6种β亚基、12种γ亚基。多种趋化因 子共用一个受体或者一个趋化因子与多个受体相 结合以保证生物学效应的完成。趋化因子与不同 的受体相互作用可以引起不同的生物学效应[6], 激活腺苷酸环化酶(AC)和磷脂酶C(PLC)。前 者是由Gαs激活、被Gαi抑制,后者由Gαq激活。 AC作用产生cAMP,PLC产生两个第二信使二酰 基甘油和肌醇1,4,5 三羟甲基氨基甲烷磷酸盐, 前者激活蛋白激酶C,后者引起细胞内钙池中的 钙外流引发细胞内钙水平升高。进一步激活磷酸 肌醇3激酶 (PI3K)和src家族酪氨酸激酶[7],在细 胞伸展的前缘Rac和Rho互相激活和灭活,导致 细胞迁移和趋化。
肿瘤细胞和基质细胞表达的趋化因子与肿瘤 细胞表面或基质细胞表面的受体结合,通过肿 瘤细胞与基质细胞之间的自分泌和旁分泌环促进 肿瘤的进展。通过大规模的对正常乳腺组织、 原位癌、浸润癌基因表达谱的筛查,证明微环 境中肿瘤相关成纤维细胞过表达CXCL12,与肿 瘤细胞所表达的受体CXCR4作用,可以促进肿瘤的增殖、浸润和转移。乳腺癌转移的靶器官 富含趋化因子CXCL12(SDF-1),迁移的乳腺 癌细胞表达相关的受体CXCR4 ,CXCR4的中和 性抗体可以抑制实验性和自发性转移[8]。说明趋 化因子CXCR4/CXCL12轴在乳腺癌的转移过程 中起关键的作用。MDA-MB-231表达CCL2,在 鼠的模型中形成肺转移,CCL2的中和性抗体可 以抑制转移[9]。另外在进展期乳腺癌组织中高表 达CCL5,CCL5的表达水平与乳腺癌的进展相 关[10]。乳腺癌细胞表达CCL2和CCL5诱导单核细 胞浸润到肿瘤组织中[11]。肿瘤浸润的单核细胞 发育为TAMs,在CCL2、CCL5等趋化因子的作 用下分泌促肿瘤进展的因子如CCL2 、TNF-α、 MMP-9[12]促进肿瘤复发,与预后呈负相关。总 之,肿瘤细胞表达趋化因子促进单核细胞浸润肿 瘤组织,形成一个恶性循环,持续性地浸润表达 趋化因子。趋化因子介导乳腺癌细胞和基质细胞 或免疫细胞的相互作用,影响肿瘤的进展。 趋化因子及其受体在肿瘤转移中发挥重要 作用,我们的前期研究已经证明TAMs所分泌的 标志性趋化因子CCL18对乳腺癌转移有影响, 其受体是P5TPNM3[4],本文在此基础上进一步研 究CCL18在乳腺癌转移过程中的作用以及作用 机制。 近期在肿瘤细胞与巨噬细胞共培养体系中 证明,肿瘤微环境可以改变巨噬细胞的表形 使其具有促进肿瘤进展的功能[13]。本课题在已 经证明TAMs促进乳腺癌迁移的基础上,证明 TAMs通过分泌CCL18与乳腺癌细胞表面受体结 合引起细胞骨架在细胞迁移的前缘的聚集,从 而促进乳腺癌转移,为临床以CCL18为分子靶 点抑制乳腺癌迁移提供实验依据。
| [1] | Vij R, Noth I. Peripheral blood biomarkers in idiopathic pulmonary fi brosis[J]. Transl Res,2012,159(4):218-27. |
| [2] | Chenivesse C, Chang Y, Azzaoui I, et al. Pulmonary CCL18 recruits human regulatory T cells[J]. J Immunol,2012, 89(1):128-37. |
| [3] | Laoui D, Movahedi K, Van Overmeire E, et al. Tumorassociated macrophages in breast cancer: distinct subsets, distinct functions[J]. Int J Dev Biol,2011,55(7-9):861-7. |
| [4] | Chen J, Yao Y, Gong C, et al. CCL18 from tumor-associated macrophages promotes breast cancer metastasis via PITPNM3[J]. Cancer cell,2011,19(4):541-55. |
| [5] | Zlotnik A, Yoshie O. Chemokines: a new classifi cation system and their role in immunity [J]. Immunity,2000,12(2):121-7. |
| [6] | Devalaraja MN, Richmond A. Multiple chemotactic factors: fine control or redundancy?[J] Trends Pharmacol Sci,1999,20(4):151-6. |
| [7] | Rot A, von Andrian UH. Chemokines in innate and adaptive host defense: basic chemokinese grammar for immune cells [J]. Annu Rev Immunol,2004,22:891-928. |
| [8] | Müller A,Homey B,Soto H,et al.Involvement of chemokine receptors in breast cancer metastasis[J].Nature,2001,410(6824):50-6. |
| [9] | Salcedo R, Ponce ML, Young HA, et al. Human endothelial cells express CCR2 and respond to MCP-1: direct role of MCP-1 in angiogenesis and tumor progression[J]. Blood,2000,96(1): 34-40. |
| [10] | Niwa Y, Akamatsu H, Niwa H, et al. Correlation of tissue and plasma RANTES levels with disease course in patients with breast or cervical cancer[J]. Clin Cancer Res,2001,7(2):285-9. |
| [11] | Mira E, Lacalle RA, González MA, et al. A role for chemokine receptor transactivation in growth factor signaling[J]. EMBO Rep,2001,2(2):151-6. |
| [12] | Azenshtein E, Luboshits G, Shina S, et al. The CC chemokine RANTES in breast carcinoma progression: regulation of expression and potential mechanisms of promalignant activity[J]. Cancer Res,2002,62(4):1093-102. |
| [13] | Hagemann T, Wilson J, Kulbe H, et al. Macrophages induce invasiveness of epithelial cancer cells via NF-kappa B and JNK[J]. J Immunol,2005,175(2):1197-205. |
 2014, Vol.41
2014, Vol.41
