前列腺癌是老年男性常见的肿瘤,在过去的 几十年里,雄激素被看作是前列腺癌的重要促进 因子,是前列腺癌的病因之一。 因此,雄激素阻 断治疗(androgen deprivation therapy,ADT)成为 前列腺癌的常规治疗[1, 2]。然而,大多数前列腺癌 在ADT后变为雄激素非依赖性前列腺癌(androgen independent prostate cancer,AIPC)[3],肿瘤侵袭性 更强,更容易转移 [4, 5]。前列腺癌初治应用ADT有 效,逐渐转为AIPC的机制目前仍不清楚,不表达 雄激素受体的前列腺肿瘤干细胞(cancer stem cells, CSCs)选择性存活也许是AIPC的成因。因为其独 特的生物学特性,肿瘤干细胞抵抗放疗 [6]、化疗 和激素治疗 [7, 8, 9, 10, 11]。 本课题拟研究雄激素阻断治疗对前列腺癌组 织中肿瘤干细胞的影响,以CD44和整合素α2β1作 为前列腺肿瘤干细胞标志,探讨激素非依赖性前 列腺癌的形成机制。 1 资料与方法 1.1 患者资料
18例前列腺癌病理石蜡切片,包括术前前列 腺穿刺活检病理及根治性前列腺切除术后的肿瘤 病理。其中,9例在根治性前列腺切除前接受3个 月的ADT。此外,还检测2例去势术后5年和7年后 重复穿刺的病理切片(未手术),共20例患者的 标本。 1.2 免疫组织化学
(1)石蜡切片脱蜡至水。(2)1.5%H2O2 室 温孵育10 min,消除内源性过氧化物酶活性。 PBS 清洗5 min×2次。(3)10%山羊血清孵育1 h。 (4)加入PE标记的抗-CD44单克隆抗体 (10 μl/ml, Novus Biologicals,LLC. Littleton) 和FITC标记的 抗-整合素α2β1单克隆抗体 (10 μl/ml,Life Span Bioscience,Seattle) 37°C 孵育1 h。PBS洗涤5 min× 3次。(5)防淬灭封片剂封片。(6)荧光显微镜 观察CD44和整合素α2β1的表达。蓝色为DAPI细胞 核染色,标记细胞核;红色为CD44阳性细胞;绿 色为整合素α2β1阳性细胞;橙色为CD44和整合素 α2β1双阳性细胞; CD44和整合素α2β1阳性部位均 定位于细胞膜。 1.3 统计学方法
观察5个高倍视野(40倍),计数细胞不少于 1 000个,比较术前术后标本中CD44和整合素α2β1 双阳性细胞比例的平均值,作 t 检验,P<0.05为差 异有统计学意义。 2 结果
18例前列腺癌组织均可见CD44和整合素α2β1 表达。在非ADT治疗组,前列腺癌组织(穿刺 活检标本)含有(3.56±1.33)% (n=9)的CD44和整 合素α2β1双阳性细胞,根治性前列腺切除后,该 组前列腺癌组织(根治切除标本)中CD44和整 合素α2β1双阳性细胞增加至 (3.78±1.39)% (n=9, t=-0.686,P=0.512),治疗前后双阳性细胞比例差 异无统计学意义。 在ADT治疗组,ADT开始前的 前列腺癌组织(穿刺活检标本)含有(3.44±1.81)% (n=9)的CD44和整合素α2β1双阳性细胞,患者接 受3月的ADT后,在根治性前列腺切除获得的前 列腺癌组织中CD44和整合素α2β1双阳性细胞增加 至 (9.22±1.71)% (n=9,t=-6.353,P=0.000)。结果提 示ADT治疗后,CD44和整合素α2β1双阳性细胞显 著增加。除此之外,接受5年和7年ADT治疗后, 穿刺标本中CD44和整合素α2β1双阳性细胞增至 18.7%,比初诊时穿刺标本平均比例增加4.3倍,见 图1A、1B。在癌旁组织中,ADT同样增加了CD44 和整合素α2β1双阳性细胞比例,见图1C、1D。提 示雄激素阻断也使正常的前列腺组织的前列腺干 细胞比例增加。术前穿刺肿瘤标本与术后切除肿 瘤标本中CD44和整合素α2β1双阳性细胞比例变化, 见图2。
 |
图1 雄激素阻断治疗后前列腺癌组织及癌旁组织干细胞比例的变化 Figure 1 The change of the proportion of stem cells in prostate cancer tissues and peritumoral tissues after ADT (IHC ×20 ) |
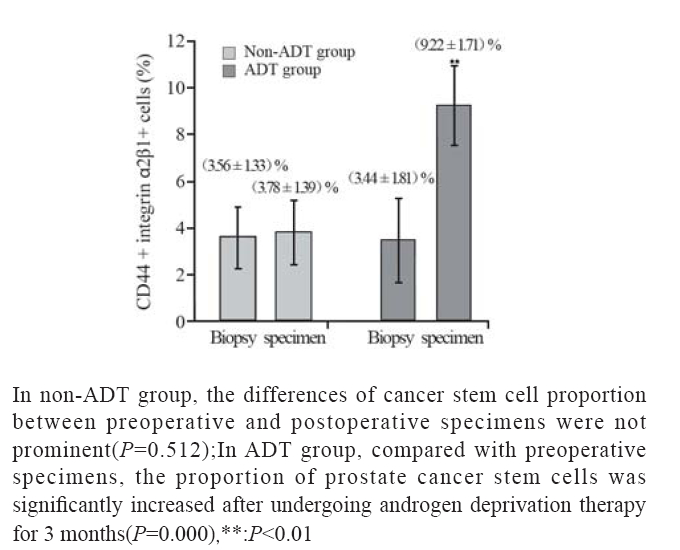 |
图2 ADT治疗后前列腺癌组织中CD44和整合素α2β1双阳 性细胞比例的变化 Figure 2 The change of the proportion of CD44+ integrinα 2β1+ cells in prostate cancer tissue after ADT |
前列腺癌由激素依赖性转为激素非依赖性的 机制尚不清楚。激素非依赖性前列腺癌(AIPC) 的形成可能与长期的雄激素阻断使最初占少数的 前列腺肿瘤干细胞或祖细胞比例逐渐增加,占据 大多数比例有关。Collins等[12, 13]认为,前列腺癌 肿瘤干细胞既不表达雄激素受体(AR),也不对 雄激素受体发生反应。只有分化好的腺腔细胞表 达AR并对雄激素发生反应。雄激素阻断后,对雄 激素有反应性的分化好的腺腔细胞被杀灭,而对 其无反应的前列腺肿瘤干细胞可在低雄激素环境 中存活下来。由此,AIPC可能是相对未分化的前 列腺肿瘤干细胞或祖细胞占多数的细胞群。研究 证明,CD44与整合素α2β1联合,可作为前列腺干 细胞和前列腺肿瘤干细胞的标志物[12, 13]。本课题检测了雄激素阻断治疗(ADT)前后前列腺组织 和前列腺癌组织中的干细胞标志物CD44和整合素 α2β1。结果显示,ADT治疗后,前列腺干细胞标 志物CD44 和 整合素 α2β1阳性细胞较治疗前比例 增高。这提示,雄激素可能参与前列腺肿瘤干细 胞或正常前列腺中前列腺干细胞的分化。 Liu[14] 等 报道,CD44 和 整合素 α2β1在 AIPC 细胞系 PC3 和 DU145高表达 。在我们之前的研究中 [15],Du145 细胞系中肿瘤干细胞比例较原发瘤高。 以上研究 结果均提示AIPC可能与前列腺肿瘤干细胞和雄激 素水平变化有关。因此,研究更佳的治疗方案若 能调整雄激素水平,控制肿瘤干细胞,则对延缓 AIPC的形成,改善患者的预后具有重要意义。
| [1] | Labrie F, Dupont A, Cusan L, et al. Combination therapy with flutamide and medical (LHRH agonist) or surgical castration in advanced prostate cancer: 7-year clinical experience[J]. J Steroid Biochem,1990,37(6):943-50. |
| [2] | Huggins C, Hodges CV. Studies on prostatic cancer: I. The effect of castration, of estrogen and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate. 1941.[J]. J Urol,2002,168(1):9-12. |
| [3] | Macfarlane RJ, Chi KN. Research in castration-resistant prostate cancer: what does the future hold?[J]. Curr Oncol,2010,17 Suppl 2: S80-6. |
| [4] | Scher HI, Halabi S, Tannock I, et al. Design and end points of clinical trials for patients with progressive prostate cancer and castrate levels of testosterone: recommendations of the prostate cancer clinical trials working group[J]. J Clin Oncol,2008,26(7):1148-59 |
| [5] | Heidenreich A, Aus G, Bolla M, et al. EAU guidelines on prostate cancer[J]. Eur Urol,2008,53(1):68-80. |
| [6] | Pajonk F, Vlashi E, McBride WH. Radiation resistance of cancer stem cells: the 4 R’s of radiobiology revisited[J]. Stem Cells,2010,28(4):639-48. |
| [7] | Silvestre DC, Pineda JR, Hoffschir F, et al. Alternative lengthening of telomeres in human glioma stem cells[J]. Stem Cells,2011,29(3):440-51. |
| [8] | Taipale J, Beachy PA. The Hedgehog and Wnt signalling pathways in cancer[J]. Nature, 2001,411(6835):349-54. |
| [9] | Rizzo S, Hersey JM, Mellor P, et al. Ovarian cancer stem celllike side populations are enriched following chemotherapyy and overexpress EZH2[J]. Mol Cancer Ther,2011,10(2):325-35. |
| [10] | Wei J, Barr J, Kong LY, et al. Glioblastoma cancer-initiating cells inhibit T-cell proliferation and effector responses by the signal transducers and activators of transcription 3 pathway[J]. Mol Cancer Ther,2010,9(1):67-78. |
| [11] | Kawasaki BT, Mistree T, Hurt EM, et al. Co-expression of the toleragenic glycoprotein, CD200, with markers for cancer stem cells[J]. Biochem Biophys Res Commun,2007,364(4):778-82. |
| [12] | Collins AT, Berry PA, Hyde C, et al. Prospective identifi cation of tumorigenic prostate cancer stem cells[J]. Cancer Res,2005,65(23): 10946-51. |
| [13] | Collins AT, Habib FK, Maitland NJ, et al. Identification and isolation of human prostate epithelial stem cells based on alpha(2)beta(1)-integrin expression[J]. J Cell Sci,2001,114(Pt21): 3865-72. |
| [14] | Liu AY. Differential expression of cell surface molecules in prostate cancer cells[J]. Cancer Res,2000, 60(13):3429-34 |
| [15] | Wei C,Guomin W,Yujun L,et al.Cancer stem-like cells in human prostate carcinoma cells DU145:the seeds of the cell line?[J]. Cancer Biol Ther,2007,6(5):763-8. |
 2014, Vol.41
2014, Vol.41



