2.安徽医科大学第一附属医院泌尿外科;
3.安徽医科大学第二附属医院泌尿外科
2.Department of Urology, The First Affiliated Hospital of Anhui Medical University;
3.Department of Urology, The Second Affi liated Hospital of Anhui Medical University
膀胱癌是我国最常见的肿瘤之一,中国肿瘤 登记地区统计数据表明,我国的膀胱癌发病率呈 进行性上升,尤其在城市男性人口中,膀胱癌的 发病率持续数年稳居第六位,年标化发病率高达 13.7/105[1]。膀胱癌患者中90%为尿路上皮癌,其中 初发患者的70%为非肌层浸润性肿瘤(non-muscleinvasive bladder cancer,NMIBC),通过经尿道电 切和术后即刻灌注化疗药物获得治愈,但仍有20% 的高危NMIBC患者术后需要灌注卡介苗(Bacillus Calmette-Guérin ,BCG)等免疫刺激剂预防肿瘤的 复发与进展[2]。
人巨细胞病毒(human cytomegalovirus, HCMV)属于疱疹病毒的双链DNA病毒,是一种 条件病原体,在人群中普遍存在HCMV潜伏感染。 当宿主免疫力下降时,可诱发HCMV活动性感染。 近年来,HCMV感染与人类肿瘤的发生与发展之间 的关系引起人们的关注[3],但HCMV活动性感染与尿 路上皮癌患者的免疫功能的相关研究较少。本研究 通过检测33例患者的T细胞亚群和HCMV-IgG、IgM 抗体状态,了解两者之间的影响,为尿路上皮癌患 者的术后辅助治疗提供指导意见。 1 资料与方法 1.1 资料 1.1.1 病例资料
男24例,女9例;年龄35~85(58.2±13.2) 岁;初发患者23例,复发患者10例;有吸烟习惯者 22例;有饮酒习惯者9例;血尿33例;尿频、尿急 和尿痛15例,腰痛6例;伴有高血压6例,糖尿病2 例,冠心病1例。肿瘤组织病理分级低度恶性潜能 尿路上皮乳头状瘤9例,低级别尿路上皮癌14例, 高级别尿路上皮癌10例。33例尿路上皮癌患者的肿 瘤组织及抗凝血标本均无菌采集于安徽医科大学第 一及第二附属医院泌尿外科。本研究获得了安徽医 科大学伦理道德委员会的批准。 1.1.2 资料来源
用于流式细胞仪的CD3-PC5、CD4-FITC、CD8- PE单克隆抗体购自英国BD公司;HCMV IgG、IgM ELISA检测试剂盒购自意大利DIESSE公司。流式 细胞仪(BECKMAN COVLTER,EPICS® ALTRATM FCM with HypersortTM,美国);高速冷冻离心机 (GL-20B,上海安亭科学仪器厂);台式高速离 心机(TGL-16C,上海安亭科学仪器厂); 1.2 方法 1.2.1 流式细胞术检测尿路上皮癌患者外周血标本 CD3+、CD4+和CD8+ T细胞亚群
每份样本检测不少于1×104个细胞,以确定T细 胞亚群的荧光强度。测定前先用标准荧光微球校准 仪器,所有标本都用同一设定条件检测。(1)取 200 μl血(肝素抗凝),分别加入20 μl CD3-PC5、 CD4-FITC、CD8-PE单克隆抗体进行染色,室温避 光孵育45 min。(2)每管中加入500μl的固定液, 室温避光孵育15 min。(3)每管中加入1ml的清 洗缓冲液,1 200 r/min离心5 min,弃除上清液。 (4)每管中加入500 μl的红细胞裂解液,室温避 光孵育15 min。(5)每管中加入1ml的清洗缓冲液 后,1 200 r/min离心5 min,弃除上清液。(6)用 缓冲液洗涤1次,加入300 μl PBS重悬细胞,上流式 细胞仪检测。 1.2.2 HCMV-IgG及IgM检测
按试剂盒说明书检测 抗凝血血浆HCMV-IgG和IgM抗体。结果判定用吸 光度法,以酶标光度仪检测各孔吸光度(OD)值,检 测波长450 nm,样品孔OD值为阴性,OD值≥2.1判 定为阳性。 1.3 统计学方法
使用SPSS 13.0 进行统计学处理,计数资料采用χ2检验进行分析。 2 结果 2.1 抗凝血HCMV-IgG及IgM抗体鉴定
33份尿路上皮癌患者的血浆ELISA法检测结果 如下:HCMV-IgG阳性的为31份,阳性率为93.9% (31/33);HCMV-IgM阳性的为7份,阳性率为 21.2%(7/33)。 2.2 流式细胞仪检测外周血T细胞亚群
根据HCMV-IgM抗体将尿路上皮癌患者分为阳 性组(7例)和阴性组(26例)。 利用流式细胞术 测定两组血标本中CD3+、CD4+ 和CD8+T细胞亚群的百分比。 2.2.1
阳性组血标本CD3+、CD4+和CD8+T细胞的 百分比,见图1A~C;阴性组血标本CD3+、CD4+和 CD8+T细胞的百分比,见图1D~F。 2.2.2 两组间CD3+、CD4+和CD8+T淋巴细胞比例和CD4+/CD8+比值分析
HCMV-IgM阳性组患者的CD3+、CD4+T淋巴细 胞比例显著低于阴性组,CD8+T淋巴细胞高于阴性 组,CD4+/CD8+ 比值低于阴性组,P值均小于0.01, 见表1。
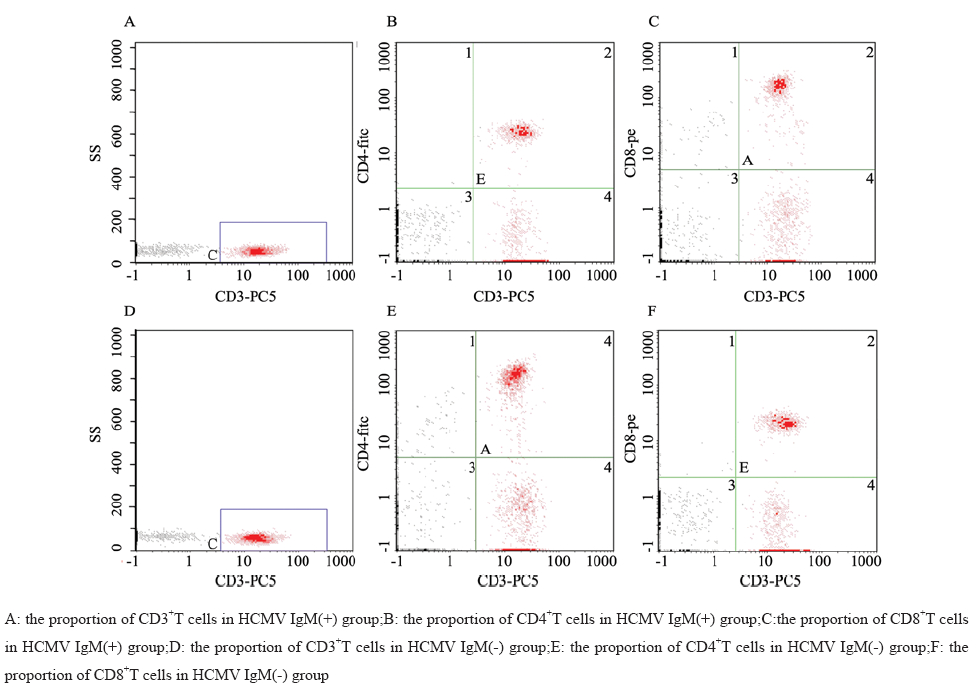 |
图1 尿路上皮癌患者外周血CD3+、CD4+和CD8+T细胞流式细胞仪检测结果 Figure 1The proportion of CD3+,CD4+ and CD8+T cells in peripheral blood of urothelial carcinoma dectected by flow cytometry |
|
|
表1 尿路上皮癌患者外周血CD3+、CD4+和CD8+ T淋巴细 胞比例分析 Table 1 The proportion of CD3+,CD4+,CD8+T cells and CD4+⁄CD8+ in peripheral blood of urothelial carcinoma |
CD4+/CD8+ 比值正常范围为0.95~2.05,当比值 低于0.95时,通常处于免疫抑制状态。根据CD4+/ CD8+的比值可将膀胱癌患者分为细胞免疫状态正常 和细胞免疫状态异常。在HCMV-IgM阳性的7例患者 中,有6例(85.7%)CD4+/CD8+ 低于0.95,而在阴性 组中,仅有3例(11.5%)低于0.95,两组间比较差异 有统计学意义,见表2。
|
|
表2 两组尿路上皮癌患者细胞免疫功能状态分析 Table 2 Comparison of cellular immunity of patients with urothelium carcinoma in two groups |
HCMV 在人群中感染广泛,且具有种属特异性,即人是HCMV的唯一宿主。通常在免疫功能正 常的机体内HCMV 呈潜伏状态或低度增殖状态, 与宿主保持相对平衡状态并保持终生。当受染宿主 使用免疫抑制剂或免疫功能发育不全、免疫功能减 弱时,HCMV 的潜伏感染激活,导致病毒在宿主 细胞内增殖,对机体代谢进行多水平调节和干扰, 从而引发各种疾病。正常人体感染HCMV后产生的 HCMV-IgG抗体可以持续终生,因此IgG抗体的存 在只表明曾感染过HCMV,不一定表示有HCMV活 动性感染。HCMV-IgM通常在HCMV感染一周后产 生,持续3~5月,当病毒被机体清除或进入潜伏状态 后,HCMV-IgM亦渐消退,因此,其被用作实验室 诊断活动性HCMV感染的重要指标之一,其阳性提 示近期有HCMV活动性感染。在我国两组健康的无 偿献血人群检测中发现[4, 5],HCMV-IgG抗体阳性率 高达90%,但HCMV-IgM抗体阳性率低于3%。 在 本组33例尿路上皮癌患者中,HCMV-IgG抗体阳性 率为93%(31/33),与健康人群的发生率相近, 但HCMV-IgM抗体阳性率却达到21.2%(7/33), 远高于健康人群的比例。
HCMV的潜伏感染与其免疫逃避机制有关[6], 如抑制树突状细胞( dentric cell ,DC)的抗原呈递功 能,抑制CD8+T 细胞和自然杀伤(natural killer,NK) 细胞介导的细胞毒作用。当机体免疫功能下降, 如AIDS、恶性肿瘤、妊娠或器官移植患者,潜伏 状态的HCMV 则可能被激活并进一步恶化机体的 细胞免疫功能。Moutaftsi 等[7]研究发现,感染了 HCMV的DC细胞,其MHC-Ⅰ类分子、MHC-Ⅱ 类分子和表面分子CD40 、CD80 都明显下降,脂 多糖诱导DC形成障碍,提示DC递呈抗原肽的能力 严重受抑。同时,研究者还发现感染了HCMV 的 机体,病毒特异性CD8+T 细胞增殖和细胞毒性都降 低,使感染了HCMV的细胞逃避CD8+T细胞的免疫 监视[8]。
膀胱癌是我国最常见的泌尿系肿瘤,90%的患 者为非肌层浸润性尿路上皮癌(NMIBC),保留膀胱 的经尿道电切术是治疗NMIBC的最佳方案,但术 后较高的复发率与进展率迫使临床医师寻求更加有 效的方法减少肿瘤的复发与进展[2],术后膀胱内灌 注化疗药物或免疫增强剂获得临床医生的重视。 BCG是目前已知的减少高风险NMIBC复发与进展 最有效的膀胱内灌注药物,并获得EUA、AUA和NCCN的推荐。与其他化疗药物不同的是[9],BCG 预防肿瘤复发与进展的机制是通过激活尿路上皮癌 患者体内细胞免疫系统来达到杀灭肿瘤细胞的目 的。BCG具有极强的非特异性免疫刺激活性,能 够黏附到膀胱内壁的尿路上皮细胞和肿瘤细胞,诱 导膀胱内壁产生广泛炎性反应,活化NK细胞、巨 噬细胞、Th1细胞(type l help T cell)、细胞毒性T细 胞(cytotoxic T lymphocyte,CTL)等多种免疫细胞 并促进这些细胞在肿瘤部位聚集,并产生包括白介 素(interleukin,IL),肿瘤坏死因子(tumor necrosis factor,TNF),干扰素(interferon,IFN)等细胞因子。 BCG通过T细胞、B细胞、LAK细胞、细胞因子的 相互作用达到杀伤肿瘤的目的,提示免疫系统在 抑制尿路上皮癌的发生与发展过程中具有重要的 作用。尽管BCG是目前所知最有效的生物制剂之 一,维持BCG膀胱灌注治疗可使膀胱肿瘤进展概 率降低37%,但仍有30%~45%患者对BCG膀胱灌 注治疗无效。在对BCG灌注失败的患者研究中发 现[10],尿液中IL-2的水平是预测BCG疗效的重要 标志物,IL-2主要由Th1细胞产生(CD4+),具有 刺激T细胞的生长与活化,激活NK细胞与巨噬细 胞,促进CTL细胞毒功能,研究发现尿液中IL-2浓 度越高,持续时间越长,肿瘤的复发与进展率就 越低。BCG灌注后尿液中TNF浓度也是一个重要的 预测因子[11],TNF由巨噬细胞、NK细胞和T细胞产 生,具有杀伤靶细胞和促进细胞凋亡的功能。
在本研究中发现,尿路上皮癌患者HCMV-IgM 阳性组和阴性组CD3+、CD4+ 和CD8+T细胞亚群之 间比较,差异有统计学意义(P<0.001)。阳性组 患者的CD4+T细胞的比例显著低于阴性组,并且 该组患者的CD4+/CD8+比值亦显著低于阴性组。 通过CD4+/CD8+的比值我们发现,阳性组中有85% (6/7)的患者处于免疫功能低下状态,而相对于 阴性组仅有11.5%(3/23)的患者处于免疫功能低 下状态。在我们前期的研究发现[12],HCMV活动性 感染与尿路上皮癌的病理分级和复发相关,相对于 HCMV-IgM阳性的患者,他们更易发生高级别尿路 上皮癌,术后更易发生复发与进展,对于此类患 者,术后应首选膀胱灌注BCG治疗。然而从本组 的研究结果发现,当患者处于HCMV活动性感染 状态时,其自身的细胞免疫状态功能低下,T辅助 细胞比例亦明显降低,这种改变可能会影响患者的BCG灌注治疗效果,目前尚无HCMV活动性感染 与BCG膀胱灌注疗效的相关性研究,值得我们进 一步研究。此外我们认为术前检测HCMV-IgM是一 种简单有效预测尿路上皮癌患者免疫状态的方法, 对于HCMV-IgM阳性的患者,我们认为还应辅助抗 病毒治疗,及早恢复患者的细胞免疫功能。
| [1] | Wen DG, Shan BE, Zhang SW, et al. Analysis of incidence and mortality rates of bladder cancer in registration areas of China from 2003 to 2007[J]. Zhong Liu,2012,32(4):256-62. [温登瑰, 单保恩,张思维,等,2003—2007年中国肿瘤登记地区膀胱 癌的发病与死亡分析[J]. 肿瘤, 2012,32(4):256-62.] |
| [2] | Oosterlinck W, Decaestecker K. Current strategies in the treatment of non-muscle-invasive bladder cancer[J]. Expert Rev Anticancer Ther,2012,12(8):1097-106. |
| [3] | Cui Y, Wang ML. Research in human cytomegalovirus infection and cancer[J]. Wei Sheng Wu Yu Gan Ran,2008,3(3):166-9.[崔 寰,王明丽.人巨细胞病毒感染与肿瘤相关性研究进展[J]. 微生 物与感染,2008,3(3):166-9.] |
| [4] | Yang N,Chen HL,Qian X,et al. Analysis of Nanchang qualifi ed blood donors with human cytomegalovirus infection[J]. Zhongguo Shu Xue Za Zhi,2012,25(11):1193-4.[杨南,陈火玲,钱 献,等.南昌市合格无偿献血者人巨细胞病毒感染情况分析[J]. 中国输血杂志,2012,25(11):1193-4.] |
| [5] | Huang LS,Sheng CH,Lin MS. Investigate in Shantou blood donors with HCMV[J]. Guangzhou Yi Yao,2009,40(5):63-4.[黄 蓝生,盛楚华,林美珊. 汕头市健康无偿献血人群HCMV感染调 查[J]. 广州医药,2009,40(5):63-4.] |
| [6] | Zhou YF, Fang F. Molecular mechanisms of HCMV in immune escape[J]. Guo Wai Yi Xue (Bing Du Xue Fen Ce), 2004, 11(2):43-6. [周玉峰,方峰. HCMV免疫逃避分子机制研究进展 |
| [7] | Moutaftsi M, Mehl AM, Borysiewicz LK, et al. Human cytomegalovirus inhibits maturation and impairs function of monocyte-derived dendritic cells[J]. Blood, 2002, 99(8):2913-21. |
| [8] | Hansen SG, Powers CJ, Richards R, et al. Evasion of CD8+ T cells is critical for super-infection by cytomegalovirus[J]. Scince, 2010,328(5974):102-6. |
| [9] | Kawai K, Miyazaki J, Joraku A,et al. Bacillus Calmette–Guerin (BCG) immunotherapy for bladder cancer: current understanding and perspectives on engineered BCG vaccine[J].Cancer Sci,2013,104(1):22-7. |
| [10] | Zuiverloon TC, Nieuweboer AJ, Vékony H, et al. Markers predicting response to bacillus Calmette-Guérin immunotherapy in high-risk bladder cancer patients: a systematic review[J]. Eur Urol,2012,61(1):128-45. |
| [11] | Shintani Y, Sawada Y, Inagaki T, et al. Intravesical instillation therapy with bacillus Calmette-Guérin for superficial bladder cancer: study of the mechanism of bacillus Calmette-Guérin immunotherapy[J]. Int J Urol,2007,14(2):140-6. |
| [12] | Shi HQ,Ge J,Tang L,et al. The correlation study of HCMV active infection and urothelial carcinoma[J]. Anhui Yi Ke Da Xue Xue Bao,2013,48(1):60-5.[施浩强,葛俊,唐亮,等. HCMV 活动性感染与尿路上皮癌的相关性研究[J].安徽医科大学学 报,2013,48(1):60-5.] |
 2014, Vol.41
2014, Vol.41




