文章信息
- 杜桂容,齐颖,罗肇璋,王洪敏,莫国玉,杨富强,饶桂荣,谢小明,陈光明. 2014.
- DU Guirong, QI Ying, LUO Zhaozhang, WANG Hongmin, MO Guoyu, YANG Fuqiang, RAO Guirong, XIE Xiaoming, CHEN Guangming. 2014.
- T-VISA-BikDD质粒对肿瘤细胞的抑制活性研究
- Inhibitory Activity of T-VISA-BikDD Plasmid on Tumor Cells in Vitro
- 肿瘤防治研究, 2014, 41(12): 1292-1295
- Cancer Research on Prevention and Treatment, 2014, 41(12): 1292-1295
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.12.008
-
文章历史
- 收稿日期:2013-11-20
- 修回日期:2014-04-02
2.510000 广州,中山大学肿 瘤防治中心 华南肿瘤学国家重点实验室乳腺科
2.Department of Breast Oncology, State Key Laboratory of Oncology in South China, Sun Yat-Sen University Cancer Center, Guangzhou 510000, China
本研究试用T-VISA-BikDD[1]质粒进行了肿瘤 基因治疗[2, 3]研究,该质粒含有hTERT端粒酶启动 子(简称T),结合VISA整合性放大系统和BikDD (突变的Bik基因)。本研究以多种肿瘤细胞株为 研究对象,观察T-VISA-BikDD质粒在体外对不同 肿瘤细胞株的生长抑制作用。 1 材料和方法 1.1 材料 1.1.1 细胞株
肺癌细胞株H1299、H1975、 H1437、H322和A549;鼻咽癌细胞株CNE-1和 CNE-2;胃癌细胞株HGC-27和MGC-803;胰腺癌 细胞株BxPC-3和Panc-1;肝癌细胞株Hepg-Ⅱ;胶 质瘤细胞株BT325、U251和U87;黑色素瘤细胞 株WM35;乳腺癌细胞株MDA-MB-231和MDAMB- 453;前列腺癌细胞株PC-3,共19株肿瘤细胞 均由中山大学肿瘤医院乳腺科实验中心提供。 1.1.2 主要试剂和耗材
T-VISA-BikDD和CMVBikDD 质粒(解放军458医院科研室);Invitrogen LipofectamineTM2000转染试剂(美国Invitrogen 公司);胎牛血清、DMEM 高糖培养液、RPMI 1640培养液(Hyclone 公司);0.25%胰蛋白酶 (吉诺生物医药技术有限公司,中国);MTT试 剂盒(广州威佳科技分装Sigma);细胞培养瓶、 培养板(美国Coring公司)。 1.1.3 主要仪器
CO2细胞培养箱(Galaxy 170s,德国),酶标仪(Thermo NK3,美国);超净工 作台(苏净安泰SW-CJ-1FD,中国);倒置显微 镜(OLYMPUS CKX41,日本);离心机(贝克 曼Allegrax-15R,美国)。 1.2 方法 1.2.1 细胞培养
19株肿瘤细胞,在含有10%胎牛 血清的DMEM或RPMI1640培养液中培养,在37℃、 5% CO2条件下,传代生长,取对数生长期细胞进行 实验。 1.2.2 转染质粒到多种肿瘤细胞株中
实验 分组:空白对照组、T-VISA-BikDD低剂量组 (T-VISA-BikDD-1组)、T-VISA-BikDD中剂量组 (T-VISA-BikDD-2组)、T-VISA-BikDD高剂量组 (T-VISA-BikDD-3组)和CMV-BikDD组(阳性对 照组),其中T-VISA-BikDD低剂量、中剂量和高 剂量的质粒用量分别为0.8、1.24和2.0 μg,每组做 四个复孔。质粒转染前24 h,取对数生长期肿瘤 细胞铺板,接种于24孔板中,使得转染前细胞融 合度达到70%~80%左右。转染当天,用无血清培 养液稀释T-VISA-BikDD和CMV-BikDD质粒,轻 轻混匀;取相应的LipofectamineTM2000转染试剂与 无血清培养液混匀,室温放置5 min;将上述两者 混匀,室温放置20 min;转染前更换细胞培养液 (更换成无血清培养液),将转染复合物加到每 孔中,摇动培养板,混匀;在37℃、5%CO2的恒 温培养箱培养4 h,吸弃含有复合物的培养液,每 孔加入新的含10%胎牛血清的培养液,在37℃、 5%CO2 的恒温培养箱培养48 h。 1.2.3 MTT法检测细胞活性
24孔板,每孔加入 100 μl浓度为5 mg/ml的MTT,37℃下孵育4 h, 吸弃培养液,每孔加入750 μl DMSO(二甲基亚 砜),振荡10 min,使结晶物溶解充分,每孔取 100 μl加入96孔板(每孔做3个复孔)用酶标仪492 nm比色,检测吸光值计算细胞死亡率。细胞死亡 率计算:死亡率% =(对照组平均吸光值-转染组平 均吸光值)/对照组平均吸光值 × 100%。 1.3 统计学方法
实验数据用x±s表示,组间比较用方差分析中 均数的两两比较,应用SPSS11.5软件进行分析, P<0.05为差异有统计学意义。 2 结果 2.1 T-VISA-BikDD和CMV-BikDD质粒对肿瘤细 胞株的杀伤作用
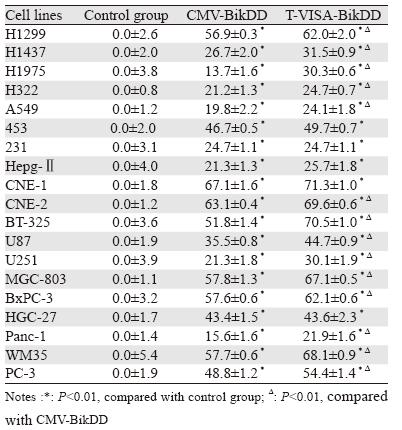
转染质粒48 h后,T-VISA-BikDD和CMVBi kDD质粒组的1 9 种肿瘤细胞的死亡率明显 上升,与空白对照组比较,差异有统计学意义 (P<0.01);与CMV-BikDD质粒组比较,T-VISABikDD 质粒组的肺癌细胞株、胶质瘤细胞株、鼻 咽癌细胞株、黑色素瘤细胞株、胃癌细胞株、胰 腺癌细胞株和前列腺癌细胞株等14个细胞株的死 亡率显著上升(P<0.01),这一结果提示,在促 进肿瘤细胞杀伤作用上,T-VISA-BikDD质粒比 CMV-BikDD质粒具有高效性,结果见表 1。
 |
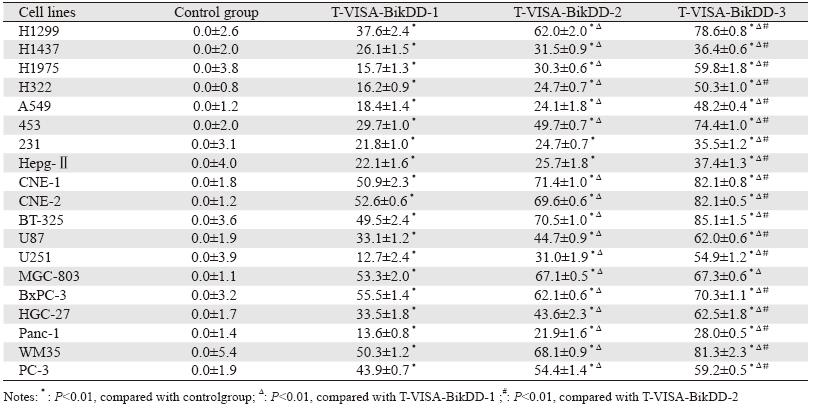
转染质粒48 h后,与空白对照组比较,T-VISABikDD 低、中、高三个剂量组的多种肿瘤细胞的死 亡率均显著上升(P<0.01)。随着T-VISA-BikDD 剂量的增加,细胞的死亡率不断上升,当T-VISABikDD 剂量为2 μg时,肿瘤细胞的死亡率最高。 与T-VISA-BikDD低剂量组比较,T-VISA-BikDD 高剂量组的19种肿瘤细胞的死亡率均显著性上升 (P<0.01);T-VISA-BikDD中剂量组除肝癌细 胞(Hepg-Ⅱ)和乳腺癌细胞(MDA-MB-231) 外,其余17株细胞株的死亡率与T-VISA-BikDD低 剂量组比较,差异均有统计学意义(P<0.01)。 T-VISA-BikDD高剂量组与中剂量组比较,除胃 癌细胞(MGC-803)外,其他18个细胞株的死亡率差异均有统计学意义(P<0.01)。结果显示 T-VISA-BikDD质粒在体外对多种肿瘤细胞株杀伤 作用与剂量存在一定的依赖关系,结果见表 2。
 |
细胞凋亡是一种进化上高度保守的死亡模 式,它对于生物体的发育、集体稳态的维持至关 重要。一般认为恶性转化的肿瘤细胞是因为失控 生长、过度增殖,从细胞凋亡的角度看则认为是 肿瘤的凋亡机制受到抑制不能正常进行细胞死亡 清除的结果。通过向肿瘤细胞内导入凋亡诱导蛋 白,以诱导肿瘤细胞发生凋亡,已成为肿瘤基因 治疗的新策略[4]。目前大多数研究者认为,细胞凋 亡存在三条通路,即死亡受体通路[5]、线粒体通路[6] 和内质网通路[7],三条通路是相互密切关联的,并 受多种因素的调节,其中“线粒体途径”是最重要 的途径之一。Bcl-2家族蛋白是该途径的关键调节 因素[8],Bcl-2家族中包含很多的凋亡诱导蛋白都 具有仅含BH3结构域的特点,而在这些仅含BH3结 构域的凋亡诱导蛋白中,Bik能结合的Bcl-2家族凋 亡抑制蛋白最多,且与凋亡抑制蛋白中研究最多 的Bcl-2及Mcl-1的结合力最强[9],伴随着死亡信号 的刺激,Bik磷酸化后可以与抗凋亡蛋白质结合, 拮抗其抗凋亡作用,从而使得其他促凋亡蛋白质 可以直接激活Bax[10]。Bax移位到线粒体并形成同 源二聚体通道,这种插入到线粒体外膜的Bax通道 足以促进细胞色素c的释放,接着导致caspase的激 活和细胞凋亡[11]。
BikDD为突变型Bik,是Bik的第33位酪氨酸 和35位丝氨突变为天冬氨酸,提高其与凋亡抑制 蛋白Bcl-2和Bcl-XL的亲和力,及其对细胞的增殖 抑制作用和促进凋亡能力。本实验将BikDD基因 连入T-VISA载体,构建出T-VISA-BikDD,利用阳 离子脂质体转染的方法将其转染入多种肿瘤细胞 株,通过MTT实验观察T-VISA-BikDD质粒对多种 肿瘤细胞的杀伤作用[12]。
MTT实验结果表明,T-VISA-BikDD和CMVBikDD 质粒对19种肿瘤细胞均有明显的杀伤作 用,且T-VISA-BikDD在多株肿瘤细胞中的杀伤 作用均强于CMV-BikDD(P<0.01),在鼻咽癌 细胞株(CNE-1和CNE-2)、脑胶质瘤细胞株 (BT-325)、黑色素瘤细胞株(WM35)、胃癌 细胞株(MGC-803)、肺癌细胞株(H1299)、胰 腺癌细胞株( BxPC-3)和乳腺癌细胞株(MDAMB- 453)等细胞株中尤为显著,死亡率均≥ 50%。在同一肿瘤系中,T-VISA-BikDD质粒对不 同细胞株的杀伤作用存在不同程度的差异,对于 同一株肿瘤细胞,T-VISA-BikDD质粒的杀伤作用 与剂量存在依赖关系,即T-VISA-BikDD质粒对肿 瘤细胞的杀伤作用会随着质粒量的增加而升高, 且差异有统计学意义(P<0.01)。这些结果说明 BikDD与T-VISA及CMV启动子的联合应用均能在 肿瘤细胞中发挥其生长抑制作用,而且T-VISA载 体在肿瘤细胞中可更高效实现凋亡诱导基因及其表达蛋白特异性表达,抑制肿瘤细胞的增殖。
由于本实验处于初步探索阶段,不能充分地 反应出药物的高效性及特异靶向性,需要进一步 深入研究,才能通过更多的检测指标以及结合体 内药效学实验来证实其高效性及特异靶向性,为 肿瘤基因治疗提供技术途径和实验依据。
肿瘤基因治疗已开展多年,疗效明确,但靶 向性差、不良反应大,本课题T-VISA-BikDD药物 若能解决肿瘤基因治疗研究与开发领域的靶向瓶 颈问题,将为其开发肿瘤基因治疗提供新思路。
| [1] | Xie X, Li L, Xiao X, et al. Targeted expression of BikDDeliminates breast cancer with virtually no toxicity in noninvasiveimaging models[J].Mol Cancer Ther, 2012, 11(9): 1915-24. |
| [2] | He N, Sun HC, Xu HX, et al. Synthesis and characterization ofPEG-b-(PG-g-PEI) for gene delivery[J].Nan Fang Yi Ke Da XueXue Bao, 2013, 33(11): 1643-7.[ 何宁,孙贺春,徐欢喜.可降解非病毒基因载体PEG-b-(PG-g-PEI)的合成与表征[J].南方医科大学学报, 2013, 33(11): 1643-7.] |
| [3] | Cheng M, Zhi K, Gao X, et al. Activation of cellular immunity andmarked inhibition of liver cancer inamouse model following genetherapy and tumor expression of GM-SCF, IL-21,and Rae-1[J].Mol Cancer, 2013, 12(1): 166. |
| [4] | Vachani A, Moon E, Wakeam E, et al. Gene therapy for lungneoplasms [J].Clin Chest Med, 2011, 32(4): 865-85. |
| [5] | Mahood Z, Shukla Y. Death receptors: targets for cancer therapy[J].Exp Cell Res, 2010, 316(6): 887-99. |
| [6] | Cusimano EM, Knight AR, Slusser JG, et al. Mitochondria:thehemi of the cell[J]. Adv Emerg Nurs J, 2009, 31(1): 54-62. |
| [7] | Nakgave T, Zhu H, Morishima N, et al. Caspase-12 mediatesendoplasmic reticulum specific apoptosis and cytotoxicity byamyloid beta[J]. Nature, 2000, 403(6765): 98-103. |
| [8] | Stiles BL. PI-3-K and AKT: Onto the mitochondria[J]. Adv DrugDeliv Rev, 2009, 61(14): 1276-82. |
| [9] | Varadarajan S, Butterworth M, Wei J, et al. Sabutoclax (BI97C1)and BI112D1, putative inhibitors of MCL-1, induce mitochondrialfragmentation either upstream of or independent of apoptosis [J].Neoplasia, 2013, 15(5): 568-78. |
| [10] | KiM H, Rafiuddin-Shah M, Tu HC, et al. Hierarchial regulationof mitochondrion-dependent apoptosis by BCL-2 subfamilies[J].Nat Cell Biol, 2006, 8(12): 1348-58. |
| [11] | Jiao S, Li Z. Non-apoptotic function of BAD and BAX in longtermdepression of synaptic transmission[J]. Neuron, 2011,70(4): 758-72. |
| [12] | Lin ZN, Dong SZ, Dong SY, et al. Methodology and applicationof T lymphocyte proliferation function detected by MTT[J].Zhongguo Wei Sheng Jian Yan Za Zhi, 2000, 10(1):8-10.[林忠宁,董胜璋, 董书芸, 等. MTT法检测T淋巴细胞增殖功能的方法学探讨与应用[J].中国卫生检验杂志, 2000, l0(1): 8-10.] |
 2014, Vol. 41
2014, Vol. 41