文章信息
- 钟艳平,孟泳圳,李力,尹富強,黎丹戎,张玮. 2014.
- ZHONG Yanping, MENG Yongzhen, LI Li, YIN Fuqiang, LI Danrong, ZHANG Wei. 2014.
- 卵巢癌SKOV3细胞中侧群细胞的生物学特性
- Biological Characteristics of Side Population Cells in Ovarian Cancer Cell Line SKOV3
- 肿瘤防治研究, 2014, 41(12): 1282-1285
- Cancer Research on Prevention and Treatment, 2014, 41(12): 1282-1285
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.12.006
-
文章历史
- 收稿日期:2013-12-16
- 修回日期:2014-04-11
2.530021 南宁,广西医科大学肿瘤医院妇瘤科
2.Department of Gynecological Oncology, Tumor Hospital of Guangxi Medical University, Nanning 530021, China
越来越多的证据表明肿瘤细胞中的某些亚群 具有干细胞的特性。干细胞学说认为,肿瘤干细 胞是肿瘤的发生、生长、耐药以及转移、复发的 根源。而肿瘤干细胞则是机体的正常干细胞或其 前体细胞在一系列内外因素作用下增殖分化失常 形成的。因此,肿瘤是一种干细胞疾病。目前人 们已经能够成功分离白血病、乳腺癌、脑肿瘤和 胰腺癌干细胞[1, 2]。对其他一些实体瘤的研究也提 示有相应的肿瘤干细胞的存在[3, 4, 5]。
要寻求攻克肿瘤干细胞的突破点,首先要探 明肿瘤干细胞的生物学行为特性和侵袭转移机 制。侧群(SP)细胞具有肿瘤干细胞的相关特 性,是目前富集肿瘤干细胞的常用方法之一。本研究采用Hoechst 33342染色与荧光激活细胞分选 (fluorescence-activated cell sorting,FACS)技术 相结合,对卵巢癌细胞系SKOV3中的SP细胞进行 检测及分选,并体外检测该细胞亚群的生物学特 性,为深入研究卵巢癌干细胞提供模型和基础。 1 材料与方法 1.1 实验材料 1.1.1 细胞
卵巢癌细胞株SKOV3为广西医科大 学附属肿瘤医院实验研究部保存。 1.1.2 主要试剂
胎牛血清、RPMI 1640培养液购 自美国Hyclone公司,7-AAD 、Hoechst 33342购自美 国Sigma公司 ,盐酸维拉帕米购自阿拉丁公司,流 式分选微球、校准微球购自美国BD公司。Matrigel 胶购自北京大学生物中心,Transwell小室购自美国 Corning Costar公司。 1.1.3 主要仪器
InfluxTM流式细胞分选仪(美国 BD公司),ZEISS倒置荧光相差显微镜,Olympus 倒置光学显微镜,Thermo CO2培养箱。 1.2 方法 1.2.1 细胞培养
人卵巢癌细胞株SKOV3,用含 10%胎牛血清、100 u/ml的青霉素和100 μg/ml链霉 素的RPMI 1640培养液、在37℃饱和湿度,5%CO2 恒温培养箱内培养,每3~4天传代一次。 1.2.2 SKOV3细胞中SP细胞筛选鉴定
采用 InfluxTM流式细胞仪分选法,具体方法与步骤参见 本课题组前期建立的方法[6]。 1.2.3 细胞生物学功能体外检测
细胞生长曲线 测定采用MTT法。流式细胞仪检测细胞周期, Multicycle软件分析G0/G1、S、G2/M各期细胞数 所占比例。克隆形成能力测定:采用InfluxTM流式 细胞仪,将SP细胞及non-SP细胞按照每孔200、 400、800数量分选至24孔板,培养7天后,甲醇固 定,姬姆萨染色,显微镜下计数集落。以15~50个 细胞为一个集落,用下列公式计算克隆形成率: 克隆形成率=克隆形成数/接种细胞数×100%。将3 个重复孔的结果计数后取平均值。细胞体外迁移 侵袭能力的测定:收集流式细胞仪分选出的SP细 胞和non-SP细胞,离心去上清液后,用含1%FBS 的培养液重悬细胞 ,调整细胞密度为1×106/ml。 用无血清培养液将液态的Matrigel胶稀释5倍,每 个Transwell小室加入60 μl稀释后的Matrigel,置 于37℃培养箱中待其凝固后(迁移实验无需加 Matrigel,余步骤同侵袭实验),每孔上室接种 100 μl细胞悬液,下室加入500 μl含20% FBS的培 养液。置于37℃培养箱中孵育24 h后,用棉球轻轻 擦去上室内的细胞,95%乙醇固定,HE染色,200 倍显微镜下观察拍照,分别选取上下左右及中间5 个视野,计数细胞。 1.2.4 细胞自我更新能力检测
分别收集体外培养 9、14、20和30天后的SP及non-SP细胞,制备成细 胞密度为1×106的单细胞悬液,用浓度为3 μg/ml的 Hoechst 33342复染,流式细胞仪分析SP及non-SP 细胞中SP细胞的比例。 1.3 统计学方法
采用SPSS 17.0软件进行统计学分析。数值 以x±s表示,两组独立样本比较用非配对t检验, P<0.05为差异有统计学意义。 2 结果 2.1 SKOV3细胞系中SP细胞的检测结果
SKOV3细胞经染色后去除7-AAD染色阳性的 死细胞及细胞碎片,见图 1A,通过 Hoechst 33342 蓝光(Y轴)和红光(X轴)双参数图,见图 1B, 1C,SP细胞位于左下角两种荧光均很弱的区域。 实验组低染区SP细胞比例为(1.12±0.104)%,见 图 1B,对照组(维拉帕米阻滞组)低染区SP细胞 比例减少为0,见图 1C,全被维拉帕米阻滞,证实 卵巢癌细胞株SKOV3中确实存在SP细胞。

|
| A:Viable cells (91.5%); B: Hoechst 33342 group; C: Hoechst 33342+Verapamil group; FSC: fluorescence-activated cell; SP: side population; non- SP: non-side population 图 1 Flowjo软件分析卵巢癌细胞株SKOV3中侧群细胞比例 Figure 1 Side population(SP) cells proportion in SKOV3 cell line analyzed by Flowjo software |
用MTT比色法连续7天测定SP与non-SP细胞的 吸光度(OD)值,发现第1至第3天,细胞生长缓 慢,SP和non-SP细胞均处于潜伏期,自第4天起, 细胞生长速率增快,至第六天时SP与non-SP细胞 的生长速度开始出现明显差异(P<0.05),表明 SP细胞较non-SP细胞有更强的增殖能力,见表 1。
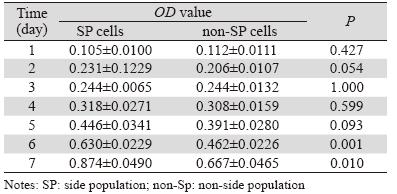 |
接种细胞数目为800、400、200个时,SP细胞 的克隆形成率分别为(12±1.5)%、(10±2.3)% 及(8.9±1.1)%,non-SP细胞的克隆形成率则分别为(3.0±0.8)%、(1.75±0.5)%及(1.7± 0.2)%。不同细胞接种组的SP和non-SP细胞的克 隆形成率差异均有统计学意义(P<0.05),说明 SP细胞的克隆形成能力强于non-SP细胞。 2.4 SP细胞与non-SP细胞迁移、侵袭能力比较
SP细胞、non-SP细胞接种于Transwell小室24 h 后,固定染色并计数。non-SP细胞迁移数为(74± 4)个,SP细胞迁移数为(91±6)个,差异有统计 学意义(P=0.024)。non-SP细胞侵袭数为(34± 4)个,SP细胞侵袭数为(60±5)个,差异有统计 学意义(P=0.000),见图 2。

|
| A: non-SP cells migration; B: SP cells migration; C: non-SP cells invasion; D: SP cells invasion 图 2 Transwell法检测细胞迁移和侵袭能力(×200) Figure 2 Cell migration and invasion detected by Transwell(×200) |
流式细胞仪检测SP与non-SP细胞周期结果 显示:SP细胞在G0/G1、S、G2/M各期的分布比 例分别为(69.94±5.39)%、(26.98±3.98)%及 (2.78±2.57)%、non-SP细胞则分别为(45.34± 4.62)%,(33.53±5.69)%及(18.12±6.54)%。 SP与non-SP细胞在G0/G1期(P=0.004)及G2/M期(P=0.019)的分布比例有显著差异,结果表明SP 细胞大多数处于细胞周期的静止期,见图 3。

|
| 图 3 流式细胞仪检测non-SP(A)与SP(B)的细胞周期 Figure 3 Cell cycle of non-SP cells (A) and SP cells (B) detected by flow cytometry |
流式细胞仪分选出的SP细胞及non-SP细胞 体外培养9、14、20和30天后,Hoechst 33342重 新染色后上流式细胞仪分析SP细胞比例。SP细 胞组的SP比例分别为(6.65±0.36)%、(2.5± 0.18)%、(1.2±0.21)%及(1.1±0.18)%,non- SP细胞组的SP比例分别为(0.012±0.003)%、 (0.018±0.014)%、(0.026±0.005)%及(0.014 ±0.01)%。结果表明:SP细胞可分化为non-SP细 胞,SP比例随着培养时间的增加而逐渐减少,培 养20天后其SP比例稳定在1%左右,与亲本SKOV3 细胞株中SP细胞比例一致。而non-SP不可分化为 SP细胞,见图 4。
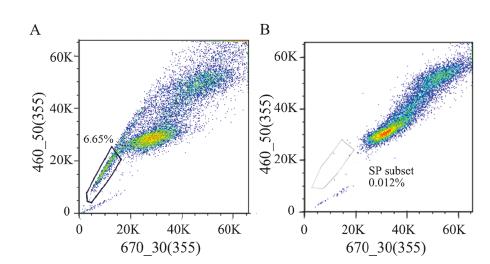
|
| 图 4 SP细胞(A)及non-SP细胞(B)体外培养7天后SP 比例示意图 Figure 4 SP proportion in SP cells (A) and non-SP cells (B) cultured in vitro after 7 days |
卵巢癌致死率为各类妇科肿瘤之首。传统的 手术、化疗、放疗均未能有效提高患者的5年生存 率,因此探索治疗卵巢癌的新方法具有极其重要 的意义。肿瘤干细胞(cancer stem cells,CSC)理 论的提出使得我们重新审视传统的研究思路及方 法。若能将治疗策略靶向卵巢癌CSC,则有望提 高疗效,降低患者死亡率。由于卵巢癌CSC缺乏特异性的表面标志物,而SP表型可用于分选表面 标志物不明确的肿瘤干细胞,因此SP细胞为研究 卵巢癌干细胞提供了一种实用而简便的手段。目 前在鼻咽癌[7]、肝癌[8]、甲状腺癌[9]等多种肿瘤组 织和细胞系中均检测不同比例的SP细胞,并证实 SP细胞具有CSC特性。
本课题组在前期研究[6]中,已证实人卵巢癌 细胞株SKOV3中存在少量的SP细胞亚群,并分析 了不同终浓度的Hoechst 33342以及不同SKOV3细 胞密度对SP细胞比例的影响,优化了SKOV3中SP 细胞分选的实验条件,为分选其他肿瘤组织或细 胞株中的SP细胞建立了参照标准。利用SP表型分 选出来的卵巢癌细胞是否具有肿瘤干细胞的特性 则是本次研究中需解决的关键问题。本研究通过 比较SP细胞与non-SP在体外的增殖速度、克隆形 成能力、侵袭与迁移能力、自我更新能力及在细 胞周期各时相的分布情况来验证SP细胞是否具备 肿瘤干细胞特征。结果表明:SP细胞在体外具有 高增殖活性,较强的克隆形成能力及侵袭迁移能 力。进一步研究发现,SP细胞大多数(70%左右) 处于细胞周期的G0/G1期即静止期,在细胞周期中 相对静止是正常干细胞的一个重要特征[10](该结 果表明SP细胞与正常干细胞在细胞周期方面具有 相似性,是SP细胞具备干细胞特性的实验依据之 一)。分选出的SP细胞培养9天左右,检测其SP 比例为6.65%,培养14天SP比例下降至2.5%,培 养超过20天其SP比例与亲本SKOV3细胞株中SP细 胞比例趋于一致,而non-SP不可分化为SP细胞, 该结果提示SP细胞能自我更新并且分化,具有同 正常干细胞类似的特征。Kondo等[11]从神经胶质瘤 细胞系C6中分离出SP细胞和non-SP细胞,继续培 养一段时间后发现,SP细胞能产生SP和non-SP细 胞,而non-SP细胞则不具备此种特性。以上研究 表明SP细胞一方面通过自我更新来维持自身比例 的恒定性,另一方面通过分化形成大量的non-SP 细胞。SP细胞在体外长期培养后,重新形成由少 数强致瘤性SP细胞和多数弱致瘤性non-SP细胞所 构成的异质性细胞群体。
利用SP细胞表型特点与流式分选技术,是富 集CSC的一种有效手段。相对于其他方法,如悬 浮球培养,特异性分子标记等,SP细胞分选更为 简便有效。本研究结果显示卵巢癌细胞株SKOV3 中存在少量SP细胞,这个细胞亚群具备干细胞所 特有的自我更新及分化潜能,相对于non-SP细胞 及亲本细胞,SP细胞侵袭转移能力强,恶性程度 高,具有肿瘤干细胞的生物学特性。SKOV3中SP 细胞为卵巢癌干细胞研究提供了一个新的平台。
| [1] | Wu C, Alman BA. Side population cells in human cancers[J].Cancer Lett, 2008, 268(1): 1-9. |
| [2] | Hu H, Wang WH, Jiao F, et al. Update of pancreatic cancer stemcell research[J]. Zhong Liu Fang Zhi Yan Jiu, 2013, 40(8):801-4.[胡海, 汪卫华, 焦锋, 等. 胰腺癌干细胞研究进展[J]. 肿瘤防治研究, 2013, 40(8): 801-4.] |
| [3] | Mueller MT, Hermann PC, Witthauer J, et al. Combined targettreatment to eliminate tumorigenic cancr stem cells in humanpancreatic cancer[J]. Gastroenterology, 2009,137(3): 1102-13. |
| [4] | Fong MY, Kakar SS. The role of cancer stem cells and the sidepopulation in epithelial ovarian cancer[J]. Histol Histopathol,2010, 25(1): 113-20. |
| [5] | Moserle L, Indraccolo S, Ghisi M, et al. The side population ofovarian cancer cells is a primary target of IFN-alpha antitumoreffects[J]. Cancer Res, 2008, 68(14): 5658-68. |
| [6] | Meng YZ, Li L, Zhong YP, et al. Establishment and discussion ofa method for sorting ovarian cancer side population through flowcytometry[J].Guangxi Yi Ke Da Xue Xue Bao,2013,30(2):175-80 [孟泳圳, 李力, 钟艳平, 等. 卵巢癌侧群细胞流式分选方法的建立及探讨[J]. 广西医科大学学报, 2013, 30(2): 175-80.] |
| [7] | Wang J, Guo LP, Chen LZ, et al. Identification of cancer stem cell–like side population cells in human nasopharyngeal carcinoma cellline[J]. Cancer Res, 2007, 67(8): 3716-24. |
| [8] | Chiba T, Kita K, Zheng YW, et al. Side population purified fromhepatocellular carcinoma cells harbors cancer stem cell-likeproperties[J]. Hepatology, 2006, 44(1): 240-51. |
| [9] | Mitsutake N, Iwao A, Nagai K, et al. Characterization of sidepopulation in thyroid cancer cell lines: cancer stem-like cellsare enriched partly but not exclusively[J]. Endocrinology, 2007,148(4): 1797-803. |
| [10] | Horsley V, Aliprantis AO, Polak L, et al. NFATc1 balancesquiescence and proliferation of skin stem cells[J]. Cell, 2008,132(2): 299-310. |
| [11] | Kondo T, Setoguchi T, Taga T. Persistence of a small subpopulationof cancer stem-like cells in the C6 glioma cell line[J]. Proc NatlAcad Sci U S A, 2004, 101(3): 781-6. |
 2014, Vol. 41
2014, Vol. 41


