文章信息
- 边劲,王琳,寻琛,黄伟,秦叔逵. 2014.
- BIAN Jin, WANG Lin,XUN Chen,HUANG Wei,QIN Shukui. 2014.
- 培美曲塞和吉非替尼不同时序应用对人肺腺癌细胞的作用和机制
- Sequence-dependent Effects and Mechanism of Pemetrexed and Gefitinib on Human Lung Adenocarcinoma Cells
- 肿瘤防治研究, 2014, 41(12): 1266-1270
- Cancer Research on Prevention and Treatment, 2014, 41 (12): 1266-1270
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.12.002
-
文章历史
- 收稿日期:2013-09-25
- 修回日期:2013-12-11
肺癌是最常见的恶性肿瘤之一,严重危害人 类健康。化疗和运用表皮生长因子受体酪氨酸激 酶抑制剂(EGFR-TKI)的生物治疗是治疗晚期非 小细胞肺癌(non-small cell lung cancer,NSCLC)患者的两种重要手段。如何将EGFR-TKI和传统化 疗药物这两种不同作用机制的药物联合应用从而 使患者获得更大疗效,成为目前研究的热点。日 本WJTOG0203Ⅲ期临床研究证实,先化疗后序贯 吉非替尼能够提高肺腺癌患者的总生存时间[1]。 2011年ASCO会议报道的一项多中心开放Ⅱ期临床 研究表明培美曲塞同步联合厄洛替尼能提高晚期 肺癌患者的中位无疾病进展时间和中位总生存时 间[2]。那么,化疗序贯或同步联合EGFR-TKI究竟 何为最佳给药方式?
本实验通过研究培美曲塞和吉非替尼不同时 序应用对肺腺癌细胞增殖和凋亡的影响,旨在探 讨两药最佳给药方式,并且阐明其可能机制。
1 材料与方法 1.1 材料人肺腺癌PC-9细胞(突变型)、A549细胞 (野生型)由中国人民解放军八一医院实验科提 供。吉非替尼和培美曲塞分别由阿斯利康制药有 限公司及美国礼来公司提供。胎牛血清、胰蛋白 酶均购自北京中杉金桥公司。内参(β-actin)、 磷酸化表皮生长因子受体(p-EGFR)一抗、磷酸 化蛋白激酶B(p-AKT)一抗、磷酸化胞外调节蛋 白激酶(p-ERK)一抗、兔源及鼠源二抗均购自 Cell Signaling公司,抗TS单克隆抗体一抗购自美 国Zymed公司。Annexin V-FITC细胞凋亡检测试剂 盒购自南京凯基生物科技发展有限公司。
1.2 细胞培养和分组人肺腺癌细胞PC-9、 A549分别用含10%小牛 血清的DMEM、RPMI 1640高糖培养液置于37℃、 5%CO2饱和湿度的培养箱中常规培养。取对数生 长期的两种细胞制成每毫升1.0×105个细胞悬液, 分别接种于96孔板中,每孔接种100 μl,每组设 置6个复孔。细胞分组如下:(1)空白对照组 (C),(2)吉非替尼单独作用72h组(G), (3)培美曲塞单独作用72 h组(P),(4)培美 曲塞与吉非替尼同步联合作用72 h组(G+P), (5)先培美曲塞24h后序贯吉非替尼共同作用 48 h组(P-G),(6)先吉非替尼24 h后序贯培 美曲塞共同作用48h组(G-P),见图 1。吉非替 尼在PC-9、A549中初始浓度分别设置为(0.02、 0.04、0.08、0.16、0.32 μmol/L)和(1.0、2.0、 4.0、8.0、16.0 μmol/L),培美曲塞在两种细胞中 均设置为(0.01、0.1、1.0、10、100 μmol/L), 计算出培美曲塞和吉非替尼在PC-9、A549细胞中 作用72 h的IC50。然后吉非替尼在PC-9细胞中选择 浓度(0.02、0.04 μmol/L)、A549细胞中选择浓度 (2.0、4.0 μmol/L)与培美曲塞浓度(0.01、0.1、1.0 μmol/L)分别序贯或同步联合作为后续实验浓 度。
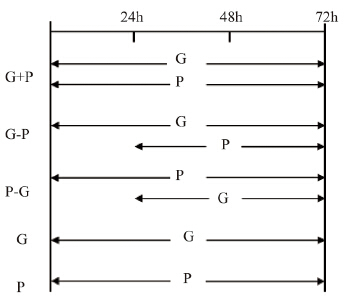
|
| G:gefitinib;P:pemetrexed;G-P:sequential gefitinib followed by pemetrexed; G+P:concurrent gefitinib and pemetrexed;P-G:sequential pemetrexed followed by gefitinib 图 1 培美曲塞和吉非替尼不同时序给药的联合方式 Figure 1 Different sequences of pemetrexed combined with gefitinib |
按不同给药方式干预72 h后弃培养液,加100 μl (5 g/L)MTT,温育4 h后弃上清液,加入100 μl 盐酸异丙醇,振荡10 min后,用酶联免疫检测仪 测定570 nm波长下各孔吸光值(OD),各种药物 浓度重复3次实验,计算各组细胞增殖抑制率。细 胞增殖抑制率(%)=(1-OD实验组/OD空白对照组)× 100%。
1.4 流式细胞仪检测不同时序给药后各组细胞凋 亡及周期分布取生长良好的对数生长期的A549、PC-9细胞以 每孔2 ml浓度为每毫升1.0×105个接种于6孔板中, 温箱培养24 h,按实验设计分组给药,作用72 h后 收集细胞。(1)细胞凋亡检测:用PBS洗涤细胞 2次,离心后,收集细胞。加入500 μl的Binding Buffer悬浮细胞,根据说明书加入Annexin V-FITC 和PI染液,混匀、室温、避光,反应10~15 min, 上流式细胞仪检测细胞凋亡率。(2)细胞周期 检测:用PBS洗液洗涤细胞1次,收集细胞。70% 乙醇固定,4℃保存过夜,染色前用PBS洗去固定 液,加入RNase A 37℃水浴30 min。再加入PI染色 混匀,4℃避光30 min,上机检测。实验重复3次。 1.5 Western印迹法检测不同时序给药后EGFR信号 通路p-EGFR、p-AKT、p-ERK及TS酶蛋白的表达
按实验设计分组给药,作用72 h后收集细胞。 细胞裂解液裂解细胞,收集细胞总蛋白。BCA法测定蛋白浓度,将蛋白质样品进行SDS-PAGE电 泳,转移至硝酸纤维膜上;室温封闭2 h,用含 0.05%Tween 200的TBS缓冲液漂洗3次,加入相应 的单克隆抗体(1∶800稀释),4 ℃培育过夜, TBST漂洗3次后加入相应的辣根过氧化物酶标记 的二抗(1∶5 000稀释),37℃摇床温育2 h;电化 学发光显色系统显色、曝光、显影,凝胶分析系 统分析蛋白的表达情况。
1.6 统计学方法采用SPSS13.0统计软件分析,数据采用均数± 标准差表示,多组间计量资料采用单因素方差分 析。以P<0.05为差异有统计学意义。
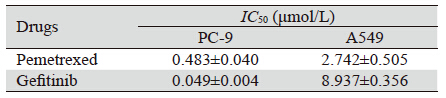
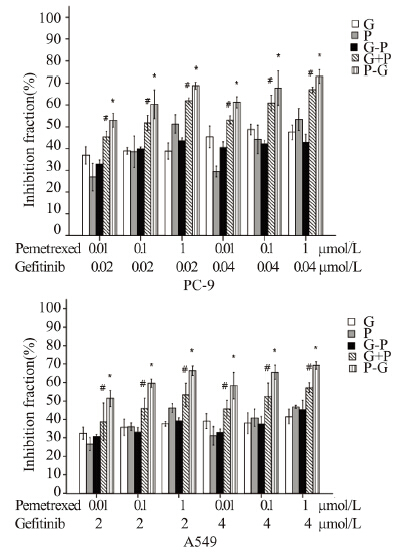
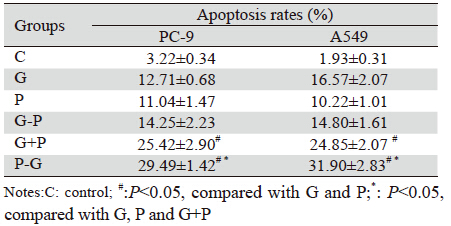
2 结果 2.1 两药不同时序作用PC-9、A549细胞后对细胞 的增殖抑制作用培美曲塞和吉非替尼各浓度单药组对PC-9、 A549细胞均存在增殖抑制作用,呈时间和浓度依赖 性,见图 2。吉非替尼作用A549细胞72 h的IC50远高 于PC-9细胞,约为其200倍,见表 1。两种细胞中, 各个浓度组中培美曲塞序贯吉非替尼组(P-G)、 培美曲塞同步联合吉非替尼组(P+G)均较单药组 抑制率有不同程度提高(P<0.05)。并且培美曲塞 序贯吉非替尼组(P-G)抑制率均更优于培美曲塞 同步联合吉非替尼组(P+G)(P<0.05)。而吉非 替尼序贯培美曲塞组(G-P)对两种细胞的抑制率 均无明显协同增效作用,见图 3。
 |
|
| A: gefitinib on PC-9 cells; B: pemetrexed on PC-9 cells; C: gefitinib on A549 cells; D: pemetrexed on A549 cells 图 2 培美曲塞和吉非替尼单药作用于人肺腺癌细胞PC-9和A549的量效曲线 Figure 2 Dose-effect curves of pemetrexed and gefitinib alone on PC-9 cells and A549 cells |
|
| *: P<0.05,compared with G,P and G+P;# : P<0.05,compared with G and P 图 3 培美曲塞和吉非替尼不同时序给药的联合方式 Figure 3 Different sequences of pemetrexed combined with gefitinib |
在PC-9、A549细胞中分别选择0.04、4.0 μmol/L吉非替尼与1.0 μmol/L培美曲塞单药及联合 作用,吉非替尼单药作用于PC-9、A549细胞72 h 后将细胞主要阻滞在G0/G1期,较C组分别提高约 27.47%、19.31%(P<0.05)。培美曲塞单药作用 于PC-9、A549细胞72 h后将细胞主要阻滞在S期, 较C组分别提高25.34%、24.28%(P<0.05)。培美 曲塞序贯吉非替尼组(P-G)、培美曲塞同步联合 吉非替尼组(G+P)的G2/M期细胞比例在PC-9细 胞中较C组提高10.32%、12.36%,在A549细胞中提高约13.93%、18.74%(P<0.05),见图 4。两种 细胞中,培美曲塞和吉非替尼单药均可以不同程 度的诱导细胞凋亡,培美曲塞序贯(P-G)或同步 联合吉非替尼组(G+P)较单药组均进一步提高 了凋亡率(P<0.05),并且培美曲塞序贯(P-G) 较同步(P+G)联合吉非替尼凋亡效应更加明显 (P<0.05),而吉非替尼序贯培美曲塞(G-P)未 提高单药的凋亡效应,见表 2。
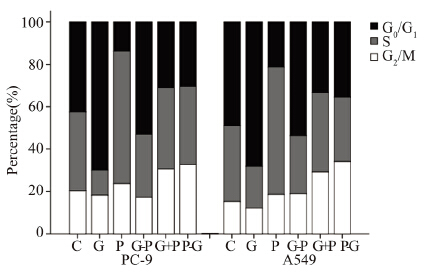
|
| 图 4 培美曲塞和吉非替尼不同时序给药对PC-9和A549细 胞周期的影响 Figure 4 Sequence-dependent effects of pemetrexed and gefitinib on the cell cycles of PC-9 cells and A549 cells |
 |
本课题组前期预实验研究发现PC-9、A549均 表达EGFR,鉴于在两种细胞中得出同样的最佳 给药方式,选择A549细胞采用Western印迹法检 测两药不同时序作用后对细胞p-EGFR、p-AKT、 p-ERK及TS酶蛋白表达的影响。结果表明,A549 细胞较高表达p-EGFR、p-AKT、p-ERK及TS酶 蛋白。与未用药相比,培美曲塞单药可以显著提 高p-EGFR、p-ERK的表达。吉非替尼显著降低p-EGFR、p-AKT、p-ERK及TS酶蛋白的表达,培 美曲塞序贯吉非替尼(P-G)、培美曲塞同步联合吉 非替尼组(P+G)较单药组均进一步降低p-EGFR、 p-AKT、p-ERK的表达 ,见图 5。
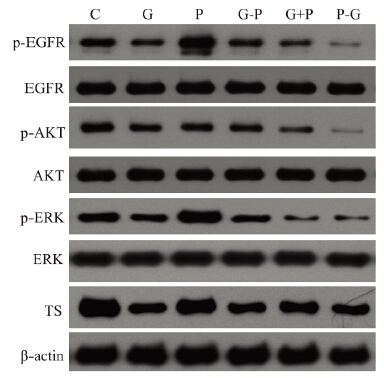
|
| 图 5 培美曲塞和吉非替尼不同时序给药对p-EGFR、 p-AKT、p-ERK及TS酶蛋白表达的影响 Figure 5 Sequence-dependent effects of pemetrexed and gefitinib on the expressions of p-EGFR,p-AKT,p-ERK and TS zymoprotein |
临床研究显示化疗与EGFR-TKI同时或序贯 应用可能存在优势人群,而这种优势人群可能与 EGFR突变状态有关,INTACT-1[3]、INTACT-2[4]、 TRIBUTE[5]和TALENT[6]研究失败的一个重要原因 可能与试验开展时尚没有认识到EGFR-TKI获益的 潜在人群有关。FAST-ACTⅡ研究公布的结果表 明,EGFR突变患者接受化疗序贯厄洛替尼较之序 贯安慰剂,无论是PFS还是OS均显著延长[7, 8]。但 是关于化疗序贯或联合EGFR-TKI是否存在EGFR 突变选择性还存在争议。因此,本实验同时选择 PC-9细胞(EGFR突变型)和A549细胞(EGFR野 生型)进行研究。
本研究中无论是EGFR突变型的PC-9还是 EGFR野生型的A549细胞,培美曲塞序贯吉非替 尼(P-G)、培美曲塞同步联合吉非替尼(G+P)对 细胞的增殖抑制及诱导细胞凋亡作用均优于单药 组,且培美曲塞序贯吉非替尼(P-G)的作用在两 种细胞中均更加显著。
研究发现培美曲塞可以增强EGFR、AKT 、 ERK磷酸化水平,而吉非替尼呈抑制作用。培美 曲塞序贯(P-G)和同步联合吉非替尼(G+P)较 单药组均进一步降低p-EGFR、p-AKT、p-ERK表达。结果说明,化疗可以上调EGFR、AKT、ERK 磷酸化,从而使吉非替尼抑制EGFR、AKT、ERK 磷酸化的敏感度增强,这可能是协同增效的细胞 学机制之一。
Takezawa等[9]曾将吉非替尼或BIBW 2992与 培美曲塞、5-Fu、S-1分别同步联合在多种肺腺癌 细胞中均获得了协同效应,同时发现吉非替尼和 BIBW 2992可以显著降低TS酶,并且认为协同增效 的可能机制之一就是EGFR-TKI降低TS酶从而增加 了培美曲塞、5-Fu、S-1的效应。虽然目前EGFR-TKI 降低TS酶的具体机制还不十分明确,但大量临床研 究已经证实TS酶是培美曲塞疗效的预测指标[10],而 在本研究中同样发现吉非替尼可以显著降低TS酶, 这可能是培美曲塞联合吉非替尼协同增效的另一个 机制,而之所以培美曲塞序贯吉非替尼可以获得更 好的协同效应可能是由于序贯可以避免两药的相互 干扰从而更好的激活EGFR信号通路,使后续的吉 非替尼较之同步联合发挥更强的抑制效应。
吉非替尼序贯培美曲塞无论在PC-9还是在 A549细胞中均未起到协同增效作用,而吉非替尼 抑制细胞的EGFR、AKT、ERK磷酸化不能被培 美曲塞逆转,因此从EGFR信号通路这一角度无法 解释二者为何会产生拮抗作用。通过观察细胞周 期发现,吉非替尼使大部分细胞阻滞在G0/G1期, 而培美曲塞将细胞大部分阻滞在S期。培美曲塞主 要作用于S期,先吉非替尼可能将更多的细胞阻滞 在G0/G1期,因而削弱了后续培美曲塞的作用。另 外,我们还发现在PC-9、A549细胞中,培美曲塞 序贯和同步联合吉非替尼组G2/M期细胞较其他组 细胞比例有所增加。已知化疗药物诱导细胞损伤 后,部分细胞在G2/M期开始DNA修复和分裂,从 而逃避凋亡。培美曲塞序贯或同步联合吉非替尼 可能将细胞阻滞在G2/M期,从而进一步干扰损伤 细胞的修复,维持培美曲塞诱导的凋亡,这或许 可以从细胞周期角度解释培美曲塞序贯或同步联 合吉非替尼可以起到协同增效作用。
本研究初步证实无论在PC-9细胞还是A549细 胞,培美曲塞序贯吉非替尼(P-G)、培美曲塞同 步联合吉非替尼(P+G)均能起到协同增效作用, 且培美曲塞序贯吉非替尼(P-G)方式更优。但是 在药物剂量上存在较大差别,PC-9细胞的敏感度 要远优于A549细胞。但本实验仅仅选择了一种突 变型和一种野生型细胞,还有待于在更多的突变 和野生型细胞加以证实,并且结合临床如何设计最为优化的序贯方案以期更好地指导临床方案的 选择还有待于进一步研究。
| [1] | Takeda K, Hida T, Sato T, et al.Randomized phase Ⅲ trial of platinum-doublet chemotherapy followed by gefitinib compared with continued platinum-doublet chemotherapy in Japanese patients with advanced non-small-cell lung cancer: results of a west Japan thoracic oncology group trial(WJTOG0203)[J]. J Clin Oncol, 2010, 28(5): 753-60. |
| [2] | Pawel JV, Szekely ZP, Vinolas N, et al. A randomized phase Ⅱ study of pemetrexed versus pemetrexed plus erlotinib in secondline treatment for locally advanced or metastatic, non-squamous NSCLC[J].Clin Oncol, 2011, 29 (abstr7526). |
| [3] | Giaccone G, Herbst RS, Manegold C, et al. Gefitinib in combination with gemcitabine and cisplatin in advanced non-small-cell lung cancer:a phase Ⅲ trial-INTACT 1[J]. J Clin Oncol, 2004, 22(5): 777-84. |
| [4] | Herbst RS, Giaccone G, Schiller JH, et al. Gefitinib in combination with paclitaxel and carboplatin in advanced non-small-cell lung cancer: a phase Ⅲ trial-INTACT 2[J]. J Clin Oncol, 2004, 22(5): 785-94. |
| [5] | Herbst RS, Prager D, Hermann R, et al. TRIBUTE: a phase Ⅲ trial of erlotinib hydrochloride (OSI-774) combined with carboplatin and paclitaxel chemotherapy in advanced non-small-cell lung cancer[J]. J Clin Oncol, 2005, 23(25): 5892-9. |
| [6] | Gatzemeier U, Pluzanska A, Szczesna A, et al. Phase Ⅲ study of erlotinib in combination with cisplatin and gemcitabine in advanced non-small-cell lung cancer: the Tarceva Lung Cancer Investigation Trial[J]. J Clin Oncol, 2007, 25(12): 1545-52. |
| [7] | Wu YL, Lee JS, Thongprasert S, et al. Intercalated combination of chemotherapy and erlotinib for patients with advanced stage nonsmall- cell lung cancer (FASTACT-2): a randomized, double-blind trial[J]. Lancet Oncol, 2013, 14(8): 777-86. |
| [8] | Mok TSK, Lee JS, Zhang L, et al. Biomarker analyses and overall survival(OS) from the randomized, placebo-controlled, phase 3, FASTACT-2 study of intercalated erlotinib with gemcitabine/platinum in first-line advanced non-small cell lung cancer(NSCLC)[J/OL]. Ann Oncol, 2012, 23(Suppl9): a12260[2012-11-25].http://www.webges.com/cslide/library/esmo/mylibrary/search/author/0/L.20%Zhang. |
| [9] | Takezawa K, Okamoto I, Tanizaki J, et al. Enhanced anticancer effect of the combination of BIBW2992 and thymidylate synthase-targeted agents in non-small cell lung cancer with the T790M mutation of epidermal growth factor receptor[J]. Mol Cancer Ther, 9(6):1647-56. |
| [10] | Chen CY,Chang YL,Shih JY,et al.Thymidylate synthase and dihydrofolate reductase expression in non-small cell lung carcinoma: the association with treatment efficacy of pemetrexed[J]. Lung Cancer, 2011, 74(1):132-8. |
 2014, Vol. 41
2014, Vol. 41


