文章信息
- 杜泽森,傅俊惠,郑春鹏,李卓毅,郑浩胜. 2014.
- 胸腹腔镜联合切除SiewertⅡ型食管胃交界部腺癌48例
- 肿瘤防治研究, 2014, 41(11): 1234-1236
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.11.015
-
文章历史
- 收稿日期:2013-08-19
- 修回日期:2014-02-24
食管胃交界部腺癌( a d e n c a r c i n oma o f esophagogastric junction,AEG) 是指病变中心位于 解剖学食管胃交界部(esophagogastric junction, EGJ)上下各5 cm范围内的腺癌,是不同于食管癌 与胃癌的特殊类型癌。AEG按Siewert分型划分为三 种类型[1]:(1)SiewertⅠ型:肿瘤中心位于EGJ上 方1~5 cm的远端食管腺癌;(2)SiewertⅡ型:肿 瘤中心位于EGJ上方1 cm 与下方2 cm之间的腺癌, 即传统意义上的“贲门癌”。(3)SiewertⅢ型:肿 瘤中心位于EGJ下方2~5 cm的腺癌。由于解剖学上 的特殊性,目前对于食管胃交接部癌特别是Siewert Ⅱ型的外科手术方式仍有争议。本院胸腹腔镜技术 自2012年1月开始开展,对SiewertⅡ型AEG行胸腹 腔镜下切除加胸腹腔淋巴结清扫,至今共48例,取 得满意效果,现报道如下。 1 资料与方法 1.1 一般资料及入选指征
2012年1月至2013年3月期间中山大学附属 汕头医院肿瘤外科行手术治疗且资料完整的AEG 病例共计48例,均经胃镜检查及术后病理确诊为 SiewertⅡ型AEG。其中男32例,女16例,年龄 39~73岁,平均(56.04±6.96)岁。所有患者术前 常规行上消化道钡餐造影点片及胸、腹部CT平扫 加增强扫描,均未提示明显外侵及远处转移,肿 瘤最大径<5 cm;术前6例合并高血压病,5例合并 慢性支气管炎,2例合并冠心病,心脏彩超及肺功 能检查均提示可耐受手术。既往无胸、腹部手术 史。所有患者既往未行放、化疗及手术治疗。
所有AEG患者按照国际Si ewe r t 抗癌联盟 (UICC)推出的第七版分期系统分期,其中 SiewertⅡ型患者Ⅰ期3例,Ⅱ期19例,Ⅲ期26例。 全部病例术后均有明确的病理诊断和淋巴结病理 检查资料,病理类型:贲门腺癌41例,贲门黏液 腺癌4例,贲门神经内分泌癌2例,贲门腺鳞癌1 例;切缘:45例阴性、3例阳性;其中上切缘阳性 1例、下切缘阳性2例。对于Ⅱ期及Ⅲ期患者术后 常规辅助化疗,对肿瘤外侵明显及切缘阳性患者 予辅助放化疗。 1.2 手术方法
麻醉采用双腔气管插管,静脉复合麻醉。术 前常规留置胃管行胃肠减压。 1.2.1 腹腔镜操作
取平卧分腿、头高脚低30度 体位。取脐下缘为腹腔镜观察孔,行穿刺建立气 腹,置入10 mm穿刺器及腔镜进行探查,确定病 灶可切除、腹腔无明显转移。在双侧锁骨中线肋 缘下2 cm和脐水平上2 cm行穿刺建立4个操作孔。 术者立于患者左侧,第一助手立于患者右侧,扶 镜者位于患者两腿之间。腹腔镜下术者用超声刀 沿横结肠上方游离胃结肠韧带,注意保留胃网膜 右动脉及深面的结肠中动脉,离断脾胃韧带,沿 胰尾上缘寻找胃胰皱襞,解剖腹腔动脉及其3个分 支,即胃左动脉、肝总动脉、脾动脉,血管骨骼 化后于根部用Hem-o-lok止血夹结扎。继续向后上 解剖结扎胃后动脉及膈下动脉,并行贲门左淋巴 结清扫;游离胃网膜囊,沿胃小弯往上清扫胃小 弯及贲门右淋巴结。暴露左右膈肌脚,适当扩大 食管裂孔。放置腹腔引流管,关闭切口。 1.2.2 胸腔镜操作
取左侧半俯卧位,取右侧第7 肋间腋中线及腋后线之间作为观察孔,置入10 mm trocar及30°镜,单肺通气,胸腔正压通气,压力 调至4~6 mmhg。取腋后线与肩胛后线中点第八 肋间做一个1.5 cm操作孔,取腋前线第3肋间及肩胛后线第5肋间各做一个0.5 cm操作孔。在奇 静脉弓离断处,切开食管和胸主动脉之间的纵隔 胸膜,进入食管后间隙,在胸内筋膜表面向上游 离至奇静脉弓水平,游离奇静脉,用组合夹双重 钳夹奇静脉后切断;向下游离至膈肌并与腹膜后 间隙相通,在食管固有动脉的根部超声刀离断血 管,清扫中、下段食管旁淋巴结;贴近心包切开 纵膈胸膜,进入心包后间隙,清扫下肺韧带淋巴 结及隔上淋巴结,向上游离至隆突下,清扫隆突 下淋巴结。 1.2.3 胸部辅助小切口行管状胃及食管残胃吻 合
在第6肋间腋后线至肩胛骨下角线做长约5 cm 辅助小切口,保留前锯肌和背阔肌,只进行钝性 分离而不切断或仅切断少许。用卵圆钳分离、扩 大食管膈肌裂孔,将胸段食管及胃向胸膜顶方向 轻柔牵拉,将胃拉入胸腔,用EndoGIA沿小弯侧 向幽门方向切割,做成大小约5 cm×30 cm的管状 胃;在肿瘤上方5~7 cm用荷包钳作食管荷包缝 合,置入25 mm管状吻合器抵钉座后切断食管; 切开管状胃末端,向幽门方向放入吻合器并穿出 胃前壁,与食管进行吻合,在距吻合口2 cm处用 EndoGIA切除多余的管状胃末端。经辅助小切口 手辅助常规放置胃管、鼻肠管。清洗胸腔,经观 察孔放置胸腔引流管,关胸。 1.3 术后处理
手术后按胸、腹外科全麻术后常规护理,并 留置硬外镇痛泵,术后第1天开始抗感染、补液、 补钾、维持内环境稳定等对症支持治疗,术后第2 天协助患者咳嗽、排痰,术后第3日开始给予肠内 高营养,必要时予白蛋白静脉滴注,生命指标平 稳者鼓励患者翻身下床活动,第4天拔除硬外镇痛 泵,排尿功能恢复后予拔除尿管,第6、7天后复 查上消化道造影点片了解吻合口及肺部情况,如 无异常,予拔除胃管、鼻肠管及胸腔引流管,第8 天开始流质饮食,以后逐步恢复正常饮食。 2 结果 2.1 手术相关临床指标
48例手术均获成功,无一例中转开腹或开 胸,无围手术期死亡病例;手术时间140~280min,平均(195.42±46.68) min;术中出血 80~320 ml,平均出血(146.35±76.60) ml;术后 引流(1028.5±402.5)ml;术后肛门排气时间平均 (2.15±1.24)d;平均住院(11.84±3.92)d。 2.2 清扫淋巴结情况
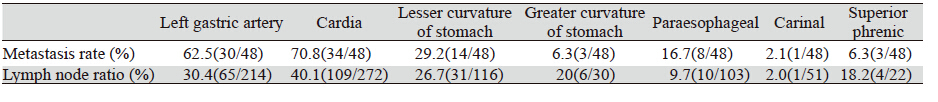
48例共清扫淋巴结808枚,平均16.8枚/例,其 中腹腔淋巴结632枚,平均13.2枚/例,胸腔淋巴 结176枚,平均3.7枚/例。48例患者有41例有淋巴 结转移,转移率为85.4%,其中胸腔淋巴结转移 率为18.8%(9/48),腹腔淋巴结转移率为83.3% (40/48)。48例患者转移淋巴结共226枚,转移度 为28.0%(226/808),其中胸腔转移淋巴结10枚, 转移度为5.7%(10/176),腹腔转移淋巴结216 枚,转移度为34.2%(216/632)。主要各组淋巴结 清扫情况具体如表 1。
 |
6例术后出现并发症,发生率为12.5%(8/48)。 其中,肺部感染3例,心率失常1例,功能性胃排 空障碍2例,吻合口瘘1例,经保守治疗后均痊愈 出院。术后随访2~15月,无肿瘤复发转移及死亡 病例。 3 讨论
食管胃交接部腺癌的外科治疗策略近年来备 受关注。SiewertⅢ型AEG,由于其淋巴引流规律 与胃癌类似,且随着器械的进步目前经腹入路通 常即可获得满意的切缘,故常经腹入路。Siewert Ⅰ型AEG,则常剖左胸或选用胸腹Ivor-Lewis术 式。SiewertⅡ型AEG的手术方式目前仍争议较 大。经腹入路创伤小,可以满意地对胃周淋巴结 进行清扫,但缺点在于对纵隔淋巴结清扫受到一 定限制,为获得足够切缘行纵隔内食管切除、吻 合较为困难,存在吻合口瘘风险;剖左胸入路可 以将术野充分暴露,切除足够长度的食管保证确 切吻合及足够切缘,同时可对胸下段食管旁及膈 肌旁等处淋巴结彻底清扫,不足在于腹腔淋巴结 清扫不彻底;经右胸、腹Ivor-Lewis入路可同时满 足胸、腹腔淋巴结的清扫,但创伤较大。
有学者认为,随着器械的不断改进,大部分 SiewertⅡ型AEG可经腹切除,经膈肌裂孔可往上分离5 cm左右并行吻合,推荐经腹入路。然而, 经腹入路的上切缘阳性率高,且只要肿瘤侵及食 管,就有7%~37%的胸腔转移率[2]。Kakeji等[3]研究 结果提示,对SiewertⅡ型AEG行下纵膈及腹腔的 淋巴结清扫是较理想的术式,其能获得足够的切 缘并能彻底清扫纵膈及腹腔的淋巴结。随着微创 技术的发展,胸腹腔镜联合治疗AEG成了一种新 的选择。腹部无开放切口,腹壁屏障损伤少,腹 式呼吸影响小,有利于术后呼吸功能的恢复,有 利于术后患者有效地咳嗽、咳痰;腔镜能提供很 好的视野、灯光及角度,便于局部解剖的观察, 使得淋巴结的清扫更加精细,出血更少。 胸腔镜 辅助小切口无需切断背部肌肉与神经,肋骨一般 无骨折,患者胸部手术创伤小,术后疼痛较轻, 同样有利于术后患者地有效咳嗽、咳痰,减低了 术后肺部感染的发生率。Noshiro等[4]研究结果提 示,胸腹腔镜治疗食管胃交接部腺癌是安全可行 的。本研究中,所有手术均获成功,无一例中转 开腹或开胸,无围手术期死亡病例,平均清扫淋 巴结16.8枚/例,证明了胸腹腔镜联合切除Siewert Ⅱ型AEG技术上是安全、可行的。
胸腹腔镜联合AEG切除的一大优势是可同时 满足胸腹腔淋巴结的清扫。由于食管胃交接部的 黏膜下层、肌层和浆膜下层均有丰富的淋巴网, 与食管和胃的淋巴管相通,形成多条淋巴引流通 道,因此,食管胃交界部腺癌具有向纵隔、腹腔 淋巴结转移的特点,以上导致AEG淋巴结转移范 围广泛且转移率高。本研究结果提示,SiewertⅡ 型AEG的转移率为85.4%,其中胸、腹腔的淋巴 结转移率分别为18.8%与83.3%,从分布看,胃 左动脉旁及贲门旁仍是转移高发部位,但食管旁 淋巴结及隔上淋巴结均有一定的转移率,因此对 SiewertⅡ型AEG而言,下纵隔的清扫是必须的。
辅助小切口对手术的完成有重要的作用。日本 胸外科医生Morihito最早在同一台手术中综合运用 视频辅助胸腔镜手术 (video-assisted thoracoscopic surgery,VATS)和保留肌肉胸廓切开术(musclesparing thoracotomy,MST)的复合微创胸外科技 术,并命名复合杂交(Hybrid)技术[5],认为其弥补全腔镜下手术操作难度大、危险度高的不足; 与传统手术相比创伤小、术后恢复快,同时仍可 保证直视的优势,保证肿瘤切除和淋巴结清扫的 彻底性和安全性,目前被广泛应用于肺叶切除。 笔者将Hybrid技术应用于AEG的手术中,主要有 以下考虑:AEG患者就诊时通常已是局部晚期, 即使予新辅助治疗后往往病灶仍较大,在手术过 程中若腔镜下处理有难度,可酌情经由辅助小切 口操作,利用直视及触觉的优势,保证肿瘤切除 和淋巴结清扫的彻底性和安全性。胸部小切口的 应用也可以用于有一定外侵或者有胸腹部外伤手 术史的患者,使得手术的适应证相对放宽,同时 也降低了手术的难度,手术时间缩短。Hybrid技术 的微创切口不仅可作为辅助切口,同时也是吻合 操作口,并常规经此小切口辅助放置鼻肠管,一 举多用,更是符合了爱惜组织、充分利用组织、 减少创伤的理念。
微创外科是发展的必然趋势,但由于食管胃 交接部腺癌其特殊复杂解剖学及生物学特点,目 前国内尚未发现胸腹腔镜联合治疗食管胃交界部 腺癌的相关报道。今后需进一步规范其手术操 作,并完善积累随访资料,证实其远期效果。
| [1] | Siewert JR, Stein HJ. Classification of adenocarcinoma of the oesophagogastric junction[J]. Br J Surg, 1998, 85(11):1457-9. |
| [2] | Sasako M, Sano T, Yamamoto S, et al. Left thoracoabdominal approach versus abdominal-transhiatal approach for gastric cancer of the cardia or subcardia:a randomised controlled trial[J]. Lancet Oncol, 2006, 7(8):644-51. |
| [3] | Kakeji Y, Yamamoto M, Ito S, et al. Lymph node metastasis from cancer of the esophagogastric junction,and determination of the appropriate nodal dissection[J]. Surg Today, 2012, 42(4):351-8. |
| [4] | Noshiro H, Miyasaka Y, Akashi M, et al. Minimally invasive esophagogastrectomy for esophagogastric junctional cancer[J]. Ann Thorac Surg, 2012,93(1):214-20. |
| [5] | Okada M, Sakamoto T, Yuki T, et al. Hybrid surgical approach of video-assisted minithoracotomy for lung cancer:significance of direct visualization on quality of surgery[J]. Chest, 2005,128(4):2696-701. |
 2014, Vol. 41
2014, Vol. 41
