文章信息
- 宋妮,周京旭,林丽珠. 2014.
- SONG Ni,ZHOU Jingxu,LIN Lizhu. 2014.
- 益气除痰方对A549细胞增殖抑制并诱导凋亡的研究
- Yiqi Chutan Decoction Inhibits Proliferation and Induces Apoptosis of A549 Cells
- 肿瘤防治研究, 2014, 41(11): 1200-1204
- Cancer Research on Prevention and Treatment, 2014, 41 (11): 1200-1204
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.11.042
-
文章历史
- 收稿日期:2013-08-20
- 修回日期:2014-01-24
2.510405 广州,广州中医药大学第一附属医院肿瘤科
2.The First Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou 510405, China
益气除痰方由党参、法夏、白术、云苓、栝 蒌皮、鱼腥草、露蜂房、枳实等组成。君药为党 参、半夏益气健脾化痰;臣药白术、云苓健脾化 痰,鱼腥草清热化痰,露蜂房消积化痰;佐药枳 实破气行痰消积;使药栝蒌皮化痰理气宽胸;各 药作用共发挥益气健脾、宣肺化痰等功效。在前 期临床研究[1]中已发现该方加减用于中晚期老年非 小细胞肺癌患者可显著延长中位生存期至13月, 具有一定的临床疗效。本文采用血清药理学方法 进一步研究其抗肿瘤作用机制。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级SD大鼠30只,150~180 g, 雌雄各半,动物质量合格证号:0045100,许可证 号:SCXK(粤)2006~0015,由南方医科大学实 验动物中心提供;饲养于广州中医药大学第一附 属医院实验中心,实验动物使用许可证号:SYXK (粤)2008-0092。
1.1.2 药物与试剂中药材购自广州中医药大学第 一附属医院门诊部;RPMI1640培养液购自Gibco公 司;MTT [溴化-3(4,5-二甲基-2-噻唑基-2,5-二苯 基四氮唑丁)] (以三蒸水配制成5 mg/ml浓度)、 二甲基亚枫(DMSO)和PI染液购自Sigma公司; 顺铂注射液购自南京制药厂有限公司(批号: 20071105)。
1.1.3 细胞株人肺腺癌A549细胞株由南方医科 大学惠赠。将肺腺癌A549细胞接种于含10%灭活 新生小牛血清的RPMI1640培养液中,置培养箱于 5%CO2、37℃、100%湿度条件下培养传代,取对 数生长期细胞进行实验。
1.2 方法 1.2.1 益气除痰方汤剂的制备按益气除痰方组 成准确称取各药材,以纯净水浸泡中药高出药面 约3 cm,浸泡约30 min,按常规煎煮三次[2],将所 有的药液混合后于文火煎煮,浓缩制成每毫升含 有1.5 g生药材的汤剂。分装后4℃保存。
1.2.2 益气除痰方含药血清的制备(1)灌胃量 计算: 根据粗略估算法[3],给予益气除痰方药量= 70×0.018×5×10g/(kg·d)=63g/(kg·d)(相当于成 人用药剂量的10倍),灌胃量=42 ml/(kg·d)。 (2)分组及给药: 大鼠标号、称重、随机分两组: 益气除痰方药物组和阴性对照组。益气除痰方药物 组灌胃益气除痰方汤剂,阴性对照组灌胃0.9%氯化 钠溶液。每天剂量分两次灌胃,间隔约8 h,连续 灌胃5天[4],第4天晚上开始禁食不禁水,于末次灌 胃后1 h取血;3%戊巴比妥钠麻醉,腹主动脉取血。 (3)血清制备: 将血液置于消过毒的离心管中,做 好标记。室温下静置2~3 h后以3 000 r/min离心10~15 min,分离血清,将同组血清混合;56℃灭活30 min;过滤灭菌;分装后于-20℃冰箱保存备用。
1.2.3 MTT法测定益气除痰方含药血清对A549细 胞增殖的抑制作用并确定血清添加量(1)接 种、培养细胞 取对数生长期细胞制备成单个细 胞悬液,以每孔1 000个细胞接种于96孔培养板, 分10组,每组设四个复孔,每孔体积200 μl;共 3块96孔培养板。放入37℃、5%CO2培养箱中培 养,24 h观察A549细胞贴壁后,吸掉培养液,分 别加入空白对照组(35%新牛血清)、阴性对照 组(35%大鼠未加药物处理血清)、5%、10%、 15%、20%、25%、30%、35%(益气除痰方含药 血清)、3 μg/ml DDP(阳性对照组),各组分别设 四个复孔,继续培养。(2)呈色、比色 分别培 养24、48、72 h后,吸掉培养液,各孔加入无血 清RPMI1640培养液40 μl+MTT溶液10 μl,37℃孵 育3 h,终止培养,弃孔内培养液,每孔加入150 μl DMSO,振荡10 min。选择490 nm波长,酶联免 疫检测仪测定各孔光吸收值,记录结果。并按照 下列公式计算细胞活性(%):细胞活性=T/D× 100%(T:各测定孔细胞的光吸收值;D:对照孔 细胞的平均光吸收值)
1.2.4 琼脂糖凝胶电泳收集经过阴性血清、10% (低剂量)、20%(中剂量)、30%(高剂量)含 药血清及阳性对照处理的细胞,提取DNA(试剂 盒),定量后制备胶板,将琼脂糖溶液倒入电泳 支架上,放上梳子,梳子离开电泳支架底部1 mm 左右。待凝胶凝聚后,小心拔去梳子,将支架放 入装有电极缓冲液(1×TBE Buffer)的电泳槽中, 各孔加2 μl溴酚蓝和7 μl DNA样品,点样端朝负 极,通电,电压为80 V。至溴酚蓝移到距边3 cm 处停止电泳,取出凝胶,紫外灯下检测。
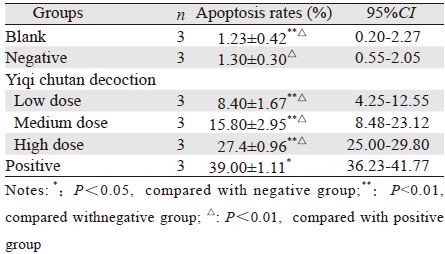
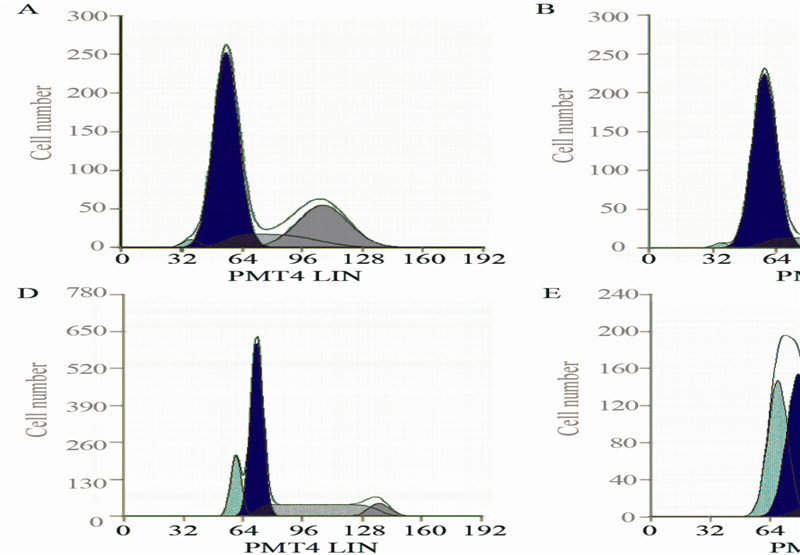
1.2.5 流式细胞仪(PI单染法)检测细胞凋亡设 置含药血清培养浓度,经过阴性血清、10%(低 剂量)、20%(中剂量)、30%(高剂量)含药血 清及阳性对照处理后,收集细胞,计数,调整细 胞浓度为每毫升1×106。取1 ml细胞,1 000 r/min, 4℃离心5 min,弃上清液。PBS清洗两次后,70% 乙醇固定过夜。1周之内检测,检测前4℃条件下 PBS清洗,加入PI染液1 ml,避光30 min。流式 细胞仪上机检测,记录激发波长488 nm处红色 荧光,细胞凋亡时,G1期前出现亚二倍体峰(凋 亡峰)。
2 结果 2.1 益气除痰方含药血清对A549细胞体外生长的 抑制作用倒置显微镜下观察空白组、阴性组、不同含 药血清组及阳性组各孔细胞生长及形态变化。24 h 除阳性组外,其余各组细胞形态变化不明显,经 顺铂处理的阳性组细胞缩小、包膜完整;48、72 h 时观察25%、30%、35%含药血清组细胞形态发生变化,细胞呈空泡状改变,且随着浓度的增高, 状态更差,但是细胞在数量上是增多的,阳性组 细胞缩小的数量增加,总体数量增多不明显。益 气除痰方含药血清及阳性组对A549细胞活性的影 响,以其空白组细胞活性为参考标准,实验结果 显示:含药血清对A549细胞活性具有抑制作用, 且时间和血清浓度对细胞的生长有显著的影响 (Univariate分析P均小于0.01),见表 1,并最终 确定10%、20%、30%含药血清为实验浓度。
 |

|
| 0: Negative; 1: Low dose; 2: Medium dose; 3: High dose; 4:Positive; 5: DNA marker 图 1 A549细胞DNA琼脂糖凝胶电泳图 Figure 1 Agarose gel electrophoresis of A549 cell DNA |
 |
|
| A: blank group (1.23±0.42)%; B: negative group(1.30±0.30)%; C: low dose group(8.40±1.67)%; D:medium dose group(15.80±2.95)%; E: high dose group(27.4±0.96)%; F: positive group(39.00±1.11)% 图 2 流式细胞仪检测A548细胞凋亡 Figure 2 Apoptosis of A548 cells detected by flow cytometry |
肺癌为有形之块,中医以“积”“癥”名之。肺 癌是在机体气血阴阳等物质匮乏的基础上,或因 禀赋、或因六淫、或因饮食、或因邪毒,导致脏 腑经络功能失调,肺失宣降,气机不利,血行瘀 滞,津液不布,生成瘀血痰浊等病理产物,通过 邪正斗争的矛盾运动,邪胜正衰而成,是一种全 身属虚,局部属实的疾病。中晚期肺癌证型具有 多样性和复杂性,一系列对中晚期肺癌证型的调 查研究显示:在各证型中以气虚为主的兼挟证最 多[1],气虚、脾虚痰湿证常见证型之一[5, 6, 7]。《难 经》说:“损其肺者,益其气……”。周岱翰教 授、林丽珠教授在长期的临床实践中确立益气除 痰法为中晚期肺癌的治疗大法,并进行了相关 临床研究[1],结果提示益气化痰法可使Ⅲ、Ⅳ期 NSCLC的中位生存期达到9月,与化疗配合应用 可达到12月,是晚期非小细胞肺癌的一种有效疗 法。其中,脾虚痰湿型患者中位生存期达到13 月,有可能进一步提高疗效。并有研究[8, 9, 10]提示其 可以改善中晚期非小细胞肺癌患者的生存质量, 减轻化疗的不良反应。
“药物血清”的概念最早于80年代由日本昭和药 科大学田代真一教授提出[11]。所谓“药物血清”,是 指给动物或人服用一定量的药物后。经过一定的 时间采血所获得的血清,以模拟并试图替代药物 本身而供实验研究使用的一种非单体药物药理研 究的方法。近20余年,该方法在中药基础研究中 发挥着重要的作用。但目前,该方法在国内还没有 统一的规范方法,其中很多细节问题需要解决。
在本实验中,根据相关文献报道[4, 12],选用大 鼠作为含药血清的供体,并以整体模型动物的有 效剂量(为临床成人剂量的10倍量)给药,并连续 给药5天,使药物达到稳定的血药浓度。取血后置于56℃灭活血清,去除血清中存在的补体,减少对 实验的影响。但血清成分复杂,不可控的影响因素 很多,血清本身固有的活性成分常影响实验结果, 缺乏除去影响因素的理想措施[13]。故本实验设计空 白对照组(新生牛血清)与阴性对照组(大鼠空白 血清),以排除大鼠血清自身因素引起的干扰。
MTT比色实验中[14],在一定细胞数范围内, MTT结晶形成的量(光吸收值)与细胞数成正 比。利用此原理测定空白组、阴性组及不同浓度 含药血清处理组在适宜条件下培养后光吸收值变 化,以空白组光吸收值为基准,算出各组相对 量,以此来表示各实验组的细胞活性,据此建立 MTT法用于检测药物对细胞增殖的抑制作用。通 过本实验数据分析发现,益气除痰方含药血清对 肺腺癌A549细胞增殖具有抑制作用,具有明显的 剂量依赖性,高剂量组效果相对较好,但是,血 清浓度过高本身对细胞生长具有影响,35%含药 血清组对细胞生长的影响不稳定,故最终确定了 10%、20%、30%为实验浓度。琼脂糖凝胶电泳试 验可对分离的DNA进行检测,该研究中琼脂糖凝 胶电泳提示高剂量组及阳性组均可见明显的DNA Ladder条带,而阴性组及低、中剂量组均未见明显 条带,说明益气除痰方含药血清达到一定浓度后 可诱导A549细胞凋亡,而中、低剂量组未见凋亡 条带,可能因含药血清浓度低,无法诱导凋亡, 或者细胞凋亡数量较少有关。细胞凋亡在机体的 胚胎发育、组织修复、内环境的稳定等方面起着 十分重要的作用。Propidium iodide(PI)是一种核 酸染料,它不能透过完整的细胞膜,但在凋亡中 晚期的细胞和死细胞,PI能够透过细胞膜而使细 胞核红染。PI单染法中,测定不同处理的实验组 的细胞凋亡率经单因素方差分析统计后,差异有 统计学意义(P<0.05);不同浓度含药血清组之 间凋亡率比较差异有统计学意义(P<0.05),表 现为明显的剂量依赖关系;但各组与阳性组比较 差异有统计学意义(P<0.05)。
实验以顺铂为阳性对照组,其诱导凋亡作用 较中药组明显,考虑与体外实验与体内实验具有 差异、含药血清中药物浓度难以确定、化疗药物 直接作用比较强等因素相关。
综上所述,本实验研究采用含药血清体外培 养的方法证实了益气除痰方对A549细胞具有明显 的抑制增殖和诱导凋亡的作用,但其作用机制尚 需进一步的研究。
| [1] | Zhou DH, Lin LZ, Zhou YQ, et al. The role of TCM method for invigorating Qi and removing the phlegm in prolongating median survival time in the patient with non-small cell lung cancer[J]. Zhong Yi Za Zhi, 2005, 46(8): 600-2.[周岱翰, 林丽珠, 周宜强, 等. 益气除痰法延长非小细胞肺癌中位生存期的作用[J]. 中医 杂志, 2005, 46(8): 600-2.] |
| [2] | Chen CM,Li YH. Analyses of traditional Chinese medicine decoction method[J]. Xian Dai Zhong Xi Yi Jie He Za Zhi,2006,15(4): 488-9.[陈春梅, 李勇华. 中药煎服法浅析[J]. 现 代中西医结合杂志, 2006, 15(4): 488-9.] |
| [3] | Chen Q. Study on the method of traditional Chinese Medicine Pharmacology[M]. Third edition. Beijing:People's Medical Publishing House, 2011: 1262-4.[陈奇. 中药药理研究方法学[M]. 第3版. 北京:人民卫生出版社, 2011: 1262-4.] |
| [4] | Li ZG, Wang JJ. The thinking on the methodology of serum pharmacology on Chinese materia medica[J]. Zhongguo Zhong Yi Yao Xin Xi Za Zhi, 2002, 9(2): 5-6.[李振光, 王净净. 关于中药血 清药理学方法的思考[J]. 中国中医药信息杂志, 2002, 9(2): 5-6.] |
| [5] | Hu XM, Zhang PT, Yang ZY, et al. A study on distribution of traditional Chinese medicine syndromes in patients with advanced non-small cell lung cancer[J]. Zhongguo Zhong Liu,2007,16(1): 51-3.[ 胡小梅,张培彤,杨宗艳,等. 中晚期非小细胞肺癌患者中 医证型分布规律研究[J]. 中国肿瘤, 2007,16(1): 51-3.] |
| [6] | Chen T,Chen MH. Statistical analysis of clinical types of primary bronchogenic carcinoma of lung in TCM literature[J]. Shizhen Guo Yi Guo Yao, 2006, 17(5): 854-5.[陈涛,陈茂华. 原发性支 气管肺癌临床证型的文献统计分析[J]. 时珍国医国药, 2006, 17(5): 854-5.] |
| [7] | Sun LL, Lin LZ. Theoretical study and clinical application of TCM method for invigorating Qi and removing the phlegm in curing lung cancer[J].Zhong Yi Yan Jiu,2011,24(10): 1-3.[孙玲玲, 林丽珠.益气除痰法治疗肺癌理论探讨及临床应用[J].中医研 究, 2011, 24(10): 1-3.] |
| [8] | Zhang EX. Effect of clinical study on improving life quality of patients suffering lung cancer of non-small cell carcinoma at advanced stage with treating methodology of nourishing qi dissipating phlegm[J]. Zhong Yi Yao Xue Bao,2006,34(5): 20-1.[张恩欣. 益气除痰法提高晚期非小细胞肺癌患者生存质 量的临床研究[J]. 中医药学报, 2006, 34(5): 20-1.] |
| [9] | Zhang EX. Effect of invigorating qi and expelling phlegm method and radiofrequency ablation on living quality of patients with medium and advanced lung cancer[J].Fujian Zhong Yi Yao,2009,40(5):16-7.[张恩欣.益气除痰法结合射频消融对中晚 期肺癌患者生存质量的影响[J].福建中医药, 2009, 40(5): 16-7.] |
| [10] | Chen XZ,Wang YJ,Tian HQ,et al. The clinical curative effect of TCM method for invigorating Qi and removing the phlegm combining with chemotherapy in curing advanced non small cell lung cancer [J].Zhongguo Yi Yao Zhi Nan, 2012,10(19): 332-3. [陈 学彰,王艳杰,田华琴,等.益气除痰法结合化疗治疗中晚期非小 细胞肺癌的临床疗效观察[J].中国医药指南, 2012,10(19):332-3.] |
| [11] | Iwama H, Amagaya S, Ogihara Y. Effect of shosaikoto, a Javanese and Chinese herbal medicinal mixture on the mitogenic activity of lipopolysaccharide, a new pharmacological testing method[J]. J Ethnohparmacol, 1987, 21(1): 45-53. |
| [12] | Zhao WH, Cao YX, Yuan ZF. The methodology exploration of serum pharmacology on Chinese materia medica[J]. Zhong Yao Xin Yao Yu Lin Chuang Yao Li, 2002, 13(2): 122-4.[赵万红,曹永 孝,袁泽飞.中药血清药理学的方法学探讨[J].中药新药与临床 药理, 2002, 13(2): 122-4.] |
| [13] | Zhang HM,Xi e CG,Chen SW. An As s e s sment on the Pharmacological Test of Drug Contained Serum[J]. Zhongguo Zhong Xi Yi Jie He Za Zhi, 2004, 24(8): 741-5.[张红敏, 谢春光, 陈世伟.含药血清体外药理试验的评价[J]. 中国中西医结合杂 志,2004, 24(8): 741-5.] |
| [14] | Shi C,Wan LG. Detection method of cell proliferation [J]. Shi Yan Yu Jian Yan Yi Xue, 2012, 30(2): 153-5, 168. [石淙,万腊根. 细胞 增殖的检测方法[J]. 实验与检验医学, 2012, 30(2): 153-5, 168.] |
 2014, Vol. 41
2014, Vol. 41


