文章信息
- 刘家美,刘俊,冯学泉,徐新女,刘宏胜,张飚,吴静超,王金环. 2014.
- LIU Jiamei, LIU Jun, FENG Xuequan, XU Xinnv, LIU Hongsheng, ZHANG Biao, WU Jingchao, WANG Jinhuan. 2014.
- 腺病毒介导靶向碱性成纤维细胞生长因子siRNA载体的构建及鉴定
- Construction and Identification of Recombinant Adenovirus Vector of Small Interfering RNA Targeting Basic Fibroblast Growth Factor
- 肿瘤防治研究, 2014, 41(11): 1186-1189
- Cancer Research on Prevention and Treatment, 2014, 41 (11): 1186-1189
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.11.028
-
文章历史
- 收稿日期:2013-08-21
- 修回日期:2013-10-07
2.300060 天津,天津市环湖医院神经外科
3.300192 天津,天津市第一中心医院神经外科
4.300192 天津,天津市第一中心医院卫生部危重病急救医学重点实 验室
2. Department of Neurosurgery, Tianjin Huanhu Hospital, Tianjin 300060, China
3. Department of Neurosurgery, Tianjin First Center Hospital, Tianjin 300192, China
4. Key Laboratory for Critical Care Medicine of The Ministry of Health, Tianjin 300192, China
碱性成纤维细胞因子(basic fibroblast growth factor,bFGF)与恶性脑胶质瘤具有密切的相关 性,bFGF在恶性胶质瘤中高表达,且表达水平 与胶质瘤的恶性程度和分级正相关[1, 2],本课题组 前期应用小分子RNA(siRNA)干扰的方法“沉 默”bFGF,结果表明降低bFGF表达水平可明显诱 导胶质瘤细胞的凋亡,抑制肿瘤细胞的增殖[3, 4],因此bFGF基因可作为胶质瘤基因治疗的一个良好 靶点。本研究拟采用体外LR重组法,构建携带靶 向bFGF基因的小分子干扰RNA重组腺病毒载体, 并应用Western blot方法验证其作用效果。
1 材料与方法 1.1 材料bFGF-siRNA的正义链为5′-CGAACUGGGCA GUAUAAACTT-3′,反义链为5′-GUUUAUACUGC CCAGUUCGTT-3′; 含bFGF-siRNA、U6启动子和 BglⅡ/EcoRⅠ酶切位点的pGenesil-1-bFGF-siRNA 的质粒(专利号:ZL200810053006.x)、腺病毒 穿梭质粒pGStrack、腺病毒骨架质粒pGSadeno购 自晶赛公司;大肠杆菌DH5α,HEK293细胞为本 室保存;T4 DNA连接酶及限制性内切酶均购自 Takara公司;LR克隆酶Ⅱ购自Invitrogen公司;脂 质体转染试剂Metafectence购自Biontex公司;质 粒提取试剂盒及病毒DNA 提取试剂盒购自中鼎公 司;Western blot所用抗体购自美国Santa Cruz公 司。
1.2 方法 1.2.1 bFGF-siRNA表达框亚克隆至腺病毒穿梭 质粒pGStrack上用BglⅡ/EcoRⅠ两步法双酶切 pGenesil-1-bFGF-siRNA及腺病毒穿梭质粒。1.0% 琼脂糖凝胶电泳回收所需片段,回收的目的基因 和穿梭质粒片段在T4 DNA连接酶作用下16℃连接 过夜。取10 μl连接产物转化大肠杆菌DH5α感受 态细胞,涂布于含Kana抗性(终浓度为50 mg/L) 的LB(Luria-Bertani)平板上,37℃恒温箱培养 过夜。从每个培养皿上各挑取3个单克隆菌落接种 于5 ml含Kana抗性的LB培养液中,37℃恒温摇床 (250 r/min)培养过夜。最后,提取质粒并做酶 切鉴定,命名为pGStrack-bFGF-siRNA。
1.2.2 bFGF-siRNA表达框从pGStrack转至pGSadeno 腺病毒表达载体上pGStrack- bFGF-siRNA与腺 病毒骨架质粒pGSadeno在LR克隆酶Ⅱ作用下进行 LR体外重组反应,加入1 μl蛋白酶K,37℃反应 15 min,消化重组酶。将5 μl上步反应产物转化感 受态细胞DH5α,筛选在Amp抗性LB平板上生长的 菌落进行培养,提取质粒命名为pGSadeno-bFGFsiRNA 。最后用PI-SceⅠ/I-CeuⅠ双酶切进一步鉴 定正确的重组腺病毒质粒。
1.2.3 包装重组腺病毒用PacⅠ酶切重组腺病毒 质粒,酚∶氯仿∶异戊醇抽提,乙醇沉淀,获得 线性化腺病毒DNA。用Metafectene脂质体转染试 剂,按DNA∶lipid=1∶3的比例对达到50%~70% 融合度的HEK293细胞进行转染,转染后24 h将 培养液更换为10%胎牛血清的完全培养液。转染 3 d后,每天观察细胞病变效应(cytopathic effect, CPE),当细胞有明显的CPE现象且有>50%脱壁 时,即收集细胞进行裂解收集病毒。
1.2.4 扩增重组腺病毒以相同密度同时接种 HEK293细胞,细胞融合度约为60%~70%时,更换 培养液,改为10%FBS DMEM培养液10~15 ml,加 入20~30 μl以上1.2.3步骤所得重组腺病毒,24~48 h 后观察,60%左右细胞变圆,出现CPE现象,轻轻 吹打收集细胞悬液,800 r/min 离心5 min,弃上清 液,获得细胞沉淀,以无菌磷酸盐缓冲液2 ml重 悬细胞沉淀,液氮及37℃水浴反复冻融3次,4℃ 5 000 r/min 离心20 min,收集上清液。
1.2.5 重组腺病毒的PCR 鉴定将上步所扩增的 重组腺病毒200 μl,用病毒DNA提取试剂盒提取 DNA,进行PCR反应,引物序列pGSadeno-f: 5′-GTTTTGGCACCAAAATCA-3′;bFGF-r:5′-A TACTGCCCAGTTCGTTTTTTGTC-3′;反应体系 为:10×PCR Buffer 2.5 μl,rTaq 0.25 μl,dNTP(2.5 mmol/L)1 μl,pGSadeno-f(10 μmol/L)0.5 μl, bFGF-r(10 μmol/L)0.5 μl,LB培养液1 μl,加双 蒸水至25 μl;反应条件:95℃ 2 min;95℃ 15 s, 55℃ 15 s,72 ℃ 30 s,72 ℃ 3 min,32个周期。
1.2.6 重组腺病毒的滴度测定用微量全细胞病 变法检测病毒滴度,即HEK293细胞按104个/孔接 种于96孔板,每孔加液量200 μl,置培养箱培养 24 h。待测病毒用DMEM培养液稀释至1×10-2、1× 10-3、1×10-4、1×10-5、1×10-6、1×10-7等稀释度。吸 弃上清液后,分别加入每个稀释度的病毒液体,每 孔200 μl,每种样本均做复孔,同时设DMEM培养 液作对照(不含腺病毒)。再置于37℃、5%CO2条件 下继续培养36~48 h,镜检观察CPE现象,按公式计 算病毒滴度PFU/ml=接种细胞数×稀释度×10/加入 的病毒体积。
1.2.7 Western blot法检测bFGF蛋白的表达细胞 分为正常对照组、空载体组和实验组。正常对照组 为加PBS处理组;空载体组为加入含有绿色荧光蛋 白的腺病毒(Ad-GFP);实验组为加入重组腺病毒 rAd5-bFGF-siRNA转染组。转染72 h后,提取总蛋 白,BCA法进行蛋白浓度测定,蛋白上样量为40 g, 行SDS-PAGE电泳后转膜,将蛋白转移至PVDF 膜上,膜封闭液室温封闭1 h后,一抗4℃过夜, TBST洗膜后,二抗(1:5000)室温作用1h,TBST 再次洗膜后,ECL化学发光试剂盒显影。
2 结果 2.1 重组穿梭质粒pGStrack-bFGF-siRNA的鉴定穿梭质粒pGStrack-bFGF-siRNA经Bgl Ⅱ/EcoR Ⅰ双酶切,凝胶电泳可见克隆在约400 bp处有一特异性条带,与预期结果相同,见图 1。

|
| M: Marker;1: objective band 图 1 Bgl Ⅱ /EcoRⅠ双酶切pGStrack-bFGF-SiRNA电泳图 Figure 1 Electrophoretogram of Bgl Ⅱ/EcoRⅠdouble digested pGStrack-bFGF-SiRNA |
腺病毒重组骨架质粒pGSadeno-bFGF-siRNA经 PI-SceⅠ/I-CeuⅠ双酶切,凝胶电泳可见一条约2.9 kb 的小条带(目的克隆)和大于10 kb的大条带(为腺病 毒载体),与预期结果相同,见图 2。
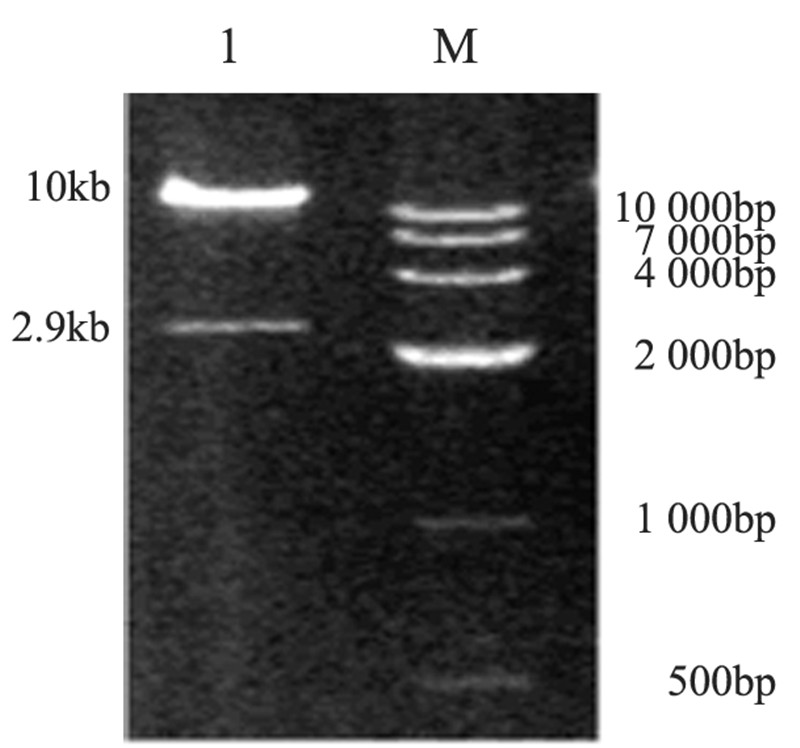
|
| M: Marker; 1: objective band 图 2 PI-SceⅠ/I-CeuⅠ双酶切pGSadeno-bFGF-SiRNA电泳图 Figure 2 Electrophoretogram of PI-SceⅠ/I-CeuⅠdouble digested pGSadeno-bFGF-SiRNA |
鉴定PCR产物在1.0%琼脂糖凝胶中电泳,可 见在约400 bp处有一特异性条带,见图 3,符合预 期,说明重组腺病毒rAd5-bFGF-siRNA包装成功。
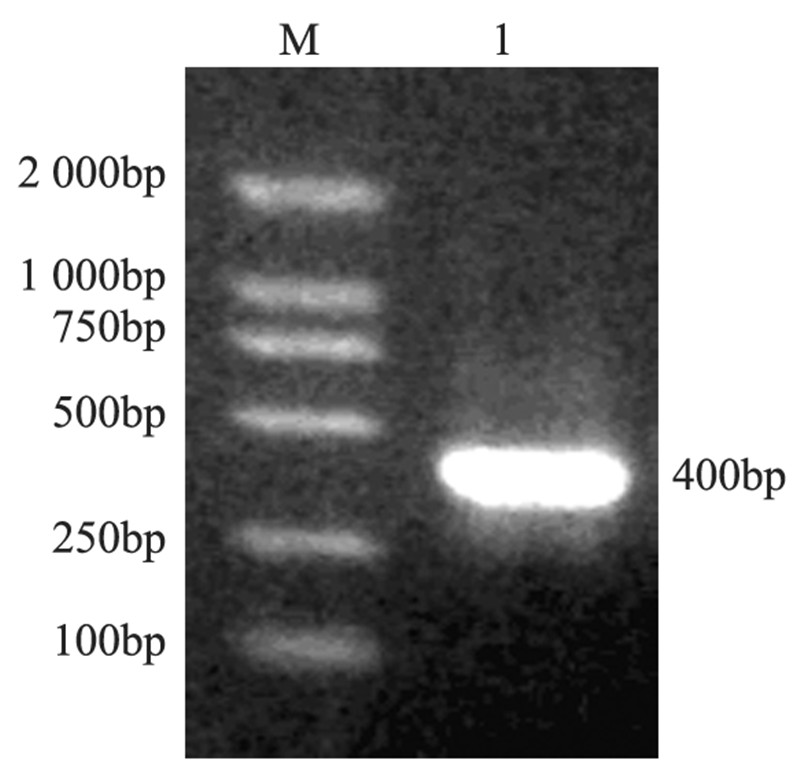
|
| M: Marker; 1: objective band 图 3 PCR鉴定重组腺病毒rAd5-bFGF-siRNA电泳图 Figure 3 Electrophoretogram of PCR identification of recombinant adenovirus rAd5-bFGF-siRNA |
按1×104个/孔293细胞接种腺病毒后36~48 h, 观察在10-2、10-3稀释度的样本中HEK293细胞出现 完全CPE现象:90%细胞变圆,10%细胞浮起,见 图 4。按上述公式计算,扩增所得腺病毒滴度约为 5×108 PFU/ml,能满足实验需要。

|
| A: normal HEK 293 cell morphology; B,C: HEK 293 cell morphology in rAd5-null-GFP and rAd5-bFGF-siRNA virus infection dope with 1×10-3 dilution under light microscopy,respectively 图 4 微量全细胞病变法测定重组腺病毒滴度 Figure 4 Recombinant adenovirus titer determined by tracing full cytopathic effect |
与正常对照组(PBS处理组)和空载体组(加入 Ad-GFP)相比,实验组胶质瘤U251细胞经转染 rAd5-bFGF-siRNA 72 h后,bFGF蛋白表达明显降 低,见图 5。
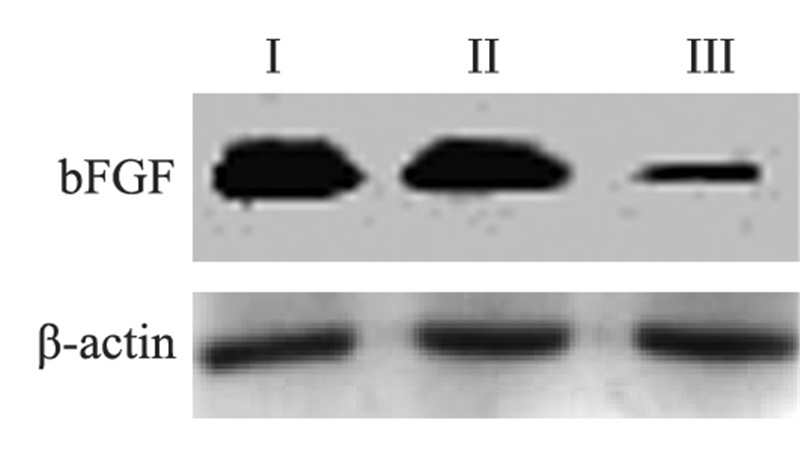
|
| I: normal control group(PBS); II: empty vector group(Ad-GFP); III: experimental group(rAd5-bFGF-siRNA) 图 5 Western blot检测bFGF蛋白的表达情况 Figure 5 bFGF protein expression detected by Western blot |
bFGF基因定位于人染色体4q26-27,其编码 的蛋白是含155个氨基酸的促有丝分裂多肽,分子量为16~18.5 kD。bFGF不但能够强烈刺激神经外 胚层和胶质细胞有丝分裂,而且作为一种与肿瘤 相关的生长因子,能够促进恶性肿瘤细胞增殖和 血管生成,与基底细胞癌、食管癌、肺癌、脑胶 质瘤等关系密切[5, 6, 7]。目前认为,bFGF通过与高亲 和力的跨膜酪氨酸激酶受体以及低亲和力FGFR受 体结合,激活多种信号转导通路,参与肿瘤的发 生发展,如Ras-Raf-MEK-MAPK、PI3K-AKT以及 JAK-STAT等[8]。因此,通过抑制bFGF的表达间接 打断多个与肿瘤生长密切相关的信号通路不失为 一种新的靶向治疗选择。应用氢醌磺酸盐抑制FGF 基因表达成功治疗恶性脑胶质瘤已有报道[9],本研 究小组前期成功应用bFGF小分子干扰RNA诱导了 恶性脑胶质瘤细胞系的凋亡[3, 4],本研究用腺病毒 载体将bFGF-siRNA重组构建出rAd5-bFGF-siRNA 为下一步的胶质瘤基因治疗提供理想的工具。
RNA干扰即双链RNA在Dicer酶作用下加工裂 解为21~23核苷酸长的小分子干扰RNA,siRNA 片段结合核酶复合物,形成RNA诱导沉默复合物 (RISC),激活的RISC通过碱基配对定位到同源 mRNA转录本上并将其剪切,从而破坏目的基因 转录产生的mRNA,沉默功能表型[10, 11]。与基因替 代,反义寡核苷酸等传统的基因疗法相比,RNA 干扰具有高效特异等优点,为基因治疗开辟了新 的途径。本实验构建的bFGF-siRNA质粒即将优 选的bFGF-siRNA序列克隆至含有U6启动子和Bgl Ⅱ/EcoRⅠ酶切位点的质粒,然后得到pGenesil-1- bFGF-siRNA质粒,用于下一步与腺病毒穿梭质粒 pGStrack重组。
由于腺病毒载体具有转移效率高、安全性 好、靶细胞范围广、高滴度制备等优点,因此腺 病毒载体已成为基因治疗研究的首选工具。传统 的细胞内同源重组法由于重组率低、工作量大、 周期长等缺陷限制了其在研究中的应用。细菌内 重组法制备腺病毒的关键环节是同源重组,由于 转化条件的限制,筛选出正确的重组腺病毒质粒 阳性率只有20%。为进一步提高效率,我们采用 LR体外重组方法,将两个质粒先体外LR重组, 然后经酶切线性化转染HEK293细胞来制备重组 腺病毒。LR反应即attL入门克隆和attR目的载体 之间的重组反应,以便在平行反应中将目的序列 转移至一个或多个目的载体。本实验采用复制缺 陷型腺病毒构建系统,即以Ad5血清型E1/E3缺陷 型腺病毒DNA为骨架,这样便使穿梭载体和病毒 骨架载体都有了相应的改进,然后用酶切消化和 连接的方法将目的基因克隆至入门载体,即腺病 毒穿梭质粒pGStrack,然后腺病毒重组穿梭质粒 pGStrack-bFGF-siRNA与腺病毒骨架质粒pGSadeno 进行LR体外位点特异性重组。重组腺病毒rAd5- bFGF-siRNA成功构建之后,我们采用微量全细胞 病变法进行病毒滴度测定,结果显示病毒滴度较 高,完全满足后续实验需要。在转染恶性脑胶质 瘤实验中发现,rAd5-bFGF-siRNA能够成功诱导肿 瘤细胞的凋亡,增加对化疗药物的敏感度[12],证明 了此重组载体治疗脑胶质瘤的有效性。综上,本 研究采用LR体外重组法成功构建出携带有bFGFsiRNA 重组腺病毒rAd5-bFGF-siRNA为胶质瘤基因 治疗提高了一个重要工具。
| [1] | Bajetto A, Porcile C, Pattarozzi A, et al. Differential role of EGF and BFGF in human GBM-TIC proliferation: relationship to EGFR-tyrosine kinase inhibitor sensibility[J]. J Biol Regul Homeost Agents, 2013, 27(1): 143-54. |
| [2] | Liu J, Xu X, Feng X, et al. Adenovirus-mediated delivery of bFGF small interfering RNA reduces STAT3 phosphorylation and induces the depolarization of mitochondria and apoptosis in glioma cells U251[J]. J Exp Clin Cancer Res, 2011, 30: 80. |
| [3] | Feng XQ, Wang JH, Xu XN, et al. Effects of bFGF small interfering RNA on apoptosis of glioma U251 cells[J]. Tianjin Yi Yao, 2009, 37(5): 337-9. [冯学泉, 王金环, 徐新女, 等. bFGF小 分子干扰RNA诱导胶质瘤U251细胞凋亡作用的研究[J]. 天津 医药, 2009, 37(5): 337-9.] |
| [4] | Wu JC, Feng XQ, Wang JH, et al. A preliminary study about the apoptostic mechanism of small interfering RNA targeting bFGF in glioma U251 cells[J]. Zhonghua Wai Ke Za Zhi, 2012, 50(10): 928-32. [吴静超, 冯学泉, 王金环, 等. 靶向碱性成纤维生长因 子的小分子干扰RNA诱导胶质瘤U251细胞凋亡机制的初步探 讨[J]. 中华外科杂志, 2012, 50(10): 928-32.] |
| [5] | Yang ZL, Cheng K, Han ZD. Effect of bFGF on the MCF-7 cell cycle with CD44(+)/CD24(-): promoting the G0/G1→G2/S transition[J]. J Breast Cancer, 2012, 15(4): 388-92. |
| [6] | Demirkesen C, Büyükpinarba?ili N, Ramazano?lu R, et al. The correlation of angiogenesis with metastasis in primary cutaneous melanoma: a comparative analysis of microvessel density, expression of vascular endothelial growth factor and basic fibroblastic growth factor[J]. Pathology, 2006, 38(2): 132-7. |
| [7] | Dobrzycka B, Mackowiak-Matejczyk B, Kinalski M, et al. Pretreatment serum levels of bFGF and VEGF and its clinical significance in endometrial carcinoma[J].Gynecol Oncol, 2013 , 128(3): 454-60. |
| [8] | Bottcher RT, Niehrs C. Fibroblast growth factor signaling during early vertebrate development[J]. Endocr Rev, 2005, 26(1): 63-77. |
| [9] | Cuevas P, Díaz-González D, Sánchez I. Dobesilate inhibits the activation of signal transducer and activator of transcription 3, and the expression of cyclin D1 and bcl-XL in glioma cells[J]. Neurol Res, 2006, 28(2): 127-30. |
| [10] | Knight SW, Bass BL. A role for the RNase Ⅲ enzyme DCR-1 in RNA interference and germ line development in Caenorhabditis elegans[J]. Science, 2001, 293(5538): 2269-71. |
| [11] | Jinek M, Doudna JA. A three-dimensional view of the molecular machinery of RNA interference[J]. Nature, 2009, 457(7228): 405-12. |
| [12] | Feng X, Zhang B, Wang J, et al. Adenovirus-mediated transfer of siRNA against basic fibroblast growth factor mRNA enhances the sensitivity of glioblastoma cells to chemotherapy[J]. Med Oncol, 2011, 28(1): 24-30. |
 2014, Vol. 41
2014, Vol. 41


