文章信息
- 张萌,彭利,乔治斌,何宏涛,周烨,徐卓. 2014.
- ZHANG Meng, PENG Li, QIAO Zhibin, HE Hongtao, ZHOU Ye, XU Zhuo. 2014.
- 罗格列酮诱导人肝癌HepG2细胞凋亡中p38MAPK通路的作用
- p38MAPK Signaling Pathway in Rosiglitazone-induced Apoptosis of Hepatocellular Carcinoma Cell Line HepG2
- 肿瘤防治研究, 2014, 41(11): 1181-1185
- Cancer Research on Prevention and Treatment, 2014, 41 (11): 1181-1185
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.11.023
-
文章历史
- 收稿日期:2013-08-15
- 修回日期:2013-11-25
研究发现,过氧化物酶体增殖物激活受体 γ(peroxisome proliferator-activated receptor-γ, PPAR-γ)的合成配体噻唑烷二酮类药物具有抑制肿 瘤细胞增殖、诱导肿瘤细胞凋亡的作用[1],此类 作用与多种细胞内信号通路有关,但具体机制尚 不清楚[2]。丝裂原活化蛋白激酶(mitogen-activatedprotein kinases,MAPKs)是细胞内的一类丝氨酸/苏 氨酸蛋白激酶,是将细胞外刺激信号传递到细胞 核,介导细胞产生反应的重要信号通路,在细胞 的增殖、分化及凋亡等进程中发挥关键性作用[3], 尤其是对肿瘤细胞的凋亡诱导作用更是目前研究 的热点。噻唑烷二酮类药物是否可以通过MAPKs 通路影响肝癌细胞的增殖及凋亡,目前尚未见报 道。本实验通过观察噻唑烷二酮类经典药物罗格 列酮对体外培养的人肝癌HepG2细胞增殖与凋亡 的影响,研究MAPKs通路相关蛋白的表达变化, 探讨其作用机制。
1 材料与方法 1.1 主要材料与试剂人肝癌细胞系HepG2由河北医科大学第四医 院科研中心提供。罗格列酮购自北京上草生物 科技有限公司,溶于二甲基亚砜(DMSO)后过滤 除菌,-20℃保存。β-actin和p-p53鼠抗人单克隆 抗体、Bcl-2和Bax兔抗人单克隆抗体均购自美国 Santa Cruz Biotechnology公司,兔抗人ERK1/2、 p-ERK1/2多克隆抗体及p38MAPK、p-p38MAPK 单克隆抗体均购自美国Ce l l Signa l ing公司。 p38MAPK通路抑制剂SB203580购自美国Sigma公 司。细胞蛋白提取试剂盒、Bradford法蛋白定量试 剂盒及DAB检测试剂盒购自上海索莱宝生物科技 有限公司。JEM-1200EXⅡ透射电子显微镜为日本 电子JEOL公司产品。
1.2 方法 1.2.1 细胞培养人肝癌HepG2细胞置于5%CO2、37℃恒温培养 箱中,培养液为含有10%胎牛血清、100 u/ml青霉 素、100 μg/ml链霉素的RPMI 1640。每2~3天传代 一次,取对数生长期的细胞进行实验。
1.2.2 MTT法检测细胞增殖将HepG2细胞按1×104个/孔接种于96孔板, 孵育24 h后加入以DMSO溶解的罗格列酮(终浓度 分别为0、1、10、100、200 μmol/L),每组设6个 复孔,设阴性对照(只加等量DMSO)及空白组(只 加培养液)。培养12、24、36 h后,每孔加入20 μl MTT,孵育4 h,弃上清液,加入100 μl DMSO, 振荡10 min至结晶充分溶解,于酶标仪490 nm波 长处测定吸光度 (A)值。细胞增殖抑制率=(对照 组A值-试验组A值)/(对照组A值-空白组A值)× 100%。实验重复 3 次。
1.2.3 流式细胞仪检测细胞凋亡取HepG2细胞(5×105个/培养瓶),经罗格列 酮(终浓度为0、1、10、100 μmol/L)、10 μmol/L SB203580及100 μmol/L罗格列酮+10 μmol/L SB203580分别作用24 h后收获细胞。经70%冰乙醇 固定12 h后离心弃固定液,PBS重悬5 min后500目 筛网过滤成单细胞悬液,加入DNA染色液4℃避光 30 min后上机检测。在二倍体细胞峰前出现一个亚 二倍体峰判定为凋亡细胞峰,以凋亡率表示凋亡 状态。实验重复3次。
1.2.4 透射电子显微镜观察细胞凋亡的超微结构取HepG2细胞(5×105个/培养瓶),经罗格列酮 作用24 h后收获细胞,PBS漂洗,1 200 r/min离心 10 min,细胞团经4%戊二醛前固定2 h,1%锇酸后 固定1 h,常规酒精梯度脱水,醋酸铀染色,树脂包 埋,超薄切片,经柠檬酸铅染色后封片,透射电子显 微镜观察照相。
1.2.5 Western blot检测蛋白表达变化按照方法1.2.3进行细胞培养和分组,收获细 胞,按照试剂盒说明提取细胞总蛋白并检测蛋白 浓度。 取50 μg样品进行聚丙烯酰胺凝胶电泳,电 转移至PVDF膜。5%脱脂奶粉37℃封闭2 h,分别 加入1:200稀释的β-actin和p-p53抗体、1:500稀释的 ERK1/2、p-ERK1/2、p38MAPK、p-p38MAPK抗 体、1:150稀释的Bcl-2和Bax抗体,4℃过夜;加入 相应二抗,37℃孵育2 h,DAB显色,β-actin为内 参照。将目标条带与β-actin条带的吸光度值之比作 为其蛋白表达水平的参数。实验重复3次。
1.3 统计学方法实验数据采用SPSS17.0统计软件进行分析。计 量资料以均数±标准差(x±s)表示,多组间均数比较 采用方差分析,其中两两比较用S-N-K检验。两组 均数比较用t检验,P<0.05为差异有统计学意义。
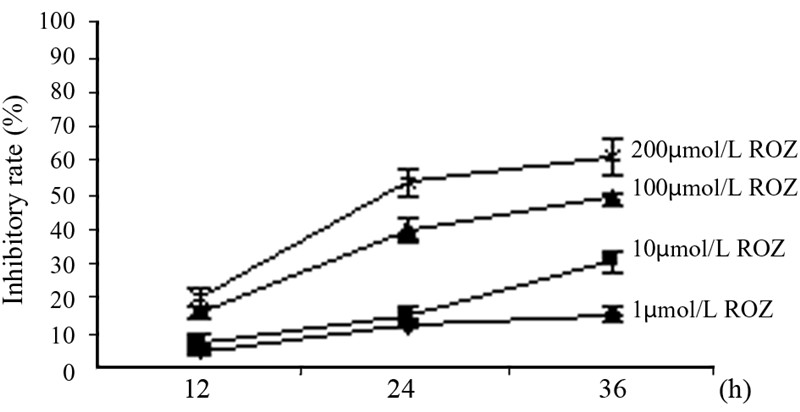
2 结果 2.1 罗格列酮对HepG2细胞增殖的抑制作用MTT 结果显示,罗格列酮能够明显抑制 HepG2细胞的增殖,且具有时间及浓度依赖性, 见图 1。1 μmol/L罗格列酮作用24 h后,HepG2细胞 的抑制率为(12.44±1.16)%,较12 h组有显著提高(P <0.05),而200 μmol/L罗格列酮作用24 h后抑制率 可达到(53.84±3.72)% 较200 μmol/L罗格列酮作用 12 h组及100 μmol/L罗格列酮作用24 h组均有显著 提高(P<0.05) ,见表 1。
|
| ROZ:rosiglitazone 图 1 罗格列酮对HepG2细胞的增殖抑制作用 Figure 1 Inhibitory effect of Rosiglitazone on proliferation of HepG2 cells detected by MTT |
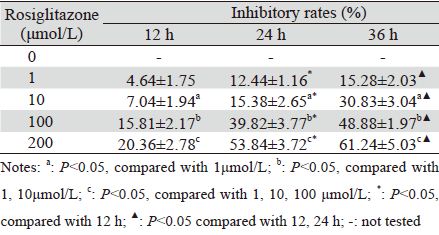 |
流式细胞术结果显示,罗格列酮可诱导HepG2细胞凋亡。1 μmol/L罗格列酮作用24 h后,HepG2 细胞凋亡率为(8.87±0.54)% (P<0.05),随着药物浓 度增加凋亡率逐渐升高。100 μmol/L罗格列酮作用 24 h后凋亡率为(23.62±1.41)%,联合应用10μmol/L SB203580后凋亡率降至(12.15±0.72)%两者差异 具有统计学意义(P<0.05)。SB203580单独作用对 HepG2细胞的凋亡无明显影响(P<0.05),见表 2。
 |
罗格列酮作用后,电子显微镜下可见典型的 HepG2细胞凋亡表现: 细胞体积缩小,常染色质增 加,核质比例减少。部分细胞染色质凝集、固缩、 边缘化,聚集于核膜下呈境界分明的团块状、花 瓣状或新月体形,线粒体肿胀甚至空泡化,有的 可见核碎裂及凋亡小体形成,见图 2。

|
| A:×4000; B:×12000 图 2 电子显微镜观察罗格列酮诱导的HepG2细胞凋亡 Figure 2 Rosiglitazone-induced apoptosis of HepG cells observed by transmission electron microscope |
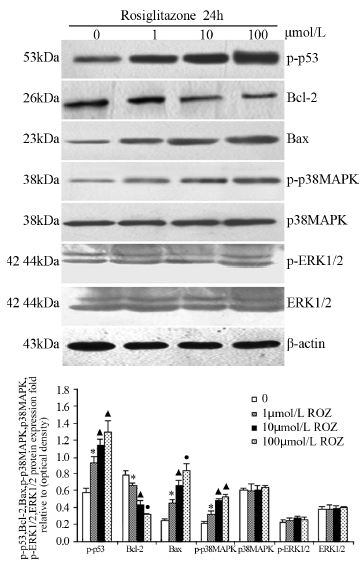
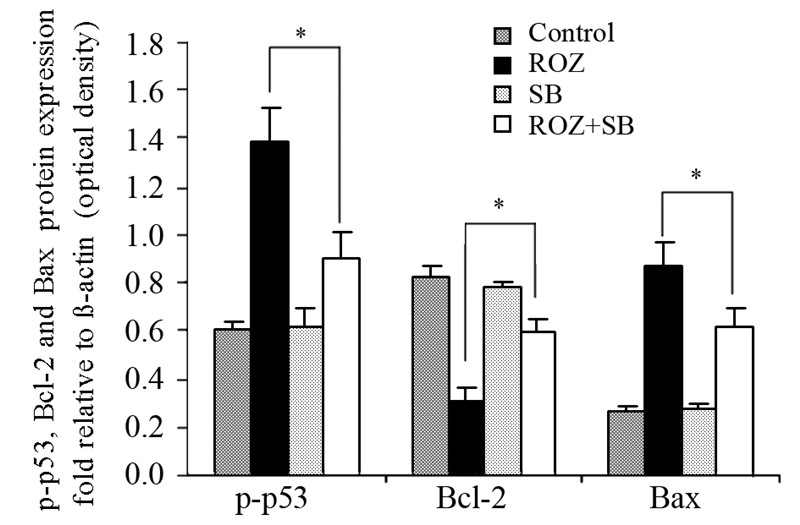
Western blot结果显示:随着罗格列酮浓度的 增加,HepG2细胞中p-p38MAPK蛋白的表达水平 显著升高,但p38MAPK、ERK1/2和p-ERK1/2蛋白 均无明显变化;同时p-p53和Bax蛋白表达水平显 著升高,而Bcl-2蛋白表达水平显著降低,见图 3。 SB203580单独作用对HepG2细胞中p-p53、Bcl-2和 Bax蛋白的表达无明显影响,但与罗格列酮联用后 可明显削弱罗格列酮引发的p-p53、Bcl-2和Bax蛋 白表达变化(P<0.05) ,见图 4。
|
| *:P<0.05,compared with 0 μmol/L ROZ; ▲: P<0.05,compared with 0, 1 μmol/L ROZ; ●: P<0.05,compared with 0,1,10μmol/L ROZ 图 3 罗格列酮对HepG2细胞ERK1/2、p-ERK1/2、 p38MAPK、p-p38MAPK、p-p53、Bcl-2和Bax蛋白表达的 影响 Figure 3 Effect of Rosiglitazone on the expression of ERK1/2,p-ERK1/2,p38MAPK,p-p38MAPK,p-p53,Bcl-2 and Bax protein in HepG2 cells at various concentrations for 24h |
|
| *: P<0.05; SB: SB203580 图 4 罗格列酮联合SB203580对HepG2细胞p-p53、Bcl-2和 Bax蛋白表达的影响 Figure 4 Effect of Rosiglitazone(100μmol/L) combined with SB203580(10μmol/L) on expression of p-p53,Bcl-2 and Bax protein in HepG2 cells for 24h |
罗格列酮是噻唑烷二酮类药物的典型代表, 临床上广泛使用于治疗Ⅱ型糖尿病。近期研究表 明,罗格列酮具有一定的抑癌作用。Shen等[4]在 体内外实验中均发现罗格列酮可抑制人肝癌MHCC97L 、BEL-7404细胞的侵袭和转移;我们之前的 研究也发现罗格列酮可通过调控PTEN及VEGF蛋 白的表达抑制人肝癌SMMC-7721细胞的增殖[5]。 我们通过流式细胞检测及电镜形态学观察证实, 罗格列酮可显著抑制HepG2细胞的增殖并诱导其 凋亡。
目前发现MAPKs家族中存在着多条并行的信 号通路,不同的细胞外刺激可激活不同的MAPKs 通路,其中p38丝裂原活化蛋白激酶(p38 mitogen activated protein kinase,p38MAPK)通路与细胞外信 号调节激酶1/2(extra cellular signal-regulated protein kinase,ERK1/2)通路是研究的重点[6]。MAPKs各通路的具体功能仍有差异,ERK1/2通路主要传递细 胞丝裂原信号,参与调节细胞周期及促进细胞增 殖分化,p38MAPK通路则在炎症与细胞凋亡等应 激反应中发挥重要作用[7]。Fujita等[8]研究发现,曲 格列酮(噻唑烷二酮类药物)可通过激活p38MAPK 通路在体外诱导肾癌细胞的凋亡。Liu等[9]的实验 显示,高浓度环格列酮可诱导白血病HL-60细胞 的凋亡,并认为这与p38MAPK通路及caspase-3 的激活有关。本实验发现,经罗格列酮作用后, HepG2细胞p-p38MAPK蛋白的表达水平显著提 高,而p38MAPK蛋白、ERK1/2及p-ERK1/2蛋白 未见明显变化;且p38MAPK通路特异性抑制剂 SB203580可显著降低罗格列酮诱导的HepG2细胞 的凋亡率,说明罗格列酮是通过激活p38MAPK通 路而非ERK1/2通路诱导HepG2细胞凋亡的。
p38MAPK通路对肿瘤细胞的凋亡诱导作用主 要是通过调控下游凋亡基因的表达实现的。p53基 因是重要的抑癌基因,其活性调节主要发生在转 录后水平,即p53蛋白的磷酸化激活,磷酸化p53 蛋白通过调控细胞周期及诱导细胞凋亡发挥抑癌 作用[10]。Bcl-2蛋白家族在诱导凋亡的线粒体信号 途径中起着重要的作用,抗凋亡的Bcl-2和促凋亡 的Bax是其重要成员。Bax/Bcl-2的比值与肿瘤细 胞的凋亡有密切关系,在凋亡进程中主要表现为 Bcl-2表达减少而Bax表达增多[11]。本实验发现, 罗格列酮在诱导凋亡的过程中,可上调HepG2细 胞内p-p53及Bax蛋白的表达,下调Bcl-2蛋白的 表达;而抑制p38MAPK通路后,罗格列酮对上 述蛋白的调控作用明显减弱,因此,我们推测罗 格列酮是通过激活p38MAPK通路,活化p53,并 使Bcl-2家族抗/促凋亡信号发生变化,最终实现 激活HepG2细胞的凋亡进程。同时本实验也证实 p38MAPK通路参与了对p53、Bcl-2和Bax蛋白的调 控。有研究表明,辛伐他汀可通过p38MAPK-p53 途径诱导大肠癌HCT116细胞的凋亡[12];Lee等[13] 通过研究链球菌致热外毒素B(SPE B)诱导的凋 亡发现,p38MAPK通路位于p53的上游,激活 p38MAPK-p53途径可上调Bax蛋白表达。也有研究 发现,p38MAPK通路对Bcl-2家族的调控无需通过 P53的介导。Yang等[14]发现,在栀子素经线粒体途 径诱导人非小细胞肺癌H1299细胞凋亡的过程中, 激活的p38MAPK通路可直接改变Bax/Bcl-2的比例;而Dong等[15]认为p38MAPK通路是经由NF-κB 实现对Bcl-2家族调控的。
综上所述,罗格列酮可通过激活p38MAPK通 路抑制人肝癌HepG2细胞的增殖并诱导其凋亡, 其机制可能与p38MAPK通路参与p-p53、Bax及 Bcl-2蛋白的调控有关。但p38MAPK通路抑制剂并 未完全逆转罗格列酮的凋亡诱导效应,提示我们 可能有其他信号通路参与其中。Wang等[16]发现罗 格列酮可通过阻断TGF-beta通路抑制人神经胶质 瘤细胞的增殖,并认为P21和c-Myc基因也参与了 此过程;Liu等[17]则发现罗格列酮可经由Wnt/GSK- 3β/β-catenin信号通路抑制人淋巴瘤细胞的增殖并 诱导其凋亡,因此有关罗格列酮抗肿瘤作用的分 子通路及其交互作用仍需进行深入的研究。
| [1] | Robbins GT, Nie D. PPAR gamma, bioactive lipids, and cancer progression[J]. Front Biosci(Landmark Ed), 2012, 17: 1816-34. |
| [2] | Reka AK, Goswami MT, Krishnapuram R, et al. Molecular cross-regulation between PPAR-γ and other signaling pathways: implications for lung cancer therapy[J]. Lung Cancer, 2011, 72(2): 154-9. |
| [3] | Klein AM, Zaganjor E, Cobb MH. Chromatin-tethered MAPKs[J]. Curr Opin Cell Biol, 2013, 25(2): 272-7. |
| [4] | Shen B, Chu ES, Zhao G, et al.PPARgamma inhibits hepatocellular carcinoma metastases in vitro and in mice[J]. Br J Cancer, 2012, 106(9):1486-94. |
| [5] | Zhang M, Peng L, Miao ZJ, et al.Effect of rosiglitzone on expression of VEGF in liver cancer cell line SMMC-7721[J]. Zhong Liu Fang Zhi Yan Jiu,2010,37(3):298-301.[张萌, 彭利, 苗 战军, 等.罗格列酮对肝癌SMMC-7721细胞VEGF蛋白表达的 影响[J]. 肿瘤防治研究, 2010, 37(3): 298-301.] |
| [6] | Keshet Y, Seger R. The MAP kinase signaling cascades: a system of hundreds of components regulates a diverse array of physiological functions[J]. Methods Mol Biol, 2010, 661: 3-38. |
| [7] | del Barco Barrantes I, Nebreda AR. Roles of p38 MAPKs in invasion and metastasis[J]. Biochem Soc Trans, 2012,40(1):79-84. |
| [8] | Fujita M, Yagami T, Fujio M,et al. Cytotoxicity of troglitazone through PPARγ-independent pathway and p38 MAPK pathway in renal cell carcinoma[J]. Cancer Lett, 2011, 312(2): 219-27. |
| [9] | Liu JJ, Liu WD, Liu XD, et al. Pro-apoptotic effect of ciglitazone in leukemic HL-60 cells via PPARγ and P38 MAPK signaling pathway[J]. Zhonghua Yi Xue Za Zhi, 2010, 90(32):2270-4.[刘 加军, 刘文达, 刘晓丹, 等. 环格列酮通过PPARγ及P38 MAPK 信号途径诱导白血病HL-60细胞凋亡[J]. 肿瘤医学杂志, 2010, 90(32):2270-4.] |
| [10] | Taira N, Yoshida K. Post-translational modifications of p53 tumor suppressor: determinants of its functional targets[J]. Histol Histopathol, 2012,27(4):437-43. |
| [11] | Croker BA,O’Donnell JA, Nowell CJ, et al. Fas-mediated neutrophil apoptosis is accelerated by Bid, Bak, and Bax and inhibited by Bcl-2 and Mcl-1[J]. Proc Natl Acad Sci U S A, 2011, 108(32): 13135-40. |
| [12] | Chang HL, Chen CY, Hsu YF, et al. Simvastatin induced HCT116 colorectal cancer cell apoptosis through p38MAPKp53- survivin signaling cascade[J]. Biochim Biophys Acta, 2013, 1830(8):4053-64. |
| [13] | Lee WT, Chang CW. Bax is upregulated by p53 signal pathway in the SPE B-induced apoptosis[J].Mol Cell Biochem, 2010, 343(1-2): 271-9. |
| [14] | Yang X, Yao J, Luo Y, et al. P38 MAP kinase mediates apoptosis after genipin treatment in non-small-cell lung cancer H1299 cells via a mitochondrial apoptotic cascade[J]. J Pharmacol Sci, 2013, 121(4):272-81. |
| [15] | Dong X, Li JC, Jiang YY, et al. p38-NF-κB-promoted mitochondria-associated apoptosis and G2/M cell cycle arrest in norcantharidin-treated HeLa cells[J]. J Asian Nat Prod Res, 2012, 14(11): 1008-19. |
| [16] | Wang P, Yu J, Yin Q, et al. Rosiglitazone suppresses glioma cell growth and cell cycle by blocking the transforming growth factor-beta mediated pathway[J]. Neurochem Res, 2012, 37(10): 2076-84. |
| [17] | Liu JJ, Dai XJ, Xu Y, et al. Inhibition of lymphoma cell proliferation by peroxisomal proliferator-activated receptor-γ ligands via Wnt signaling pathway[J]. Cell Biochem Biophys, 2012, 62(1):19-27. |
 2014, Vol. 41
2014, Vol. 41


