文章信息
- 王晶晶,胡春宏,李代强,佘晓玲,马进安. 2014.
- 原发于肾上腺的结节性淋巴细胞为主型霍奇金淋巴瘤合并肾上腺髓质增生1例报道
- 肿瘤防治研究, 2014, 41(10): 1148-1151
- Cancer Research on Prevention and Treatment, 2014, 41 (10): 1148-1151
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.10.020
-
文章历史
- 收稿日期:2013-11-13
- 修回日期:2014-05-12
原发于肾上腺的结节性淋巴细胞为主型霍奇 金淋巴瘤(nodular lymphocyte-predominant Hodgkin lymphoma,NLPHL)少见。肾上腺髓质增生也是一 种少见疾病。肾上腺合并存在结节性淋巴细胞为 主型霍奇金淋巴瘤和肾上腺髓质增生两种病理状 态的病例也少见报道。现将湖南省中南大学湘雅 二医院收治的1例患者临床资料报告如下。
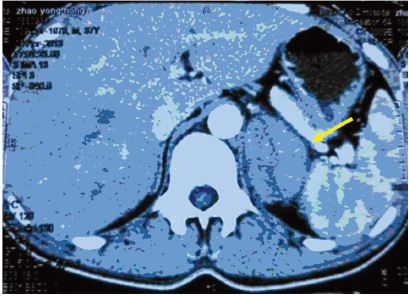
1 临床资料患者,男,36岁,因反复高热伴消瘦10天, 体检发现左肾上腺占位1月,第一次入住我院。既 往身体健康,无高血压病史。体格检查:血压: 120/80 mmHg,心肺腹部均未见明显异常。胸腹部 CT示:左侧肾上腺见软组织肿块,大小约4.5 cm× 5.5 cm,密度欠均匀,边界尚清,增强扫描病灶明 显强化,其内见不强化的低密度区,见图 1。右侧 肾上腺未见明显异常,腹膜后未见明显肿大淋巴 结。肺部CT未见明显异常。骨髓涂片及骨髓活检 未见异常。血清LDH、B-微球蛋白均正常。肾上 腺皮质及髓质功能均正常。血常规及生化、血糖 均正常。无手术禁忌,遂在全麻下行腹腔镜左肾 上腺肿块切除术。
|
| a soft tissue mass in the left adrenal gland,measuring 4.5cm × 5.5cm,less uniform density,clear border 图 1 原发于肾上腺的结节性淋巴细胞为主型霍奇金淋巴瘤合并肾上腺髓质增生患者腹部CT Figure 1 Abdominal CT of patient with primary adrenal nodular lymphocyte-predominant Hodgkin lymphoma(NLPHL) combined with adrenal medulla hyperplasia |
术后病理示:左侧肾上腺肿块,5.5 cm×4 cm ×4 cm大小,镜下肾上腺组织中有淋巴-造血组 织肿瘤,部分破坏肾上腺向腹膜后形成结节性肿 块。镜下可见大小混合分布的淋巴细胞,其中可 见非典型性“爆米花样”细胞,细胞较大,胞质少 到中等,淡染,胞核呈多叶、泡状,核仁小而清 晰,少数细胞有较大核仁。有病理性核分裂,部 分形成结节状,间质纤维增生。结合免疫组织化 学,考虑结节性淋巴细胞为主型霍奇金淋巴瘤。 另有部分区域肾上腺髓质细胞增生,细胞胞质透 明丰富。肿瘤区域免疫组织化学:CD30(-), CD15( 个别+) ,CD20(大细胞+),EBER (-),PAX-5(大细胞+),OCT-2(大细胞 +),Ki-67(大细胞60%+),CD79a(+), bcl-2(部分细胞+),Mum-1(+),CD45Ro (部分+),EMA小灶(+),CD3(+),大 细胞-),CD57(+),LcA(+),bcl-6(-), CD10(+/-),CK(-),CD23(-),ALK(-), CD21(-),CD68(+),MPO(-)。肾上腺 髓质细胞增生区域:CgA(+),S-100(+), LcA(-),Syn(+),Vimentim(+/-), 见图 2~3。诊断为:(1)肾上腺霍奇金淋巴瘤结 节性淋巴细胞为主型ⅠB期;(2)肾上腺髓质增 生。术后患者恢复可,复查全身PET-CT未见明显 异常。予以4周期ABVD(阿霉素+博来霉素+环磷 酰胺+氮烯咪胺)方案辅助化疗。从患者确诊到2013年11月,已随访16月,患者病情稳定,未见 复发。

|
| A: HE(×200)little picture (×400); B: CD3 positive T cell rosettes surrounding LP cells(×200); C: EMA positive(×200); D: CD20 positive in LP cells (×100); E: individual CD15 positive (×100); F: CD30 negative (×100); HE: hematoxylin and eosin; CD: cluster of differentiation; LP cells: lymphocytepredominant cells; EMA: epithelial membrane antigen 图 2 NLPHL合并肾上腺髓质增生患者病理组织的肾上腺结节性淋巴细胞为主型霍奇金淋巴瘤区域的组织学和免疫组织化学结果 Figure 2 Histological and immunohistochemical results of adrenal NLPHL area in the pathological tissue of patient with primary adrenal NLPHL combined with adrenal medulla hyperplasia |

|
| A: CgA positive (×200); B: Syn positive (×200); C: Vimentim(+/-) (×200); D: HE(×200); CgA: chromogranin A; Syn: synaptophysin 图 3 NHPHL合并肾上腺髓质增生患者病理组织的肾上腺髓质增生区域的组织学和免疫组织化学结果 Figure 3 Histological and immunohistochemical results of adrenal medulla hyperplasia area in the pathological tissue of patient with primary adrenal NLPHL combined with adrenal medulla hyperplasia |
最新WHO分类将霍奇金淋巴瘤分为结节性 淋巴细胞为主型和经典型霍奇金淋巴瘤(classical HL)[1]。CHL约占HL的95%,NLPHL较少见,约占 HL的4%~5%,好发于年轻男性,常常累及外周淋 巴结。大部分患者诊断时处于Ⅰ或Ⅱ期,B症状少 见,大部分预后良好。原发于肾上腺的霍奇金淋 巴瘤非常少见,国外曾公开报道2例,均为经典型 霍奇金淋巴瘤[2, 3]。1例通过尸检确诊[2],65岁美国 男性患者因肾衰竭死亡,死后尸检发现左肾上腺 存在碰撞瘤,为髓质脂肪瘤和经典型霍奇金淋巴 瘤两种病变混合在一起;另1例为意外发现[3],于 2009年报道的76岁美国女性患者,因背痛行胸腹部CT,意外发现右肾上腺约5 cm肿块,接着予以 腹腔镜右肾上腺切除术,术后病检确定为经典型 霍奇金淋巴瘤。
B型超声、CT、MRI等影像学检查成为发现肾 上腺肿瘤的首要选择,但这些检查无法作出定性 诊断。PET-CT不仅能区分肾上腺肿瘤的良恶性, 还对于霍奇金淋巴瘤的分期、疗效评估及预后预 测均有重要的价值,已成为霍奇金淋巴瘤的优化 治疗的一部分[4, 5]。
NLPHL在组织学上呈结节性或结节-弥漫性 生长方式,肿瘤细胞被称为L&H细胞、LP细胞或 者“爆米花样”细胞,分布在小B淋巴细胞和一些 CD57+T细胞组成的结节性背景之下。检测免疫表 型是确诊NLPHL的主要手段。LP细胞不表达CD15 和CD30,可与经典型HL相区分。但B 细胞相关抗 原(CD19,CD20,CD22 和CD79a)和上皮膜抗原 (EMA)为阳性。背景中CD3 或CD57阳性小T淋 巴细胞围绕肿瘤细胞呈花环样结构[6-7]。NLPHL与 EB病毒感染没有明显联系,故EBER通常为阴性。 PCR分析示克隆性B细胞IgH重链基因重排(+)及 TCRr基因重排(-)[8]。通过免疫标志物的表达及 基因重排分析,NLPHL被认为是来源于B淋巴细 胞的肿瘤。
对本病例的肾上腺肿块进行病理分析,发现 了两种不同的病理状态。大部分区域表现为淋 巴-造血肿瘤,这部分行免疫组织化学检测符合 NLPHL。而在另外的区域上发现肾上腺髓质细 胞增生,结合免疫组织化学诊断为肾上腺髓质增 生。近30年来学者逐渐认为肾上腺髓质增生是一 个自主性儿茶酚胺分泌过多的独立疾病[9]。临床表 现主要是高血压,但需与嗜络细胞瘤相鉴别。病 理学检查为确诊的主要手段。因发病率较低,深 入研究受到限制。肾上腺髓质增生的最佳治疗是 手术切除。
NLPHL的手术治疗的主要目的是为了获得病 理诊断。对于早期局限的NLPHL患者只需接受单 纯放疗,就能获得良好预后[10, 11]。推荐的放疗剂量 为30~36 Gy。随着研究的深入,加拿大学者提出 两周期ABVD化疗联合放疗的治疗方案较单纯放疗 更能够改善预后[12]。为了进一步验证上述理论, 2011年该学者再次对88例局限期NLPHL患者进行 回顾性研究,结果仍然是化放疗联合组的预后优 于单纯放疗组[13]。由于局限期NLPHL的预后良 好,研究显示患者的10年OS大于90%,甚至达到 100%[14, 15]。获得长期生存的同时也需要考虑积极 治疗带来的晚期不良反应及治疗相关性死亡。最 近的研究发现单纯ABVD化疗与放化疗联合治疗比 较,能够获得更长的OS,是由于联合治疗会导致 死亡率升高[16]。也有学者认为对于早期NLPHL可 选择等待及观察的治疗方案[15, 17, 18]。局限期NLPHL 的最佳治疗策略的确定仍需更多的临床资料及长 期随访。对于进展期的NLPHL患者的治疗以化疗 为主,放疗为辅[14]。
由于NLPHL的肿瘤细胞表达CD20,故使用 CD20抗体治疗NLPHL成为研究的方向。Stanford 大学的一项Ⅱ期临床研究显示对于复发的NLPHL 患者使用利妥昔单抗治疗能获得100%的治疗反应 率 [19]。该研究为利妥昔单抗治疗NLPHL带来了希 望。另一项Ⅱ期研究也显示利妥昔单抗治疗复发 的NLPHL患者效果非常显著[20]。德国的霍奇金淋 巴瘤研究组研究发现ⅠA期NLPHL患者也可以通 过利妥昔单抗治疗获得较好的预后[21, 22]。2012年 NCCN指南已经推荐在NLPHL的治疗中使用利妥 昔单抗。
由于原发于肾上腺的NLPHL的病例数极少, 目前仍无标准治疗,只能参考其他部位NLPHL的 治疗方案。由于肾上腺部位特殊,与肾脏毗邻, 肾脏对放疗耐受量低,对该部位进行放疗,容易 影响肾功能,导致肾衰竭,且放疗对于肾上腺淋 巴瘤的有效性尚不清楚[23]。本例患者为局限期的 NLPHL同时合并肾上腺髓质增生,考虑已行手 术完全切除病灶,为减少治疗相关的晚期不良反 应,故采用ABVD方案单纯化疗结合密切监测。
据我们所知,这是第一例报道的原发于肾上 腺的结节性淋巴细胞为主型霍奇金淋巴瘤合并髓 质增生。由于原发部位较特殊,需根据具体情况 进行个体化治疗,并且在肾上腺肿瘤的鉴别诊断 中应考虑到此病的可能。
| [1] | Harris NL, Jaffe ES, Diebold J, et al. World Health Organization classification of neoplastic diseases of hematopoetic and lymphoid tissues: report of the Clinical Advisory Committee meeting-Airlie House, Virginia, November 1997[J]. J Clin Oncol, 1999, 17(12): 3835-49. |
| [2] | Hagspiel KD. Manifestation of Hodgkin’s lymphoma in an adrenal myelolipoma[J]. Eur Radiol, 2005, 15(8): 1757-9. |
| [3] | Bourne AE, Bell SW, Wayment RO, et al. Primary Hodgkin lymphoma of the adrenal gland: a unique case presentation[J]. Can J Urol, 2009, 16(3): 4694-6. |
| [4] | Li YY, Ke XY. Positron emission tomography in the management of Hodgkin lymphoma[J]. Bai Xue Bing·Lin Ba Liu, 2012, 21(1):16-8. [李艳莹, 克晓燕. PET-CT在霍奇金淋巴瘤治疗中的作用[J].白血病·淋巴瘤, 2012, 21 (1): 16-8.] |
| [5] | Engert A, Haverkamp H, Kobe C, et al. Reduced-intensity chemotherapy and PET-guided radiotherapy in patients with advanced stage Hodgkin's lymphoma (HD15 trial): a randomised, open-label, phase 3 non-inferiority trial[J]. Lancet, 2012, 379(9828):1791-9. |
| [6] | Anagnostopoulos I, Hansmann ML, Franssila K, et al. European Task Force on lymphoma project on lymphocyte predominance Hodgkin disease: histologic and immunohistologic analysis of submitted cases reveals 2 types of Hodgkin disease with a nodular growth pattern and abundant lymphocytes[J]. Blood, 2000, 96(5): 1889-99. |
| [7] | Liu YH, Zhuang HG, Lin HL, et al. Histology, immunophenotype and di agnos t i c s of nodul a r- lymphocyt e -pr edominant Hodgkin lymphoma[J]. Zhonghua Xue Ye Xue Za Zhi, 2005, 26(11):699-701.[刘艳辉, 庄恒国, 林汉良, 等. 结节性淋巴细胞 为主型霍奇金淋巴瘤组织学、免疫表型和诊断[J]. 中华血液学 杂志, 2005, 26(11): 699-701.] |
| [8] | Harris NL. Hodgkin’s disease: classification and differential diagnosis[J]. Mod Pathol, 1999, 12(2): 159-75. |
| [9] | Chieh-ping W. Adrenal medullary hyperplasia[J]. Chin Med J (Engl), 1978(11): 4(1):17-22. |
| [10] | Wirth A, Yuen K, Barton M, et al. Long-term outcome after radiotherapy alone for lymphocyte-predominant Hodgkin lymphoma: a retrospective multicenter study of the Australian. Radiation Oncology Lymphoma Group[J]. Cancer, 2005, 104(6):1221-9. |
| [11] | Nogová L, Reineke T, Eich HT. Extended field radiotherapy, combined modality treatment or involved field radiotherapy for patients with stage IA lymphocyte-predominant Hodgkin’s lymphoma: a retrospective analysis from German Hodgkin Study Group (GHSG) [J]. Ann Oncol, 2005, 16(10): 1683-7. |
| [12] | Savage KJ, Hoskins P, Klasa R, et al. ABVD chemotherapy is essential for optimal treatment of limited stage nodular lymphocyte predominant Hodgkin lymphoma. 7th International Symposium on Hodgkin Lymphoma, Cologne, Germany[J]. Haematologica ,2007, 92: supplement 5: 27(C012). |
| [13] | Savage KJ, Skinnider B, Al-Mansour M, et al. Treating limitedstage nodular lymphocyte predominant Hodgkin lymphoma similarly to classical Hodgkin lymphoma with ABVD may improve outcome[J]. Blood, 2011, 118(17): 4585-90. |
| [14] | Nogová L, Rudiger T, Engert A. Biology, clinical course and management of nodular lymphocyte-predominant Hodgkin. lymphoma[J]. Hematology Am Soc Hematol Educ Program, 2006: 266-72. |
| [15] | Illés A, Simon Z, Tóth E, et al. Nodular lymphocyte predominant Hodgkin lymphoma (NLPHL)-clinicopathological features based on the data of two Hungarian lymphoma centres[J]. Pathol Oncol Res, 2008, 14(4): 411-21. |
| [16] | Meyer RM, Gospodarowicz MK, Connors JM, et al. ABVD alone versus radiation-based therapy in limited-stage Hodgkin’s lymphoma[J]. N Engl J Med, 2012, 366(5): 399-408. |
| [17] | Pellegrino B, Terrier-Lacombe MJ, Oberlin O, et al. Lymphocytepredominant Hodgkin’s lymphoma in children: therapeutic abstention after initial lymph node resection--a study of the French Society of Pediatric Oncology[J]. J Clin Oncol, 2003, 21(15): 2948-52. |
| [18] | Mauz-K?rholz C, Gorde-Grosjean S, Hasenclever D, et al. Resection alone in 58 children with limited stage, lymphocytepredominant Hodgkin lymphoma-experience from the European network group on pediatric Hodgkin lymphoma[J] .Cancer, 2007, 110(1): 179-85. |
| [19] | Ekstrand BC, Lucas JB, Horwitz SM, et al. Rituximab in lymphocyte-predominant Hodgkin disease: results of a phase 2 trial[J]. Blood, 2003, 101(11): 4285-9 |
| [20] | Schulz H, Rehwald U, Morschhauser F et al. Rituximab in relapsed lymphocyte-predominant Hodgkin lymphoma: longterm results of a phase 2 trial by the German Hodgkin Lymphoma Study Group (GHSG) [J]. Blood, 2008, 111(1): 109-11. |
| [21] | Eichenauer DA, Engert A, Dreyling M, et al. Hodgkin’s lymphoma: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol 2011, 22 Suppl 6, vi55–8. |
| [22] | Eichenauer DA, Fuchs M, Pluetschow A, et al. Phase 2 study of rituximab in newly diagnosed stage IA nodular lymphocytepredominant Hodgkin lymphoma: a report from the German Hodgkin Study Group[J]. Blood, 2011b, 118(16): 4363-5. |
 2014, Vol. 41
2014, Vol. 41