文章信息
- 罗贤琴,唐华容,熊二梦,王洁,金洁,邵根宝,龚爱华,吴朝阳. 2014.
- LUO Xianqin, TANG Huarong, XIONG Ermeng, WANG Jie, JING Jie, SHAO. 2014.
- 干扰Hmgb3表达对肺腺癌A549细胞增殖的影响
- Effect of Interfered Hmgb3 Expression on Proliferation of Lung Carcinoma Cells A549
- 肿瘤防治研究, 2014, 41(10): 1059-1063
- Cancer Research on Prevention and Treatment, 2014, 41 (09): 1059-1063
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.10.001
-
文章历史
- 收稿日期:2013-09-09
- 修回日期:2014-01-17
2. 江苏大学基础医学与医学技术学院
2.School of Basic Medicine and Laboratory Medicine, Jiangsu University
Hmgb3是高迁移率族蛋白(high-mobility group box,Hmgb)成员之一,又称HMG2a、 HMG4,在进化中高度保守,于脊椎动物的胚胎 中高表达,大多数成体组织中不表达[1]。研究显示 Hmgb3是维持小鼠白血病干细胞自我更新能力所 必需的基因[2]。在实体瘤组织中,有报道[3]Hmgb3 可作为检测外周血中肺癌细胞的标志物,并且在 评价肺癌的治疗和肺癌复发中具有重要的意义。 近期有研究表明在非小细胞肺癌患者中,Hmgb3 在mRNA及蛋白水平上癌组织明显高于癌旁组 织,而且其表达量与肿瘤分级、大小、临床分期 及淋巴结转移有关,是评估非小细胞肺癌预后的 独立因子[4]。我们前期实验结果(待发表)显示 Hmgb3在肺腺癌的癌组织中高表达,提示Hmgb3 与肺癌肿瘤的发生与发展相关,但有关Hmgb3基 因的功能研究报道十分少见。
RNAi技术可通过shRNA在细胞中像在动物模 型中一样产生有效的、稳定的和可调节的基因沉 默作用[5]。慢病毒可整合于基因组内,形成稳定表 达。本研究通过慢病毒载体介导的RNAi技术沉默 肺癌细胞中的Hmgb3基因,探讨其对肿瘤细胞增 殖的影响,为后续研究提供有效的研究工具。 1 材料与方法 1.1 实验材料
人肺腺癌A549细胞、人胚肾293T细胞、慢病 毒骨架质粒Tet-pLKO-puro(addgene)及包装质 粒(PHR’-CMV-8.2△VPR、 PHR’-CMV-VSVG) 为江苏大学基础医学与医学技术学院2510实验室 保存,DMEM及胎牛血清购自美国Gibco公司, LipofectamineTM2000 Reagent购自美国Invitrogen公 司,PCR试剂盒及胶回收试剂盒购自日本TaKaRa 公司,stbl3超级感受态及带GFP的腺病毒由江苏大 学基础医学与医学技术学院2510实验室制作,快 切酶(EcoRI、AgeI)购于立陶宛Fermentas公司,质 粒大提及小提试剂盒购自美国OMEGA公司,嘌呤 霉素、强力霉素及MTT购于美国Sigma公司,蛋白 酶抑制剂及PVDF膜购于德国Roche公司,PMSF、 BCA试剂盒购于中国碧云天生物公司,鼠抗人 β-Actin抗体购自美国Bioworld公司;兔抗人Hmgb3 抗体购自美国Epitomics公司。 1.2 筛选Hmgb3基因相对高表达的肺癌细胞株进 行干扰实验
肺癌细胞株A549、SCLC、SK-MES-1于 37℃、5 % C O 2饱和湿度培养箱中培养至对数 生长期,以2×105/ml密度接种于六孔板,培养 48 h,提取RNA及蛋白。mRNA反转录成cDNA 后,定量PCR取平均Ct 值,相对定量以2 - Δ Δ C t 表达(A549设定为1),Hmgb3:上游引物: 5’-GTCCGCTTATGCCTTCT-3’,下游引物:5’-GA CATCGTCTTCCACCTCT-3’;GAPDH:上游引 物:5’-AACGGATTTGGTCGTATTG-3’,下游引 物:5’-GGAAGATGGTGATGGGATT-3’;BCA法 测蛋白浓度,调成相同浓度后各取20 μl样品进行 SDS-PAGE凝胶电泳,200 mA转膜1.5 h,5%脱脂 奶粉室温下封闭1 h,兔抗人Hmgb3(1∶3000)、 鼠抗人β-actin(1∶5000)4℃过夜,二抗室温1 h, TBST洗膜后显色拍照,统计软件分析结果。 1.3 慢病毒质粒构建
到http://www.sigmaaldrich.com/网站搜索与 pLKO.1质粒相兼容的Hmgb3 shRNA 序列,如下: 上游序列:5’-CCGGGCCGTAATTGACACATCTCT TCTCGAGAAGAGATGTGTCAATTACGGCTTTTT G-3’,下游序列:5’ -AATTCAAAAAGCCGTAATT GACACATCTCTTCTCGAGAAGAGATGTGTCAAT TACGGC-3’,对照组GFP shRNA序列,上游序列: 5’-CCGGGCAAGCTGACCCTGAAGTTCATCTCG AGATGAACTTCAGGGTCACGTTGCTTTTTG-3’, 下游序列:5’-AATTCAAAAAGCAAGCTGACC CTGAAGTTCATCTCGAGATGAACTCAGGGTC ACGTTGC-3’,由上海生工合成,用TE液稀释至 1 μg/μl,于95℃沸水中缓慢冷却至室温生成双链 RNA。慢病毒骨架质粒(Tet-pLKO-puro )经EcoRI 及AgeI双酶切,胶回收酶切的骨架质粒,与退火 形成的双链干扰序列经T4 DNA连接酶连接,并转 入Stbl3超级感受态细胞中,挑取3个转化子,活化 后进行菌液PCR:上游引物:5’-GGCAGGGATA TTCACCATTATCGTTTCAGA-3’,下游引物:5-’ TGCCATTTGTCTCGAGGTCG-3’,取阳性菌液再 扩大培养行质粒小提得到较纯的重组慢病毒质粒。 1.4 慢病毒包装、收获
取对数生长的293T细胞种于10 cm皿中,用 不含双抗的10% FBS DMEM培养,第二天汇合度 达60%~70%时,换无血清DMEM,按重组慢病毒 质粒:包装质粒PHR’-CMV-8.2△VPR:包装质 粒PHR’-CMV-VSVG=4 μg∶3 μg∶1 μg的比例用 LipofectamineTM2000 Reagent共同转染293T,6 h后 换含10% FBS的DMEM继续培养。收集48、72 h的 病毒上清液,4℃ 3 750 r/min离心10 min去除细胞 碎片,分装于EP管中并于-80℃保存。 1.5 感染目的细胞
取对数生长的A549细胞种于六孔板内,第二 天细胞汇合度达60%~70%时感染病毒,换含聚凝 胺的培养液,每孔加入500 μl病毒液,聚凝胺最终 浓度为8 μg/ml。第二天重复感染一次,次日用嘌 呤霉素的最低杀死浓度(1 μg/ml)进行筛选。 1.6 筛选最佳诱导表达浓度
A549-pLKO-sh-GFP种于24孔板内,用强力霉 素(Doxycycline:0、4、8 μg/ml)诱导GFP shRNA 的基因表达,诱导24 h后加入带GFP的腺病毒10 μl 感染细胞,第二天于荧光显微镜下观察干扰效果。 1.7 诱导A549-pLKO-sh-Hmgb3细胞株的表达并 检测干扰效果
A549-pLKO-sh-Hmgb3及A549-pLKO-sh- GFP细胞以1×104/ml密度接种于96孔板(每孔200 μl),设两组诱导浓度(0、6 μg/ml),每组设5个 复孔,细胞贴壁后,换含有相应浓度诱导物(强 力霉素)的DMEM继续培养96 h,每孔加入20 μl 5 mg/ml的MTT继续孵育4 h后终止培养,吸弃孔内 培养液,每孔加入150 μl DMSO,摇床上低速振荡 10 min,使结晶物充分溶解。在酶联免疫检测仪上 于490 nm处测量各孔的吸光值(A值)。以0 μg/ml 浓度为参照,计算在诱导浓度6 μg/ml下细胞的增 殖率,按以下公式计算:增殖率(%)=诱导表达 组/未诱导表达组×100%。 1.8 MTT法检测干扰Hmgb3后肺癌细胞增殖的变化
A549-pLKO-sh-Hmgb3及A549-pLKO-sh- GFP细胞以1×104/ml密度接种于96孔板(每孔200 μl),设两组诱导浓度(0、6 μg/ml),每组设5个 复孔,细胞贴壁后,换含有相应浓度诱导物(强 力霉素)的DMEM继续培养96 h,每孔加入20 μl 5 mg/ml的MTT继续孵育4 h后终止培养,吸弃孔内 培养液,每孔加入150 μl DMSO,摇床上低速振荡 10 min,使结晶物充分溶解。在酶联免疫检测仪上 于490 nm处测量各孔的吸光值(A值)。以0 μg/ml 浓度为参照,计算在诱导浓度6 μg/ml下细胞的增 殖率,按以下公式计算:增殖率(%)=诱导表达 组/未诱导表达组×100%。 1.9 统计学方法
采用SPSS17.0统计软件分析,计量资料以均 数±标准差(x±s)表示,每组实验重复3次,组间 差异比较采用t检验,多组样本间的比较采用F检 验,P<0.05表示差异有统计学意义。 2 结果 2.1 Hmgb3在肺癌细胞株中的表达
Hmgb3 mRNA水平上,SCLC及SK-MES-1表 达量均较低,不到A549的10%(P<0.05),见图 1A,蛋白水平表达情况同mRNA水平基本一致 (P<0.05),见图 1B,即Hmgb3在A549细胞中表达 量最高,为本研究的干扰对象。
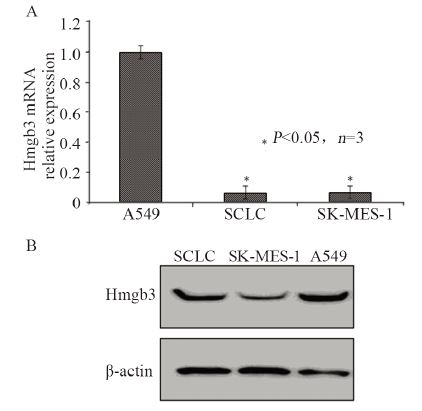
|
| A: relative expression level of Hmgb3 mRNA in different lung cancer cell lines; B: Hmgb3 protein expression in different lung cancer cell lines detected by Western blot 图 1 不同肺癌细胞系中Hmgb3 mRNA和蛋白质的相对表达 Figure 1 Expression levels of Hmgb3 mRNA and protein in different lung cancer cell lines |
慢病毒骨架质粒约10 634 bp(图 2A凝胶泳道 2,同时可见两种质粒构象:超螺旋及闭环)经 EcoRⅠ、AgeⅠ双酶切后,形成两段(图 2A泳道 1,接近10 000 bp左右的片段为回收对象),连接 的转化子进行菌液活化后以菌液为模板行PCR实 验,连接成功的阳性克隆菌液得到351 bp DNA片 段(图 2B泳道2为pLKO-sh Hmgb3,泳道4为pLKOsh GFP),对照组(未酶切质粒,图 2B泳道6)得 到2 000 bp左右的DNA片段,阴性对照组未得到任 何片段,阳性克隆菌液提质粒后行质粒PCR,也出 现阳性结果,得到351 bp DNA片段(图 2B泳道3为 pLKO-sh Hmgb3,泳道5为pLKO-sh GFP,同时可 见到两种质粒构象)。
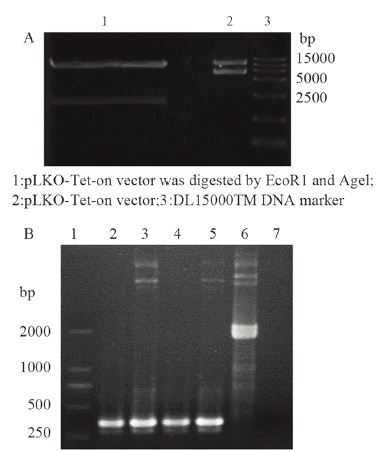
|
| A: Tet-pLKO-puro plasmid double digestion; B: recombinant lentivirus plasmid 图 2 慢病毒骨架质粒(Tet-pLKO-puro)双酶切和重组慢 病毒质粒凝胶电泳鉴定图 Figure 2 Agarose gel electrophoresis diagram of lentivirus skeleton plasmid double digestion and recombinant lentivirus plasmid |
慢病毒包装后,第二天细胞变圆变亮,病毒感 染A549细胞两天后,用最低杀死浓度的嘌呤霉素 筛选,三天后空白组细胞完全死亡,实验组留下被 病毒感染上的细胞,并用1/2最低杀死浓度维持培 养。设浓度梯度(0、4、8 μg/ml)的强力霉素,分别 诱导稳定细胞株A549-pLKO-sh-GFP干扰序列的表 达,第二天加入带GFP的腺病毒后在荧光显微镜下 观察荧光强度,结果随着诱导物浓度的增加,荧光 强度越弱,细胞状态于8 μg/ml出现较少凋亡细胞, 本实验筛选的最佳诱导浓度是6 μg/ml,见图 3。
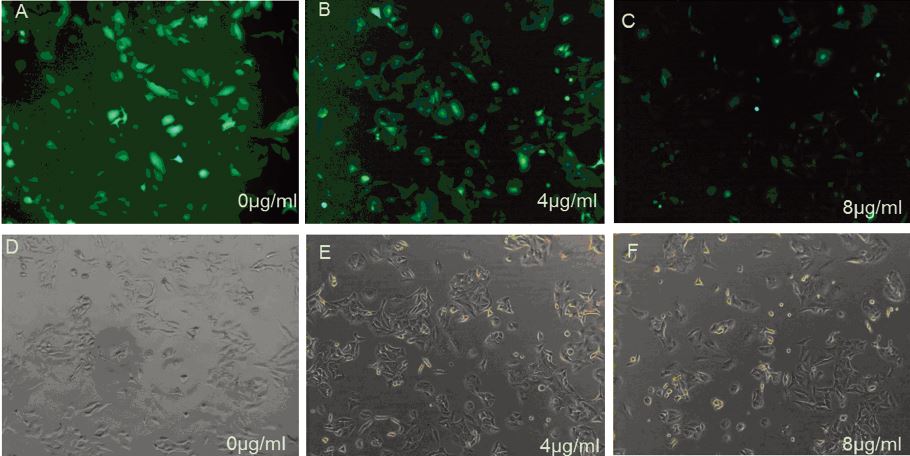
|
| Doxycycline (0, 4 and 8 μg/ml) induced A549-pLKO-sh-GFP which infected GFP adenovirus and obtained the best inducible concentration;A-C: fluorescent images; D-F:white light images 图 3 A549-pLKO-sh-GFP细胞筛选最佳诱导浓度 Figure 3 The best inducible concentration screened from the stable cell line A549-pLKO-sh-GFP |
实验组及对照组细胞分别诱导表达48 h后,收 取蛋白行Western blot实验:在最佳诱导浓度下, A549-pLKO-sh-Hmgb3细胞目的条带比未诱导情 况下明显减少,而A549-pLKO-sh-GFP细胞未有 明显变化,见图 4A,进行灰度值分析,实验组细 胞诱导表达后干扰效果达73%以上(P<0.05), 对照组细胞无明显干扰效果,差异无统计学意义 (P=0.721),见图 4B。即成功构建干扰Hmgb3 的慢病毒细胞株,且对照组A549-pLKO-sh-GFP对 Hmgb3无明显干扰效果。
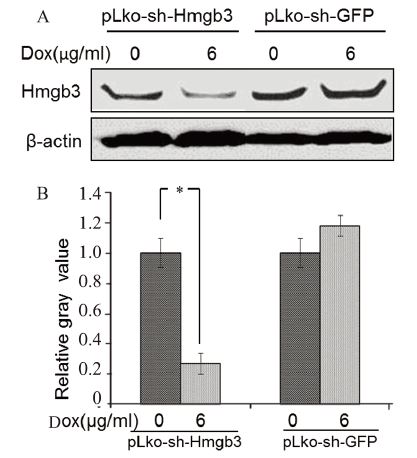
|
| A: Hmgb3 protein expression in two groups treated with and without doxycycline were detected by Western blot; B: histogram of Hmgb3 gray value in two groups treated with and without doxycycline; *: P <0.05, n=3; Dox: doxycycline 图 4 实验组与对照组在不同浓度强力霉素诱导下目的基 因Hmgb3的干扰效果 Figure 4 Interferential efficiency of Hmgb3 gene in experimental group and control group treated with different concentrations of doxycycline |
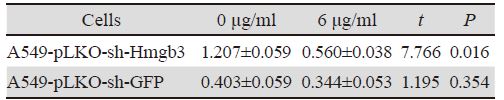
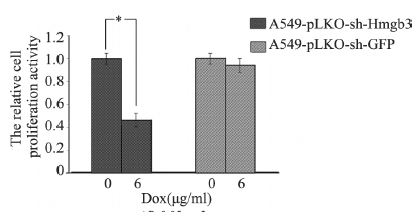
诱导表达96 h后,对照组A549-pLKO-sh-GFP 细胞与未诱导情况下相比增殖无明显变化,增殖 率约为94%,差异无统计学意义,实验组A549- pLKO-sh-Hmgb3细胞比未诱导情况下增殖明显减 慢,增殖率为46%(P<0.05),即最佳诱导浓度的 诱导剂及干扰GFP对细胞无明显抑制作用,干扰 Hmgb3后明显抑制细胞增殖,见表 1、图 5。
 |
|
| *P<0.05, n=3 图 5 在未诱导及诱导干扰序列表达96h后对照组与实验组 细胞相对增殖活力柱状图 Figure 5 Histogram of cell relative proliferation activity in experimental group and control group treated with and without doxycycline for 96h |
在我国,肺癌已成为首位恶性肿瘤死亡原 因,占全部恶性肿瘤死亡原因的22.7%,5年生存 率仅15%[6]。四大肿瘤治疗手段中虽然手术为首 选,但对于多数无法手术切除的肿瘤,基因治疗 成了一个可选的手段。
慢病毒载体在近年里由于其自身的优势逐渐成 为基因治疗及基因功能研究中的热点,由HIV-1载 体系统发展的第四代载体称可调控性慢病毒载体, Tet-pLKO-puro质粒就是其中一个代表[7]。RNA干 扰是指由双链RNA引起的mRNA水平互补序列特 异性转录后基因沉默,是生物体进化过程中抵御 外来基因侵袭和病毒感染的保守机制[8-9]。本研究 成功构建了可诱导型慢病毒,并可根据诱导物的 量来调控干扰序列的表达情况,加入适当诱导物 后干扰效率可达73%左右,撤除诱导物后又可恢 复原来无干扰功能的状态[7];骨架质粒及包装质 粒均采用质粒大提,保障了质粒的浓度和纯度, 为后续酶切和转染成功提供了有效的保障。运用 Inoue 法制备超级感受态细胞,让shRNA、慢病 毒骨架质粒的连接产物转化成功率提高数倍。本 研究中包装病毒时,采用10 cm皿,在不影响细胞 状态的情况下,提高了质粒与脂质体量(8 μg∶ 16 μl)的量,使转染效率提高,保证了病毒包装的 成功。本研究中采用对照组sh-GFP来确定最佳诱 导表达浓度,比直接拿目的基因做浓度筛选更省 时省力,用不同浓度的诱导物强力霉素诱导A549- pLKO-sh-GFP干扰序列表达24 h后,加入带GFP的 腺病毒感染,在荧光显微镜下观察荧光表达强度 即可,十分直观,并可以同时设多个浓度观察, 较RT-PCR 或Western blot实验更加省时省力,且 效果一致。本实验室采用两次感染法感染目的细 胞,时间相隔24 h,大大增加了目的细胞感染病毒 的机率。
Hmgb家族包括Hmgb1、 Hmgb2和Hmgb3[1], 参与多种生物学过程,包括维持核小体结构、核 糖核酸形成、调节基因转录及DNA修复等[10]。文 献报道Hmgb3参与急性淋巴细胞白血病的复发, 在进展期乳腺癌组织中的高表达[11]与非小细胞肺 癌的临床预后差相关[4],但该基因的功能目前尚未 见报道。因此采用干扰技术,在高表达Hmgb3的 A549细胞中,干扰Hmgb3表达后,发现细胞增殖 明显减缓,这与我们前期在胃腺癌细胞株BGC823 中实验结果一致[12]。Terada等[13]在非洲爪蟾蜍中, 通过干扰实验也观察到Hmgb3能促进蟾蜍视网膜 祖细胞增殖。因此,推测Hmgb3基因的的过表达 导致细胞周期紊乱。但究竟Hmgb3是如何在肺腺 癌A549中影响细胞周期及其他功能,还有待进一 步研究。
| [1] | Vaccari T, Beltrame M, Ferrari S, et al.Hmg4, a new member of the Hmg12 gene family[J]. Genomics, 1998, 49(2): 247-52. |
| [2] | Nemeth MJ, Kirby MR, Bodine DM.Hmgb3 regulates the balance between hematopoietic stem cell self-renewal and differentiation[J].Proc Natl Acad Sci U S A,2006, 103(37):13783-8 |
| [3] | Hayes DC, Secrist H, Bangur CS, et al. Multigene real-time PCR detection of circulating tumor cells in peripheral blood of lung cancer patients[J]. Anticancer Res, 2006, 26(2B):1567-75. |
| [4] | Song N, Liu B, Wu JL,et al. Prognostic value of HMGB3 expression in patients with non-small cell lung cancer[J]. Tumour Biol, 2013, 34(5): 2599-603. |
| [5] | Lv XX, Lv RJ, Lv C. Gene knockout and gene silencing[J]. Heilongjiang Yi Yao Ke Xue, 2009, 32(5):65-6. [吕学诜, 吕仁杰, 吕 超. 基因敲除与基因沉默[J]. 黑龙江医药科学, 2009, 32(5): 65-6.] |
| [6] | Molina R, Filella X, Augé JM, et al. Tumor markers (CEA, CA 125,CYFRA 21-1, SCC and NSE) in patients with non-small cell lung cancer as an aid in histological diagnosis and prognosis comparison with the main clinical and pathological prognostic factors[J]. Tumour Biol, 2003, 24(4): 209-18. |
| [7] | Wiederschain D, Wee S, Chen L,et al. Single-vector inducible lentiviral RNAi system for oncology target validation[J]. Cell Cycle, 2009, 8(3):498-504. |
| [8] | Elbashir SM, Harborth J, Lendeckel W, et al. Duplexes of 21 nucleotide RNAs mediate RNA interference in cultured mammalian cells[J]. Nature, 2001, 411(6836): 494-8. |
| [9] | Song E, Lee SK, Wang J, et al. RNA interference targeting Fas protects mice from fulminant hepatitis[J]. Nat Med, 2003, 9(3): 347-51. |
| [10] | Yanai H, Ban T, Wang Z,et al. HMGB proteins function as universal sentinels for nucleic-acid-mediated innate immune responses[J]. Nature, 2009, 462(7269): 99-103. |
| [11] | Pourhoseingholi MA, Moghimi-Dehkordi B, Safaee A, et al. Prognostic factors in gastric cancer using log-normal censored regression model[J]. Indian J Med Res, 2009, 129(3):262-7. |
| [12] | Tang HR, Luo XQ, XuG, et al. High mobility group-box 3 overexpression is associated with poor prognosis of resected gastric adenocarcinoma[J]. World J Gastroenterol, 2012, 18(48): 7319-26. |
| [13] | Terada K, Kitayama A, Kanamoto T, et al. Nucleosome regulator Xhmgb3 is required for cell proliferation of the eye and brain as a downstream target of Xenopus rax/Rx1[J]. Dev Biol, 2006, 291(2): 398-412. |
 2014, Vol. 41
2014, Vol. 41


