2.四川省肿瘤医院头颈肿瘤外科
分化型甲状腺癌(differentiated thyroid carcinoma, DTC)占甲状腺癌的90%以上[1],其生存率大约为 85%~90%[2]。甲状腺乳头状癌(papillary thyroid carcinoma,PTC)又为DTC的主要组织学类型, PTC起源于内胚层的滤泡细胞,能够分泌甲状腺 球蛋白和甲状腺素。然而与全身其他部位的神经 内分泌癌相同,原发于甲状腺的神经内分泌癌则 较为罕见,其主要组织类型为髓样癌(medullary thyroid cancer,MTC)。MTC主要起源于神经脊上鳃 后体的滤泡旁细胞,能分泌降钙素及其他一些肽 类激素。尽管两种肿瘤的胚胎学起源不尽相同, 但事实上仍有一些罕见特例存在,一些MTC就同 时伴随有滤泡细胞来源的肿瘤(如PTC)。本文报道 1例甲状腺右叶为神经内分泌癌,而其左叶为微小 乳头状癌的双叶双病变混合类型的病例。并对此 类病例的发病机制及相关治疗问题进行讨论。 1 病例资料
患者,男,62岁。于2月前无明显诱因发现右 颈部约2 cm×1.5 cm大小肿块,无疼痛、声嘶、呼 吸困难、咯血等症状。自觉肿块进行性增大,于 当地医院行颈部彩色B型超声检查示:甲状腺右叶 实质性占位,约2.7 cm×4.0 cm。左侧甲状腺及峡 部未见明显异常。后于四川省人民医院行细胞学 穿刺活检示:甲状腺右叶见有核异型细胞团,考 虑上皮源性肿瘤,倾向恶性。遂来我院就诊,门 诊以“甲状腺肿瘤"收入我科。患者自患病以来, 精神食欲可,大小便正常,体重无明显变化。查 体:颈软无抵抗,颈静脉无怒张,甲状腺右叶扪及大小约3.0 cm×4.0 cm 的肿块,质硬,随吞咽 活动度差,边界欠清,左侧甲状腺未扪及明显肿 大,气管左偏,双侧颈、锁骨上及腋下未触及肿 大的浅表淋巴结。我院辅助检查中颈部彩色B型 超声显示:甲状腺右叶下极区域团块,考虑恶性 病变,右侧颈部淋巴结增大,较大者约1.6 cm× 0.4 cm。细胞学穿刺结果显示:甲状腺右叶穿刺 物血块中查见散在分布的上皮样细胞团伴坏死, 疑为恶性,未见甲状腺滤泡,右颈前包块穿刺涂 片上查见肿瘤细胞倾向低分化的癌细胞。颈部CT 显示:肿瘤侵及胸锁乳突肌及食管等重要结构, 邻近颈总动脉,边界不清。实验室检查、全身骨 扫描、纤微支气管镜及胃镜等均未见明显异常。 根据上述临床特征,查体及辅助检查结果初步诊 断为甲状腺癌。手术方式采用全麻下行甲状腺近 全切除术+中央区(Ⅵ区)及右颈侧区(Ⅱ~Ⅳ 区)淋巴结清扫术+喉返神经探查术。术中肉眼 见:甲状腺右叶质硬肿块,约6.0 cm×4.0 cm,边 界欠清,气管明显左偏,肿块将颈鞘向上推挤并 侵犯食管、椎前筋膜及颈深筋膜,肿瘤包裹喉返 神经,右侧气管食管沟见0.5 cm~1.0 cm质硬肿大 淋巴结,且淋巴结与肿块有融合,甲状腺左叶未 扪及明显肿块。切除右叶时我们注意分离保护了 与肿瘤紧密粘连的颈鞘内容物,但由于右侧喉返 神经被肿瘤包裹无法分离,遂将其连同肿瘤一并 切除,同时行Ⅵ和Ⅱ~Ⅳ区淋巴结清扫,手术范 围下达锁骨下动脉,深面达椎前筋膜及食管浆膜 层。峡部及左叶在行近全切除术时保留了部分背 膜组织、左侧上下两枚甲状旁腺及喉返神经。整 个手术过程中均主动分离甲状腺上、下动静脉和 甲状腺中静脉。术中右叶肿块冰冻示:甲状腺高 度恶性肿瘤。术后石蜡病理检查示:右叶肿块为 高度恶性肿瘤,结合免疫组织化学染色后诊断为 神经内分泌癌,见图1,左叶查见微小乳头状癌(直 径约0.5 cm),见图2。期间进行对症支持处理,于术后一周、三月行剂量为30 mci的sup>131I治疗,总剂 量60 mci。并采用终身服用左甲状腺素片100 μg/d 进行甲状腺素替代与TSH的抑制治疗。现患者已 于术后三月、半年、一年进行了门诊随访,有声 嘶,无手脚麻木等并发症,颈部活动自如,其血 清甲状腺素、降钙素及生化等血清学检查均未见 异常,颈部B型超声示术后改变,未见确切占位, 胸片阴性,患者恢复良好。
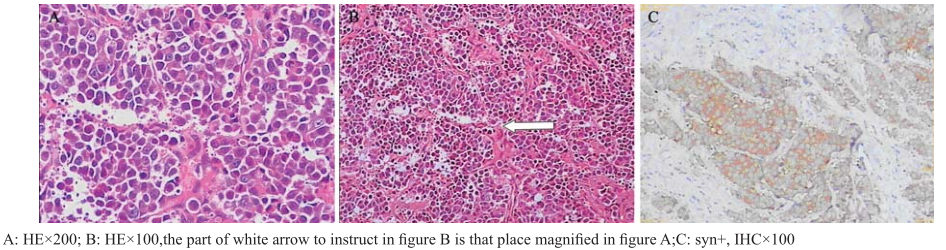 |
图1 甲状腺右叶神经内分泌癌组织HE、免疫组织化学染色 Figure 1 Tissue specimens from the right lobe of thyroid gland which has the features of Neuroendocrine carcinoma were stained with Hematoxylin,Eosin immunohistochemistry staining |
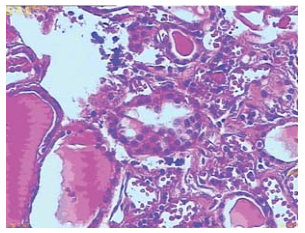 |
图2 甲状腺左叶微小乳头状癌HE染色 (×100) Figure 2 Tissue specimens from the left lobe of thyroid gland which is Papillary thyroid carcinoma were stained with Hematoxylin and Eosin staining (×100) |
2.1 发生机制
一直以来对于甲状腺癌的发病机制尚不清楚, 目前认为其主要与促甲状腺激素(thyroid stimulating hormone,TSH)的过度分泌、体内外的电离辐射以 及原癌基因通过点突变、错位及重排而被激活等 因素相关。随着对发病机制的探索,有研究[3]发现 一种特殊的原癌基因RET的变化可以使甲状腺肿瘤 之间出现转化,当其出现点突变和重排时可分别 作用于MTC和PTC发生过程中的络氨酸激酶途径 而改变其分化方向,同时临床上也确实有极少的 原发病例存在MTC和PTC/FTC共存的情况。由此 Apel等[4]首次提出了混合型甲状腺癌的概念,进而 有学者[5]提出这种不同类型甲状腺癌共存的关系可以进一步分为三类:两类肿瘤分处不同的腺叶(本 文病例);两类肿瘤紧邻;两类肿瘤的细胞相互 渗透。但是出现这种共存现象的机制仍未明朗, 如果根据早前提出的干细胞理论,则鳃后体最有 可能是干细胞的胚胎学来源,因为鳃后体能分化 成为滤泡细胞和滤泡旁细胞,相应的这些混合性 甲状腺癌细胞在甲状腺球蛋白和降钙素上均有免 疫反应性。然而Volante等[6]却认为这种混合性癌并 非由单一的干细胞分化而来,原因如前所述,即在 MTC中RET发生点突变,而在PTC中RET发生的是 基因重排,且肿瘤细胞有杂合现象的缺如和X染色 体的缺失。Rossi等[7]的研究进一步显示这种共存的 混合性甲状腺癌中MTC肿瘤中主要突变的是RET 基因,而在PTC中则主要是BRAF基因。总之,目 前对于这种共存现象究竟是偶然个案还是存在肿 瘤发生过程中的某种必然机制还不明确,仍有待 进一步研究证实。 2.2 治疗原则
甲状腺神经内分泌癌(如MTC)伴随分化型 甲状腺癌(如PTC/FTC)的病例较为罕见,故对其 治疗目前尚无统一的方案,但由于后者的预后较 前者好,故目前主要参照前者的治疗策略。在具有 神经内分泌功能的MTC中约有70%~80%为散发型 甲状腺髓样癌(SMTC),20%~30%为遗传性甲状 腺髓样癌(HMTC),MTC对于放射性碘消融术、 体外放疗及化疗均不敏感,所以手术治疗仍作为 主要的治疗手段。因HMTC相较于SMTC有着更高 比例的多灶性病变,故就病变的切除范围而言,对 于HMTC行甲状腺全切术基本达成共识。但对于 SMTC的患者,当病灶仅限于一侧腺叶时,切除范 围尚存争议。国外研究认为SMTC依然有10%~20% 的患者存在多灶性,故主张全切术[8, 9, 10],国内研究 则认为行单侧腺叶加峡叶切除术即可[11]。另对淋 巴结清扫的范围而言,因为约50%的MTC患者在确诊时出现了淋巴结转移且大部分位于中央区淋 巴结[8, 9],因此现主张至少行中央区淋巴结清扫, 当术中发现或术前检查证实存在淋巴结转移者, 则应加做颈侧区淋巴结清扫。 2.3 本例患者的治疗
本例患者并无特殊的神经内分泌亢进的表 现,术前我们进行了颈部B型超声和细胞学穿刺 活检(fine needle aspiration cytology,FNAC)等相 关辅查,因FNAC的阳性预测值可达94.4%[12],故 我们认为无论何种类型的甲状腺癌术前均应推荐 使用。完善相关辅查后,我们通过综合评价病情 考虑本例属于高危组患者[13, 14],按照AJCC第7版 (2010)甲状腺癌国际TNM分期属T4bN1bM0。 这里必须指出,正确的进行分期和危险度分级对 于患者的个性化治疗显得十分重要。而要做到 正确的分期和分度就要在治疗前完善必要的辅助 检查,因为当肿瘤侵犯到包膜外至气管或者食管 时,手术完全切除肿物的难度会加大,从而治疗 方案也需要做出相应调整。术式上我们选择了甲 状腺近全切除术+中央区(Ⅵ区)及右颈侧区(Ⅱ ~Ⅳ区)淋巴结清扫术+喉返神经探查术。该种术 式的选择是在综合考虑了患者术后的生存质量、 器官功能及并发症等问题后做出的,术后患者有 声嘶,但无明显低钙血症,余一般情况可,恢复 良好。考虑到患者具备诸多高危因素且右叶为神 经内分泌癌,虽于术中完整切除了肿块并进行了 区域淋巴结清扫,但并不能排除有微小残留病灶 的可能,故我们术后运用了放射性sup>131I (RAI)消融 术。结合最近的NCCN指南[15]和我国指南[14]的推荐 剂量,我们采用了术后30 mci,三月后再给予30 mci,总剂量为60 mci,而对于神经内分泌癌是否 应该提高治疗剂量,经过检索目前还无文献明确 报道。术后通过终身服用左甲状腺素片100 μg/d进 行了TSH抑制治疗和替代疗法。通过对患者的随 访我们发现,运用手术切除+放射性sup>131I (RAI)消融 术+TSH抑制治疗的联合治疗方案在治疗MTC合并 PTC的本病例中效果较好,患者目前除有声嘶外, 其余情况良好,生存质量较好,无明显并发症, 但是具体预后还需要更长时间的随访。
综上所述,原发于甲状腺的神经内分泌癌当 合并有分化型甲状腺癌时,具体的切除范围多少 为宜?131I治疗的剂量是否应该提高?TSH治疗抑 制时是否应该将TSH抑制到更低?外放射治疗能 否作为辅助治疗措施?有相关靶向药物可以运用 吗?甚至当甲状腺神经内分泌癌因为高浸润性而 出现广泛粘连或者转移时,是否还运用手术?单 纯的减瘤术对该类患者的意义?晚期的患者是否 可以采取外放射治疗和化疗进行姑息性治疗?治 疗后复查的频率和时间是多少?这些问题都极为 关键,希望今后能有相关研究解决这些问题,让 这部分患者也能获得正确的、个性化的治疗,从 而获得较好的预后。
| [1] | Schlumberger M, Sherman SI. Approach to the patient with dvanced differentiated thyroid cancer[J].Eur J Endocrinol, 012,166(1):5-11. |
| [2] | Toniato A,Boschin I,Casara D,et al. Papillary thyroid carcinoma: actors infl uencing recurrence and survival[J]. Ann Surg Oncol, 008,15(5):1518-22. |
| [3] | Bounacer A, Wicker R, Caillou B, et al. High prevalence of ctivating ret protooncogene rearrangements, in thyroid tumors rom patients who had received external radiation[J]. Oncogene, 997, 15(11):1263-73. |
| [4] | Apel RL, Alpert LC, Rizzo A, et al. A metastasizing composite arcinoma of the thyroid with distinct medullary and papillary omponents[J]. Arch Pathol Lab Med ,1994,118(11):1143-7. |
| [5] | Sadow PM, Hunt JL. Mixed medullary-follicular-derived arcinomasof the thyroid gland[J]. Adv Anat Pathol,2010,17(4): 82-5. |
| [6] | Volante M, Papotti M, Roth J, et al. Mixed medullary-follicular hyroid carcinoma,Molecular evidence for a dual origin of tumor omponents[J].Am J Pathol,1999,155(5):1499-509. |
| [7] | Rossi S, Fugazzola L, De Pasquale L, et al. Medullary and apillarycarcinoma of the thyroid gland occurring as a collision umour:report of three cases with molecular analysis and review f the literature[J]. Endocr Relat Cancer,2005,12(2):281-9. |
| [8] | Lundgren CI,Delbridg L,Learoyd D,et al.Surgical approach to edullary thyoid canner[J].Arq Bras Endocrinol Metabol,2007,51 5):818-24. |
| [9] | Gong L,Yi CH,Chen WK,et al. Retrospective Analysis of Pattern f Cervical Lymph Node Metastasis in Differentiated Thyroid arcinoma[J].Zhong Liu Fang Zhi Yan Jiu,2012,39(1):48-50.[龚龙,易春华,陈文奎,等.分化型甲状腺癌颈淋巴结转移特点的回顾性分析[J].肿瘤防治研究,2012,39(1):48-50.] |
| [10] | Moo-Young TA,Traugott AL,Moley JF.Sporadic and familial edullary thyroid carcinoma:state of the art[J]. Surg Clin North m,2009,89 (5):1193-204. |
| [11] | Zhang ZX, Li ZJ,Tang PZ, et al. Surgical treatment and prognosis nalysis On medullary thyroid carcinoma[J]. Zhonghua Er Bi Yan ou Tou Jing Wai Ke Za Zhi, 2011,46(3):209-13.[张再兴,李正江,唐平章,等.甲状腺髓样癌的外科治疗及预后分析[J].中华 鼻咽喉头颈外科杂志,2011,46(3):209-13.] |
| [12] | Wang JF, Zhang HM, Xu JP, et al. Value of ultrasonography and 9mTcO4 imaging in diagnosing thyroid nodules[J]. Jiangsu Yi ao,2011,37(17):2011-3. [王济芳,张海鸣,许建萍,等.B超、 99mTcO4显像和细针穿刺活检对甲状腺结节的诊断价值[J].江 医药,2011,37(17):2011-3.] |
| [13] | Takami H, Ito Y, Okamoto T, et al.Therapeutic strategy for ifferentiated thyroid carcinoma in Japan based on a newly stablished guideline managed by Japanese society of thyroid urgeons and Japanese association of endocrine surgeons[J].World Surg ,2011,35(1):111-21. |
| [14] | Chen JC, Li C, Wang SX, et al. Guidelines for the diagnosis nd treatment of differentiated thyroid carcinoma[J].Zhong iu Yu Fang Yu Zhi Liao,2011,24(1):55-68. [陈建超,李超, 王少新,等.分化型甲状腺癌的诊治指南[J].肿瘤预防与治疗,2011,24(1):55-68.] |
| [15] | NCCN clinical practice guidelines in thyroid carcinoma[S]. ersion 1. 2011. |
 2014, Vol.41
2014, Vol.41
