2.中心实验室
2.Cancer Research Center, Xinxiang Medical University;
3.San Quan Medical College
5-氟尿嘧啶(5-fluorouracil,5-Fu)和多西紫杉醇 (Docetaxel,DOC)是临床常用的化疗药物,有研究 表明不同个体相同体表面积剂量下给药后稳态血 浆浓度不同。本文回顾性研究5-氟尿嘧啶和多西他 赛联合化疗时血药浓度的个体差异,并初步探讨 血药浓度与化疗不良反应及近期疗效的关系。
1 资料与方法 1.1 病例选择
入组标准:(1)经组织学或细胞学证实的恶 性肿瘤;(2)适合5-Fu+DOC联合化疗;(3)年 龄在18~80岁之间,性别不限;(4)KPS评分≥ 60分;(5)预计生存期3月以上;(6)末梢血、 骨髓、肝肾功能基本正常;(7)先前未接受5-Fu 联合DOC化疗或在入组前已停药6月以上。
排除标准:(1)妊娠或哺乳妇女;(2)先前使 用过DOC或5-Fu且时间短于6月;(3)存在其他严 重疾病,包括化疗开始前6月发生过心梗,未得到控 制的高血压、糖尿病或心律失常;(4)有严重精神 或神经疾病病史;(5)有活动性溃疡或其他皮质激 素禁忌证;(6)同时合并放疗等其他抗癌治疗。
本实验共收集江西省肿瘤医院肿瘤科符合要 求的恶性肿瘤患者40例,其中胃癌33例,食管癌7 例,均有临床可测量的病灶。男28例,女12例, 年龄21~79岁,中位年龄57.7岁。既往有化疗史者 30例,初次化疗10例。所有患者均接受5-Fu 2.5 g/m2 静脉维持120 h,亚叶酸钙 0.2 g,d1~5,DOC 75 mg/m2,d1,21天为一周期。DOC给药前1天口 服地塞米松8毫克/次,2次/日,给药当天静脉滴注 地塞米松10 mg,化疗前给予止吐药物。患者接受 1~6周期化疗,中位周期数3.5。所有患者均签署书 面知情同意书。
1.2 血药浓度测定
所有患者第1周期第2天距离多西紫杉醇输注 结束24 h,开始5-Fu静脉持续输注12 h时采集全 血3 ml,30 min内3 000 r/min离心15 min,分离 血浆,-80℃备用。采用高效液相色谱法(high performance liquid chromatography,HPLC)测定 5-Fu和DOC血药浓度。
5-Fu血药浓度测定:流动相为0.01 mol/L磷酸盐 缓冲液(pH3.0);流速0.7 ml/min,内标为5-溴尿嘧 啶。配制5-Fu标准液建立标准曲线。血浆样品以异 丙醇/乙酸乙酯(16/84,V/V)萃取,进样量20 μl,紫 外检测波长260 nm,记录色谱图计算血药浓度[1]。
DOC血药浓度测定流动相为乙腈-水(48:53); 流速0.7 ml/min,内标为地西泮。配制DOC标准液 建立标准曲线。血浆样品用叔丁基甲醚提取2次, 进样量50 μl,检测波长230 nm,记录色谱图计算 血药浓度[2]。
1.3 毒性与疗效评价
所有患者于治疗2周期后行第1次评价,并 于4周后进行疗效确认,以后每2周期评价1次, 直至疾病进展或患者不可耐受。不良反应按 照国立癌症研究所的常规毒性判定标准3.0 版 (Common Terminology Criteria for Adverse Events v3.0,CTC-AE v3.0)分为0~Ⅳ度。近期疗效按 照实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)分为完全缓解 (complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stable disease,SD)和 疾病进展(progressive disease,PD)。
1.4 统计学方法
稳态血药浓度采用平均值、中位值、标准差 进行统计描述,血药浓度和不良反应、疗效的关 系采用Fisher精确概率计算法。所有统计分析均由 SPSS 17. 0软件完成。检验水准α=0.05。
2 结果 2.1 稳态血药浓度的分布 2.1.1 5-Fu稳态血药浓度的分布
40例患者5-Fu血药浓度变异较大。血药浓度范围为1.2~96.6 mg/L, 平均浓度和中位浓度分别为35.6 mg/L和28 mg/L, 标准差为 21.3 mg/L,经对数转换后其血药浓度呈 正态分布。
2.1.2 DOC稳态血药浓度的分布
40例患者DOC 血药浓度范围为0.34~0.98 mg/L,平均浓度和中位 浓度分别为0.72 mg/L 和0.67 mg/L,标准差为0.36 mg/L,其血药浓度符合正态分布。
2.2 血药浓度和不良反应的相关性
化疗后的不良反应主要有脱发、食欲不振、 恶心呕吐、腹泻、黏膜炎、骨髓抑制、肝功能损 害等,因本组患者5-Fu持续静脉输注均行经外周 中心静脉置管,故未见静脉炎发生。
将5-Fu血药浓度按<30 mg/L和≥30 mg/L 分为 两组,比较两组患者不良反应的差异。化疗后脱 发、食欲不振、恶心呕吐、骨髓抑制、肝功能损 伤程度和5-Fu血药浓度无相关性,腹泻级别和5-Fu 血药浓度存在相关性(P=0.037)。黏膜炎级别和 5-Fu血药浓度有相关性(P=0. 017),见表1。
|
|
表1 5-Fu血药浓度与化疗不良反应的相关情况 Table 1 Correlation between 5-Fu concentration and adverse events |
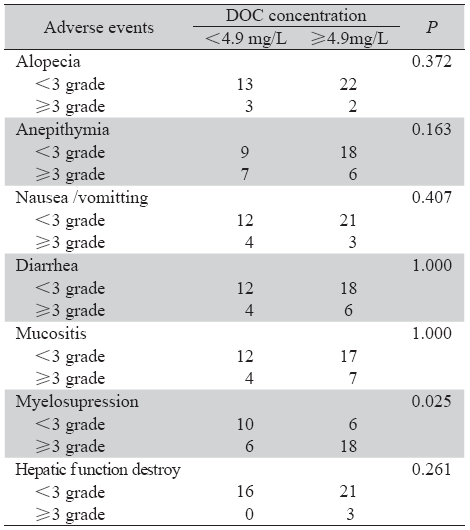
将DOC血药浓度按<4.9 mg/L和≥4.9 mg/L 分为两组,比较两组患者不良反应的差异。化疗 后脱发、食欲不振、恶心呕吐、腹泻、黏膜炎程 度、肝功能损伤和DOC血药浓度无相关性,骨髓 抑制级别和DOC血药浓度存在相关性,P=0. 025, 见表 2。
|
|
表 2 DOC血药浓度与化疗不良反应的相关情况 Table 2 Correlation between DOC concentration and adverse events |
2.3 血药浓度和近期疗效的相关性 2.3.1 5-Fu血药浓度与近期疗效的相关性
按5-Fu血药浓度<30 mg/L和≥30 mg/L分为两组采用 Fisher精确概率计算法分析患者5-Fu血药浓度高低 和近期疗效的相关性,结果发现化疗后5-Fu血药 浓度和近期疗效无相关性(P=0.592),见表 3。
|
|
表 3 5-Fu血药浓度与化疗近期疗效的相关性 Table 3 Correlation between 5-Fu concentration and short term effect |
2.3.2 DOC血药浓度与化疗近期疗效的相关性
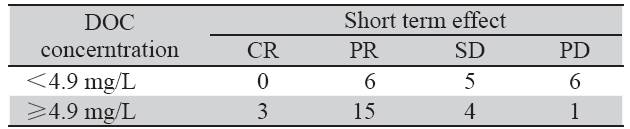
按DOC血药浓度<4.9 mg/L和≥4.9 mg/L分 为两组采用Fisher精确概率计算法分析患者DOC 血药浓度高低和近期疗效的相关性,结果发现 化疗后DOC血药浓度和近期疗效显著相关, (P=0.020),见表 4。
|
|
表 4 DOC血药浓度与化疗近期疗效的相关性 Table 4 Correlation between DOC concentration and short term effect |
3 讨论
5-Fu药物半衰期为10~20 min,5个半衰期后达 到稳态血药浓度,因此持续静脉泵入12h后检测的 浓度可以代表该化疗周期内的稳态浓度。DOC静 脉给药后机体的清除服从三室模型,α、β、γ半衰 期分别为4.5 min、38.3 min和12.2 min,24 h后可以 认为基本达到稳定状态[3]。以往药代动力学数据表 明,由于年龄、性别、代谢酶活性等个体差异的影 响,5-Fu和DOC在相同体表面积剂量下血药浓度在 不同个体间差异有统计学意义,本研究结果也证实 了上述两药在个体间稳态血药浓度间差异有统计学 意义,尤其5-Fu在相同体表面积剂量下,稳态血药 浓度最低值和最高值相差可达100倍。
5-Fu和DOC稳态血药浓度受到多种因素 影响,二氢嘧啶脱氢酶( dihydropyrimidine dehydrogenase,DPD)是5-Fu代谢的关键性限速酶, 进入体内的5-Fu 80%~85%由DPD降解失活,DPD 基因型对5-Fu血药浓度有一定的预测价值,但在 DPD正常人群也观察到5-Fu的高血药浓度,提示 DPD并不是5-Fu浓度预测的良好指标。胸苷酸合 成酶(thymidylate synthase,TS)存在于肿瘤组 织,是5-Fu治疗的重要靶点,肿瘤组织的TS水平 影响了5-Fu的治疗效果。启动子区域存在双联重 复(2R)和三联重复(3R)这两种TS基因型可能 与5-Fu体内毒性有关。不同时辰给药也是影响血药 浓度的因素,有研究表明5-Fu在凌晨4时血药浓度 最高,DOC在上午8时给药毒性反应最低,这可能 与不同时间药物代谢关键酶的活性不同有关[4, 5]。 稳态血药浓度是多种因素综合作用的结果,其机 制十分复杂,单独一种因素难以预测药物稳态浓 度。在监测血药浓度的前提下,通过调整给药剂 量可以将稳态浓度调整到适合的范围内,从而可 能在疗效和不良反应之间寻找到一种平衡。
关于5-Fu的最佳血药浓度范围现在仍有不同观 点[6],有学者认为5-Fu治疗结肠癌的最适血药浓度 为25 mg/L,超过这一浓度毒性发生率明显增加, 5-Fu治疗头颈部肿瘤时有人提出30 mg/L可能是较 好的血药浓度目标,从而提出在不同实体瘤5-Fu 的最适浓度可能有差异。彭柔君等[1]对胃癌患者的 研究数据发现5-Fu血药浓度范围在50~100 mg/L时 疗效较好而不良反应可以接受,但这一研究5-Fu 体表面积剂量为2.5 g/m2维持静脉滴注46 h,与前 述研究2.5 g/m2维持静脉滴注120 h相比给药剂量明 显偏大。本研究体表面积剂量为2.5 g/m2维持静脉 滴注120 h,故按照<30 mg/L和≥30 mg/L分为两 组,结果发现这两组患者腹泻和黏膜炎严重程度 差异有统计学意义,但临床疗效差异未见统计学 意义,提示30 mg/L是否为合适的5-Fu浓度尚有异 议。目前关于DOC的药代动力学及最佳浓度数据 相对较少,我们综合数篇文献[7, 8],其中包括806 例的大样本量研究,在本研究中将DOC最佳血药 浓度定在4.9 mg/L,结果发现DOC稳态血药浓度 <4.9 mg/L和≥4.9 mg/L的患者化疗后骨髓抑制严 重程度及临床疗效差异均存在统计学意义,提示 4.9 mg/L可能是DOC的合适血药浓度。
数项研究证实5-Fu的血药浓度高低与临床近期 疗效和远期疗效相关[9, 10],国内蔡讯等回顾性分析 70 例局部进展或转移性胃癌患者化疗后5-Fu血药 浓度与疗效及不良反应之间的关系,发现晚期胃癌 患者在 5-Fu为基础的方案化疗后,5-Fu血药浓度维 持在25.6~37.4 mg/L者能获得更好的PFS和OS。日 本学者Kuwahara等[11]回顾性分析了49例胃癌患者也 发现5-Fu高血药浓度组在近期反应和总生存方面均 有获益。但本研究没有发现5-Fu血药浓度差异对临 床近期疗效的影响,这可能受到癌细胞生物学特性 (如TS活性差异)、样本量等因素的影响,有待扩 大样本量继续观察。DOC血药浓度对疗效影响的 报道相对较少,本研究发现DOC血药浓度的高低与 近期疗效明显相关,提示根据血药浓度指导DOC给 药剂量可能起到提高临床疗效的目的。
本研究结果显示5-Fu和DOC相同体表面积剂 量给药均存在个体间稳态血药浓度差异,稳态浓度 的不同影响了药物不良反应的严重程度。5-Fu血药 浓度过高将导致中重度腹泻和黏膜炎发生率增加, DOC血药浓度过高与更加严重的骨髓抑制有关,与 更好的临床近期疗效相关,提示监测血药浓度可能 预测化疗毒性及疗效。
| [1] | Peng RJ, Dong QM, Shi YX, et al. Correlative analys is between erum dihydropyrimidine dehydrogenase activity, concentration f 5-Fluorouracil and adverse events in the treatment of advanced as tric cancer patients[J]. Ai Zheng,2006,25(8):1039-43.[彭柔君, 秋美,史艳侠,等. 胃癌患者外周血 DPD 活性、 5-FU 血药浓 与毒性反应的相关性分析[J]. 癌症, 2006, 25(8):1039-43.] |
| [2] | Zhang GW, Pan QX, Lin ZH, et al. Determination of Docetaxel in uman Plasma by HPLC[J].Zhongguo Yao Fang,2012,23(14): 286-8.[张国伟,潘群雄,林志航,等. HPLC法测定人血浆中多西 赛的浓度[J]. 中国药房,2012,23(14):1286-8.] |
| [3] | Engels FK, Loos WJ, van der Bol JM, et al. Therapeutic drug onitoring for the individualization of docetaxel dosing: randomized pharmacokinetic study[J]. Clin Cancer Res, 011,17(2):353-62. |
| [4] | Saif MW,Choma A,Salamone SJ,et al. Pharmacokinetically uided dose adjustment of 5-fluorouracil: a rational approach o improving therapeutic outcomes[J]. J Natl Cancer Inst, 009,101(22):1543-52. |
| [5] | Hooker AC,Ten Tije AJ,Carducci MA,et al. Population pharmacokinetic odel for docetaxel in patients with varying degrees f liver function: incorporating cytochrome P4503A activity easurements[J]. Clin Pharmacol Ther, 2008, 84(1):111-8. |
| [6] | Ychou M, Duffour J, Kramar A, et al. Individual 5-FU dose daptation in metastatic colorectal cancer: results of a phase II tudy using a bimonthly pharmacokinetically intensified LV5FU2 egimen[J]. Cancer Chemother Pharmacol, 2003, 52 (4): 282-90. |
| [7] | Baker SD, Zhao M, Lee CK, et al. Comparative pharmacokinetics f weekly and every-three-weeks docetaxel[J]. Clin Cancer Res, 004, 10(6):1976-83. |
| [8] | Baker SD, Verweij J, Cusatis GA, et al. Pharmacogenetic pathway nalysis of docetaxel elimination[J]. Clin Pharmacol Ther, 2009, 5(2):155-63. |
| [9] | Cai X,Xue P,Song WF,et al.The role of pharmacokinetic monitoring f fluorouracil in improvement of efficacy and reduction of dverse reactions for patients with advanced gastric cancer[J]. hong Liu,2011,31(10):930-6.[蔡讯,薛鹏,宋卫峰,等. 氟尿嘧啶 药浓度监测在进一步提高晚期胃癌化疗疗效及减少不良反 预测中的作用[J]. 肿瘤,2011,31(10):930-6.] |
| [10] | Di Paolo A, Lencioni M, Amatori F, et al. 5-fluorouracil harmacokinetics predicts disease-free survival in patients dministered adjuvant chemotherapy for colorectal cancer [J]. lin Cancer Res, 2008, 14 (9): 2749-55. |
| [11] | Kuwahara A, Yamamori M, Kadoyama K,et al. Effects of lasma concentrations of 5-fluorouracilon long-term survival fter treatment with a definitive 5-fluorouracil/cisplatin-based hemoradiotherapy in Japanese patients with esophageal quamous cell carcinoma [J]. J Exp Clin Cancer Res, 2011, 30:94. |
 2014, Vol.41
2014, Vol.41