宫颈癌是妇女最常见的恶性肿瘤之一。虽然目 前采用的化疗、手术和放射疗法起到了一定治疗效 果,但这些传统治疗难以根治残留的小病灶或微转 移灶,以至于仍有35%左右的患者因复发或转移而 导致最后死亡[1]。目前认为机体的免疫状态影响 传统治疗效果及预后,因为免疫系统能识别自身抗 原和异己抗原,清除异己抗原,激活的免疫系统发 挥免疫监视作用,持续监测肿瘤细胞状态,及时清 除异常细胞,防止肿瘤复发和转移[2]。近年来有 研究报道低剂量周期化疗有免疫促进作用。另外, 低剂量周期化疗因为其不良反应小,患者耐受性、 依从性好而受到越来越多的关注[3]。但目前未见 顺铂低剂量周期疗法对宫颈癌短期化疗效果、长 期肿瘤再发率以及对机体免疫状态影响的研究, 故本研究通过顺铂低剂量周期疗法和高剂量疗法,探讨两种用药策略对抗肿瘤效应、抗肿瘤免 疫力及肿瘤复发的影响。 1 材料与方法 1.1 材料 1.1.1 细胞株
鼠肺上皮细胞株TC-1,鼠源性的 HPV16阳性的肿瘤细胞株, 广泛用于宫颈癌的动 物实验研究,由霍普金斯大学TC WU教授惠赠。 1.1.2 实验动物
健康近交系C57BL/6小鼠,4~6 周龄, 雌性, 体质量20~30g,购自北京维通利华 公司。按三级动物要求,饲养在无特定病原体环境 中,所用饲料、 饮水及垫料均经高压灭菌处理。 1.1.3 主要试剂
RPMI 1640细胞培养液为美国 Gibco公司产品;顺铂:5毫升/只,Sigma公司产 品,PE-anti-CD8美国BD公司产品,均购自北京拜 尔迪生物技术有限公司;磷酸缓冲液(phosphate buffered solution,PBS)购自北京北方同正生物 技术发展有限公司;红细胞裂解液购自碧云天公 司;FITC-HPV-E7 四聚体(tetramer)由霍普金斯 大学TC WU教授惠赠。 1.1.4 实验仪器
流式细胞仪型号为美国Beckman coulter公司的Epics XL-MCL,数据应用Becton Dickinson 公司Cell Quest软件分析。 1.2 实验方法 1.2.1 肿瘤抑制效应
于C57BL/6小鼠左侧下腹部 注射 1× l 05 TC-1细胞建立肿瘤模型,12 d后下腹部 肿瘤大小约0.5~0.6 cm,小鼠随机分为3组(每组 5只),对照组(PBS联合外科手术组)、顺铂低 剂量组(低剂量顺铂联合外科手术组)、顺铂高剂 量组(高剂量顺铂联合外科手术组)。对照组给予 PBS,50微升/只,腹腔注射,3天1次,共2次;低 剂量顺铂组给予顺铂5 mg/kg,腹腔注射,3天1次, 共2次;高剂量顺铂组给予顺铂10 mg/kg,腹腔注 射,1次。每周两次测量肿瘤的最长径(a)和最短径 (b)至手术切除肿瘤之日。按a·b2/2公式计算肿瘤 体积(V)[4],取各组平均值,绘制肿瘤生长曲线。 1.2.2
小鼠PBMCs的HPV-E7特异性CD8+T细胞检测 按上分组及方案治疗小鼠,用药结束后1周取小鼠尾 静脉血,加入红细胞裂解液2 ml,室温放置2 min以 裂解红细胞,1 600 r/min 离心5 min,弃上清液,再次 加入红细胞裂解液500 μl,室温放置2 min,加入PBS 2 ml,振荡均匀后1 600 r/min离心5 min,弃上清液。 混匀细胞,细胞悬液加入FITC-HPV-E7 四聚体0.5 μl(0.1 μg),抗PE-CD8a 1 μl(0.2 μg),4℃孵育30 min,流 式细胞仪上检测E7 四聚体阳性的CD8+T细胞数量, 应用BD细胞软件分析系统分析数据。 1.2.3 观察肿瘤再发率及小鼠生存率
按上分组及 方案治疗小鼠,用药结束后1周取小鼠尾静脉血后手 术切除肿瘤,2d后,小鼠对侧下腹部接种1×l05 TC-1细 胞,观察肿瘤再发率及小鼠生存率。观察时间至再次 接种TC-1细胞后60天或小鼠自然死亡或小鼠肿瘤直径 达2 cm时(此时处死小鼠,等同于小鼠死亡)。(参照Steve Broomfi eld等[5]的方法,建立小鼠肿瘤再发模型)。 1.3 统计学方法
应用SPSS17.0软件进行统计分析。所有数据 以(x±s)表示,计量资料应用 t 检验和方差分析; 小鼠生存率和生存曲线应用Kaplan-Meier法。P <0.05为差异有统计学意义。 2 结果 2.1 抗肿瘤效应比较
与对照组比较,高剂量和低剂量顺铂组均显示 显著的肿瘤抑制作用(P<0.05),而高剂量与低剂量 顺铂组的抗肿瘤效应差异无统计学意义(P>0.05), 见图1。
 |
图1 对照组、高剂量顺铂组和低剂量顺铂组抗肿瘤效应比较 Figure1 The antitumor effect of in the control group,high dose and low dose cisplatin group |
对照组小鼠肿瘤再发率100%,高剂量组再发 率80%,低剂量组肿瘤再发率20%。低剂量顺铂 组肿瘤再发率显著低于对照组及高剂量顺铂组(P <0.05),对照组与高剂量顺铂组差异无统计学意 义(P>0.05)。3组小鼠的生存率存在差异,低剂量 顺铂组生存率显著高于对照组及高剂量顺铂组(P <0.05),而对照组与高剂量顺铂组差异无统计学意 义(P>0.05),见图2。
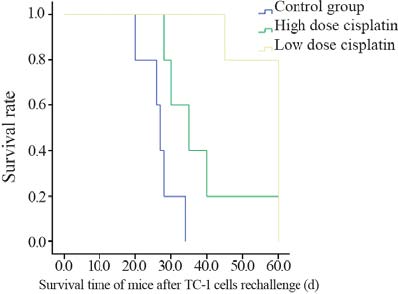 |
图2 对照组、高剂量顺铂组和低剂量顺铂组小鼠生存率比较 Figure2 The survival rate of mice in the control group,high dose and low dose cisplatin group |
与对照组相比,低剂量顺铂组HPV-E7特异性 CD8+T细胞数量显著升高(P<0.05),高剂量顺铂组 稍有降低,但差异无统计学意义(P>0.05),见图3。
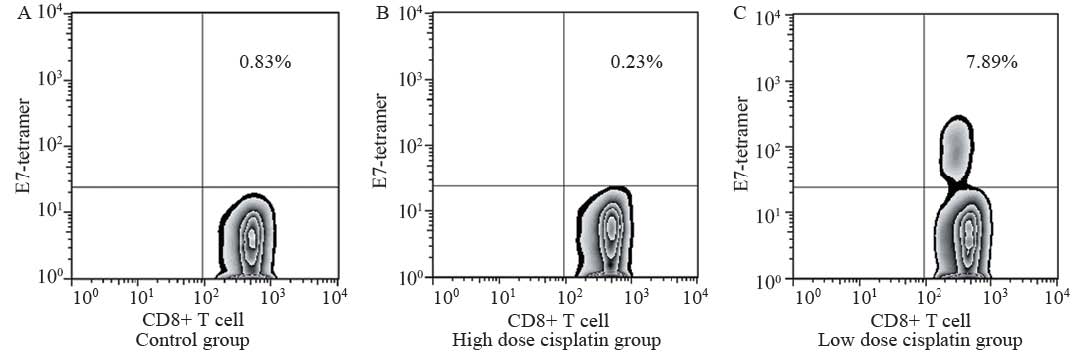 |
图3 对照组、高剂量顺铂组和低剂量顺铂组HPV-E7特异性CD8+T细胞数目比较 Figure3 The number of HPV-E7 specifi c CD8+ T cells in control group,high dose and low dose cisplatin group |
传统化疗方式为最大耐受剂量化疗,大剂量 化疗药物能有效杀灭大多数肿瘤细胞,去除大的 肿瘤病灶,因此短期效果好,有些患者的病灶甚 至消失。但是由于大剂量化疗药物的骨髓抑制作 用,免疫系统不能发挥免疫监视效应,导致肿瘤 最终复发、转移。现在有观念提出低剂量周期化 疗亦能有效杀灭肿瘤细胞,同时还能诱导肿瘤细 胞凋亡,刺激机体产生特异性抗肿瘤免疫应答而 发挥免疫促进作用[6]。Zhong 等[7]报道预先给予低 剂量紫杉醇能调节肿瘤细胞因子网促进树突状细 胞疫苗抗肺癌作用。Hermans 等[8]报道环磷酰胺周 期疗法能有效促进机体肿瘤特异性CD8+T细胞从 而增强免疫治疗的抗肿瘤作用。顺铂为宫颈癌一 线化疗药物,临床应用广泛,但未见顺铂免疫调 节作用及免疫记忆的研究。故本研究拟探讨顺铂不同用药方案,化疗药物本身的免疫调节作用及 其对肿瘤再发的影响,为临床选择适当治疗策略 提供理论依据。
本研究分别给予低剂量和大剂量顺铂,发现 低剂量顺铂与高剂量顺铂短期抗肿瘤效应相似, 但低剂量顺铂组抗HPV-E7特异性CD8+T细胞数目 显著高于对照组和高剂量顺铂组,说明低剂量顺 铂能有效促进肿瘤特异性CD8+细胞数量,促进特 异性抗肿瘤免疫应答。为了研究低剂量顺铂增强 的抗肿瘤免疫力是否具有防止肿瘤再发的作用, 我们把对照组、低剂量和高剂量顺铂组肿瘤切除 后对侧下腹部接种肿瘤细胞,观察不同治疗组肿 瘤的再发率,发现低剂量顺铂组肿瘤再发率最 低,而对照组和高剂量顺铂组再发率均显著高于 低剂量顺铂组。提示低剂量顺铂周期疗法近期能 有效发挥抗肿瘤效应,同时通过刺激机体细胞免 疫,产生免疫记忆,从而发挥免疫监视功能,在 一定程度上抑制肿瘤再发,可能为一种值得提倡 的化疗用药策略,可以在临床推广。
| [1] | Bellone S, El-Sahwi K, Cocco E, et al. Human papillomavirus ype 16(HPV-16)virus-like particle L1-specifi c CD8+cytotoxic lymphocytes(CTLs)are equally effective as E7-specific D8+ CTLs in killing autologous HPV-16-positive tumor cells in ervical cancer patients:implications for L1 dendritic cell-based herapeutic vaccines[J].J Virol,2009,83(13):6779-89. |
| [2] | Gong L, Lou JY, Wang P, et al. Clinical evaluation of neoadjuvant hemotherapy followed by radical surgery in the management of tage IB2-IIB cervical cancer[J]. Int J Gynaecol Obstet, 2012, 17(1):23-6. |
| [3] | Daenen LG,Shaked Y,Man S, et al. Low-dose metronomic yclophosphamide combined with vascular disrupting therapy nduces potent antitumor activity in preclinical human tumor enograft models[J]. Mol Cancer Ther,2009,8(10):2872-81. |
| [4] | Naito S,von Eschenbach AC,Giavazzi R, et al. Growth and etastasis of tumor cells isolated from a human renal cell arcinoma implanted into different organs of nude mice[J]. Cancer es,1986,46(8):4109-15. |
| [5] | Broomfield S,Currie A,van der Most RG,et al. Partial, but not omplete, tumor-debulking surgery promotes protective antitumor emory when combined with chemotherapy and adjuvant mmunotherapy[J]. Cancer Res,2005,65 (17):7580-4. |
| [6] | Chen CA,Ho CM,Chang MC, et al. Metronomic chemotherapy nhances antitumor effects of cancer vaccine by depleting egulatory t lymphocytes and inhibiting tumor angiogenesis[J]. ol Ther,2010,18(6): 1233-43. |
| [7] | Zhong H, Han B, Tourkova IL, et al. Low-dose paclitaxel prior o intratumoral dendritic cell vaccine modulates intratumoral ytokine network and lung cancer growth[J]. Clin Cancer es,2007,13(18 Pt 1): 5455-62. |
| [8] | Hermans IF, Chong TW, Palmowski MJ, et al. Synergistic effect of etronomic dosing of cyclophosphamide combined with specifi c ntitumor immunotherapy in a murine melanoma model [J]. ancer Res,2003,63(23):8408-13. |
 2014, Vol.41
2014, Vol.41


