卵巢癌病因不明,症状隐匿,约70%以上的患 者诊断时已属晚期,5年生存率只有30%,是临床 死亡率最高的妇科肿瘤[1]。近20年来,中国卵巢癌 的发病率和死亡率都有上升趋势[2]。提高卵巢癌的 治疗效果有待于对其发病机制的进一步探讨和新 治疗靶点的寻找。
细胞周期蛋白- 细胞周期蛋白依赖性激酶 (cyclin-cdks)是细胞增殖的主要调节者。肿瘤细 胞,包括卵巢癌细胞常由于细胞周期蛋白调控失常,而具有异常增殖的能力[3]。在哺乳动物中, Cyclin D-cdk4/6是第一个被丝裂原信号激活的激 酶,可使细胞由静息状态进入细胞周期循环,并 在G1/S期的转换过程中发挥重要作用。细胞一旦由 G1期进入S期,就会进行不可逆性的DNA复制和细 胞分裂[4]。在G1/S 期转换中Cyclin E 是另外一个调 节者,但是构成性表达Cyclin E2并不能打破由于 Cyclin D1降解所导致的G1期阻滞[5],可见Cyclin D 是细胞周期循环中一关键分子。
Cyclin D有3个亚型(D1、D2和D3),表达于各 种组织[4]。其异常表达与许多肿瘤有关。在卵巢癌 细胞系A2780中,表达的主要亚型是Cyclin D3。 研究表明Cyclin D3的表达调控主要发生在转录水 平,在本实验中克隆了Cyclin D3的启动子区,并 对其结构和功能进行了分析。 1 材料与方法 1.1 细胞培养
A2780细胞来源于华中科技大学同济医学院 附属同济医院妇科肿瘤中心,培养于含10%胎 牛血清,100 u/ml青霉素和100 μg/ml链霉素的 RPMI1640完全培养液中,在37℃、5%CO2、饱和 湿度下培养,0.25%胰酶消化传代,于对数生长期 收获细胞备用。 1.2 质粒构建
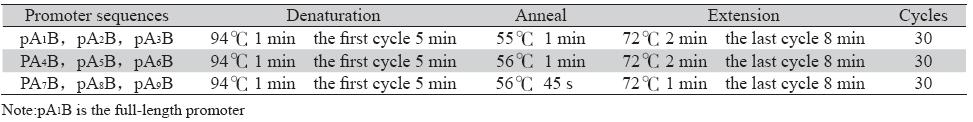
在Genbank中检索人Cyclin D3启动子区全长, 用Webcutter 2.0对其进行酶切位点分析,以正常人 骨髓单个核细胞基因组DNA为模板,用PCR的方 法扩增不同长度的Cyclin D3启动子片段,引物序 列及反应条件见表1,其中pA1B为启动子全长。 正义链(含Kpn Ⅰ酶切位点): PA1 (Kpn Ⅰ -1042): 5'-CGG GGT ACC ggg agg tgg aag aaa tgc- 3';PA2 (Kpn Ⅰ-924): 5'-CGG GGT ACC ggg ctt gtc caa acc tag-3';PA3 (KpnⅠ-764): 5'-CGG GGT ACC gag agt ctg cat ttc taa cc-3';PA4 (KpnⅠ -686): 5'-CGG GGT ACC ggt gta gaa cac aga atc tg-3';PA5 (Kpn Ⅰ-549): 5'-CGG GGT ACC gca gcg ttc act aag aac- 3';PA6 (KpnⅠ-436): 5'-CGG GGT ACC att gtt tcc tgg gtg act ag-3';PA7 (KpnⅠ-380): 5'-CGG GGT ACC aag ttc tct gca ccc ggt gg-3';PA8 (KpnⅠ-262): 5'-CGG GGT ACC gct cag cca acc ctt tcc-3';PA9 (KpnⅠ-195): 5'-CGG GGT ACC att cca cgg ttg cta cat c-3';反义 链(含SmalⅠ酶切位点)PB(~+2)为共用引 物:5'-TCC CCC\GGG ata ctc ggg cag cga aca-3'。 将PCR产物与pGEM-T Easy载体(Promega,USA) 连接,转化大肠杆菌DH5α进行扩增,抽提质粒酶 切与测序鉴定后,将目的质粒用KpnⅠ和BamⅠ酶 切(在Cyclin D 3启动子上游-112 bp 至 -117 bp之 间存在BamⅠ位点),荧光素酶报道载体 pGL3- Basic用KpnⅠ和BglⅡ酶切,(BglⅡ和BamⅠ为同 尾酶,产生的黏性末端可以互补连接),将目的 片段连入pGL3-Basic载体(Promega,USA),转 化大肠杆菌扩增,抽提质粒进行酶切与测序鉴定 (上海博亚生物工程公司),选目的克隆进行质 粒扩增、抽提和纯化,并分别命名为pD3-Δ,Δ表 示起始密码子上游序列位置。
|
|
表1 PCR扩增的反应条件 Table1 Conditions of PCR Amplifi cation |
A2780细胞按4×105/ml密度接种于6孔板,细 胞铺满70%孔底面积时,用Lipofectamine 2000 (Invitrogen,USA),按说明书步骤每孔细胞转 染0.1 ng的pRL-CMV(内参照)和0.8μg的质粒 DNA(pD3-Δ或pGL3-Basic空载体)。在37℃、5% CO2,饱和湿度下培养24 h,用双荧光素酶报告系 统(Promega,USA)和SIRIUS Luminometer V3.1 (Berthlod,Germany),按厂家推荐步骤测量启 动子相对活性,实验重复3次。 1.4 TFSEARCH分析
用TFSEARCH 1.3 v对Cyclin D3启动子主要调控 区进行分析,结合文献筛选出可能的转录因子。 1.5 统计学方法
数据以均数±标准差(x±s)表示,两样本均数比 较用 t 检验, P<0.05认为差异有统计学意义。 2 结果 2.1 Cyclin D3启动子缺失突变体的构建
用PCR的方法,扩增出了9条不同长度的 Cyclin D3启动子片段,并克隆到荧光素酶报道载 体 pGL3-Basic中(pD3-Δ),经酶切和测序鉴定,位置方向及序列无误,见图1。
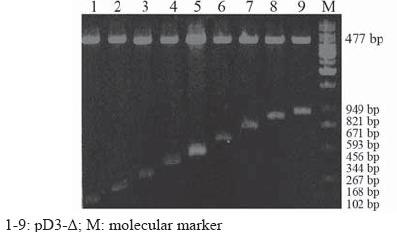 |
图1 pD3-Δ 酶切鉴定结果 Figure1 Identifi cation of pD3-Δ by endonuclease digestion |
A2780细胞瞬时转染pD3-Δ和pGL3-Basic空载 体后,双荧光素酶测定启动子相对活性,见图2。 结果显示pD3-766与pD3-1 044相比,启动子活性 明显降低;与pD3-766相比,pD3-551活性明显升 高;与pD3-362相比;pD3-197活性明显降低。这 说明在-1 044 bp 至 -766 bp之间,以及在-362 bp 至 -197 bp之间分别存在一正性调控区域;在-766 bp 至 -551 bp之间有一负性调控区域。
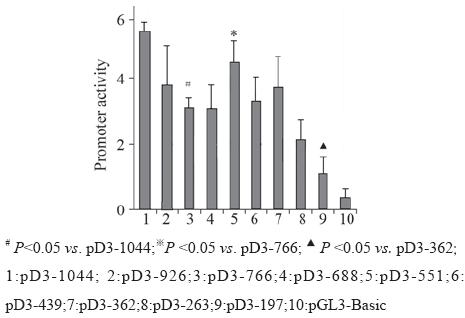 |
图2 Cyclin D3启动子缺失突变体的活性 Figure2 The activity of Cyclin D3 promoter deletion constructs |
用TFSEARCHh 1.3软件在上述主要调控区中 寻找转录因子结合位点。结合文献排除不在人类 及女性组织中表达的因子。在-1 044 bp 至 -766 bp 之间,存在C/EBP 和 AP-1 的结合位点。在-766 bp 至 -551 bp之间存在AP-1的结合位点。在362 bp 至-197 bp 之间存在HSF2、HSF1、c-Ets-、MZF1和Sp1的结合位点,见图3。
 |
图3 Cyclin D3 启动子区及相关转录因子的TFSEARCH分析结果 Figure3 The TFSEARCH analysis of cyclin D3 promoter and related transcription factors |
我们扩增并克隆了不同长度的人Cyclin D3启 动子片段,构建了重组基因表达载体pD3-Δ。并 发现在Cyclin D3启动子-1 044 bp 至 -766 bp之间, 以及在-362 bp至-197 bp之间分别存在一正性调 控区;在-766 bp至-551 bp之间有一负性调控区。 将上述调控区利用TFSEARCH软件进行分析,排 除不能在卵巢组织中表达的转录因子(如:SRY, Ik-2 和 Nkx-2等)。发现在正性调控区-1 044 bp 至 -766 bp之间存在C/EBP和AP-1的结合位点;在负 性调控区-766 bp至-551 bp之间,存在AP-1的结合 位点,但是AP-1通常为一正性调控因子,所以在 此调控区中可能存在未知的转录因子结合位点; 在另外一正性调控区(-362 bp至-197 bp)中,存在 HSF、c-Ets-、MZF1和Sp1的结合位点。C/EBP 又 称CCAAT 增强子结合蛋白。是碱性亮氨酸拉链 蛋白家族成员,与细胞分化有关。也可通过调 节细胞周期蛋白在细胞增殖中发挥重要作用[7]。 AP-1是一种作用广泛的转录因子,与细胞的增殖 分化、生存与凋亡、迁移与转化等密切相关[8]。 HSFs主要在细胞应激、癌变、衰老及发育过程中 发挥调节作用[9]。 MZF1 是SCAN结构域转录因子 家族成员,沉默MZF1基因可以抑制细胞增殖,而 MZF1的异常表达可以导致肿瘤的发生[10]。Sp1是 Sp/SKLF转录因子家族成员,该家族成员活性的增 加是肿瘤发生发展过程中经常而又重要的事件, 与肿瘤的生长、浸润及转移密切相关[11]。
综上所述,在Cyclin D3的启动子区有3段主要 的活性调控区,在这些调控区中,存在转录因子 C/EBP、AP-1、HSF、c-Ets-、MZF1和Sp1的结合 位点,这些转录因子可能通过结合于Cyclin D3启动子区的特异性位点对Cyclin D3的活性发挥调节 作用。这些发现对进一步探索Cyclin D3表达的调 控机制和靶向抑制打下基础。
致谢:衷心感谢武汉同济医院妇科肿瘤实验 室卢运萍老师及陈刚博士的大力帮助。
| [1] | Rosen DG, Yang G, Liu G, et al. Ovarian cancer: pathology, iology, and disease models [J]. Front Biosci, 2009, 14:2089-102. |
| [2] | Zhang SW,Chen WQ,Wei W,et al.Ovary cancer mortality in China 004-2005: results from the third national retrospective sampling urvey of death causes[J].Zhonghua Yu Fang Yi Xue Za Zhi, 010,44(5):418-22.[张思维,陈万青,魏文,等.中国第三次死因抽 调查(2004-2005)卵巢癌死亡情况分析[J].中华预防医学杂 ,2010,44(5):418-22.] |
| [3] | Sherr CJ, Roberts JM. CDK inhibitors: positive and negative egulators of G1-phase progression[J]. Genes Dev, 1999, 3(12):1501-12. |
| [4] | Blain SW. Switching cyclin D-Cdk4 kinase activity on and off [J]. ell Cycle, 2008, 7(7):892-8. |
| [5] | Masamha CP, Benbrook DM. Cyclin D1 degradation is suffi cient o induce G1 cell cycle arrest despite constitutive expression f cyclin E2 in ovarian cancer cells[J]. Cancer Res, 2009, 9(16):6565-72. |
| [6] | Wang Z,Zhang Y,Lu J,et al.Mpl ligand enhances the transcription f the cyclin D3 gene: a potential role for Sp1 transcription actor[J]. Blood, 1999, 93(12):4208-21. |
| [7] | Nerlov C. The C/EBP family of transcription factors: a paradigm or interaction between gene expression and proliferation ontrol[J]. Trends Cell Biol, 2007, 17(7):318-24. |
| [8] | Vesely PW, Staber PB, Hoefl er G, et al. Translational regulation echanisms of AP-1 proteins [J]. Mutat Res, 2009, 682(1):7-12. |
| [9] | Lecomte S, Desmots F, Le Masson F, et al. Roles of heat shock actor 1 and 2 in response to proteasome inhibition: consequence n p53 stability[J]. Oncogene, 2010, 29(29):4216-24. |
| [10] | Mudduluru G, Vajkoczy P, Allgayer H. Myeloid zinc finger 1 nduces migration, invasion, and in vivo metastasis through xl gene expression in solid cancer [J]. Mol Cancer Res, 2010, (2):159-69. |
| [11] | Previdi S, Malek A, Albertini V, et al. Inhibition of Sp1-dependent ranscription and antitumor activity of the new aureolic acid nalogues mithramycin SDK and SK in human ovarian cancer enografts[J]. Gynecol Oncol, 2010, 118(2):182-8. |
 2014, Vol.41
2014, Vol.41