Impact of SLC39A5 Knockout on Establishment of Esophageal Cancer Model Induced by 4-NQO in C57BL/6 Mice
-
摘要:目的
探索敲除SLC39A5基因对4-NQO诱导的C57BL/6小鼠食管癌模型的影响。
方法选取10只C57BL/6野生型小鼠作为阴性对照组,饮用浓度为100 μg/ml的丙二醇空白溶液;选取140只野生型小鼠与80只SLC39A5基因敲除小鼠,采用饮水法摄入诱癌剂,即浓度为100 μg/ml的4-NQO(4-nitroquinoline 1-oxide),实验时间为28周,实验结束后处死三组小鼠。
结果阴性对照组小鼠、野生型小鼠和SLC39A5基因敲除小鼠在实验结束时其存活率分别为100%、92.96%、91.25%;三组小鼠食管癌诱癌成功率分别为0、61.36%、28.77%,两实验组小鼠诱癌成功率差异有统计学意义(χ2=19.98, P < 0.001)。
结论成功建立了C57BL/6小鼠及SLC39A5基因敲除小鼠的食管癌模型,同时验证了SLC39A5基因在食管癌发生发展中的促进作用。
-
关键词:
- 4-硝基喹啉-N-氧化物(4-NQO) /
- 食管癌 /
- SLC39A5基因敲除小鼠 /
- C57BL/6野生型小鼠
Abstract:ObjectiveTo explore the influences of SLC39A5 knockout on the establishment of esophageal cancer model induced by 4-nitroquinoline 1-oxide (4-NQO) in C57BL/6 mice.
MethodsTen wild-type mice were treated as negative control group and drank the 1, 2-propylene glycol at 100 μg/ml; 140 wild-type mice and 80 knockout genotype mice were treated as experimental groups and drank the carcinogen 4-NQO stock solution dissolved in 1, 2-propylene glycol at 100μg/ml, the experimental time was 28 weeks and all three groups' mice were sacrificed.
ResultsThe survival rates were 100%, 92.96% and 91.25% in negative group, wild-type experimental group and SLC39A5 knockout genotype experimental group, respectively; the rates of tumor formation were 0, 61.36% and 28.77%, and there was a statistical difference between the two experimental groups(χ2=19.98, P < 0.001).
ConclusionThe esophageal cancer model in C57BL/6 mice and SLC39A5 knockout mice are established successfully and the facilitated role of SLC39A5 in the occurrence and development of esophageal cancer is verified.
-
0 引言
食管癌是一种常见的恶性肿瘤,其5年生存率仅为20%[1]。据GLOBOCAN数据统计结果显示,2012年世界范围内食管癌发病例数为455 800例,死亡病例为400 200例。世界肿瘤发病数据显示,包括中国在内的东亚为食管癌高发地区[2]。食管癌的组织学类型主要包括鳞癌与腺癌。在我国,鳞癌所占比例高达90%[3]。据国家肿瘤登记中心发布数据显示,2012年全国范围内食管癌发病居全部恶性肿瘤发病率的第五位,死亡率排名第四[4]。我们的前期研究结果显示,河北省作为食管癌高发区,其发病、死亡率一直高于国家平均水平,其中磁县发病率更居世界之首[5-7]。2012年,河北省食管癌的发病率与死亡率均居于恶性肿瘤第四位,其发病例数占全部恶性肿瘤发病的8.06%,而死亡构成比更是高达14.68%[8]。多项研究表明,食管癌的发生是环境因素与遗传因素共同作用的结果[9]。其中环境因素主要包括营养缺乏和不良生活习惯等方面[10-13];遗传方面的病因机制研究结果显示,人体细胞内遗传物质发生改变后,许多抑癌基因失活,促癌基因被激活过表达,从而导致食管癌的发生[14-15]。我们的前期研究发现,SLC39A5基因在食管癌组织中表达异常。与食管正常组织相比,SLC39A5基因在食管癌组织中高表达,建立SLC39A5基因低表达细胞系后研究发现,其增殖、侵袭能力均得到一定程度的抑制[16-17]。
近年来,食管癌的研究已渐渐深入到分子水平,基因敲除技术的应用也得到越来越多的认可,因此许多研究在此基础上对食管癌的病因机制及特定基因的功能进行了探索。其中,多年致力于癌症发病机制方面研究的Louise Fong教授团队在2003年利用p-53基因敲除小鼠探索其与胃癌之间的关系,研究结果显示,小鼠在经过相关基因敲除后,其胃癌的发生、发展速度与野生型小鼠相比均有所上升,这项结果直观地揭示了p-53基因在癌症中的作用[18]。David Feith教授也利用p-53基因敲除小鼠对上消化道癌进行了研究,从而确定了其与上消化道癌之间的关联,即在p-53基因敲除小鼠中上消化道癌发生、发展速度也有所上升[19]。本实验利用诱癌剂4-NQO(4-nitroquinoline 1-oxide)在C57BL/6野生型小鼠及SLC39A5基因敲除小鼠中建立食管癌动物模型,从而进一步验证SLC39A5基因与食管癌的关系,为研究食管癌潜在的靶基因提供实验方法。
1 材料与方法
1.1 实验动物
SLC39A5基因敲除小鼠由浙江大学医学院王福俤教授惠赠,此基因敲除小鼠采用基因打靶法制备,并对基因敲除鼠进行形态观察及分子生物学鉴定,确认基因敲除小鼠缺失SLC39A5活性。本实验在河北医科大学第四医院动物实验中心进行,随机选取新生SLC39A5+/+(C57BL/6野生型,wild-type mice, WT)小鼠150只和SLC39A5-/-(C57BL/6基因敲除型,knockout mice, KO)雄性小鼠80只,动物实验环境为SPF级,饲养环境温度为20℃~22℃,相对湿度为45%~55%,小鼠饮水为保留钙、镁离子的无菌水。实验动物使用许可证[SCXK(京)2012-0001]。
1.2 诱癌剂配制
4-NQO试剂(棕黄色固体,Sigma公司,货号N8141),丙二醇(无色液体,生工生物工程技术服务有限公司,货号A610450)。取0.5 g 4-NQO溶剂溶于100 m1 1, 2-丙二醇中,配制成初浓度为5 mg/ml的液体,放于4℃避光保存备用。使用时用无菌水稀释成终浓度为100 μg/ml的溶液。
丙二醇配制与上述诱癌剂配制方法相同,工作浓度为100 μg/ml。
1.3 实验动物分组及诱癌
将出生后5周的WT小鼠和KO小鼠剪取尾巴根部0.5~1.0 cm组织,利用RT-RCR进行基因型验证。实验小鼠喂养至6周龄,将150只WT小鼠随机分为两组,10只小鼠为阴性对照组,饮用丙二醇空白溶液;140只WT小鼠和80只KO小鼠为两组实验组,均饮用诱癌剂。小鼠饮用的诱癌剂置于避光瓶内,每周更换。每天观察小鼠存活情况与精神状态。实验结束后计算小鼠的存活率和诱癌成功率,存活率=每组存活的小鼠数/各组小鼠总数×100%,诱癌成功率=诱癌成功小鼠数/各组小鼠数×100%。
1.4 实验材料的收集与处理
实验结束后摘取小鼠眼球采集静脉血于抗凝管中,存于-20℃备用。采取脱臼法处死实验小鼠后进行解剖,打开胸腔,迅速取出小鼠食管,观察食管有无癌变,将食管剪开后卷起用一次性采血针头固定,放入4%甲醛溶液中固定,再用酒精脱水二甲苯透明石蜡包埋、切片后进行HE染色,邀请病理科高年资医师进行镜下诊断,统计实验结果。
1.5 统计学方法
数据采用SPSS 21.0软件进行处理,两组小鼠诱癌成功率比较采用卡方检验,P < 0.05为差异有统计学意义。
2 结果
2.1 小鼠基因型鉴定
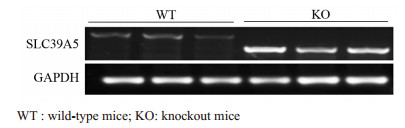
剪取WT小鼠和KO小鼠的尾巴,提取RNA,进行RT-PCR验证。结果证明两种小鼠基因型不同,符合实验要求,见图 1。
2.2 小鼠存活率
本模型实验过程中,由于诱癌剂的作用,实验组WT小鼠和KO小鼠在实验第6周开始均出现死亡,并伴随体质量增长缓慢、毛发无光泽甚至变黄脱落、精神萎靡等状况。第11周时体质量出现下降。直至实验结束,阴性对照组小鼠死亡0只,存活10只,存活率为100%。WT实验组小鼠死亡8只,存活132只,存活率为92.96%;KO实验组小鼠死亡7只,存活73只,存活率为91.25%。
2.3 小鼠诱癌成功率
小鼠食管经过组织包埋、切片及HE染色后研究结果显示,阴性对照组未见食管癌发生。野生型实验组与基因敲除实验组相比诱癌成功率差异有统计学意义,见表 1。
表 1 野生型与SLC39A5基因敲除小鼠诱癌成功率的比较Table 1 Comparison of tumor formation rates between two experimental groups
2.4 小鼠食管大体标本肉眼观察结果
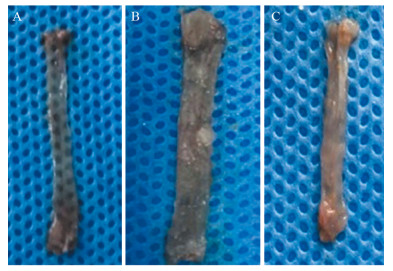
实验结束后解剖小鼠取出食管,纵向剪开平摊,肉眼观察其病变情况。观察发现阴性对照组小鼠食管肉眼未见变化;野生型实验组小鼠食管变粗,绝大部分食管黏膜有菜花样或刺瘤样增生,无明显坏死或出血改变,与周围正常组织分界较清;KO实验组小鼠绝大部分食管黏膜未见增生,但食管变长,见图 2。
2.5 小鼠食管病理组织学表现
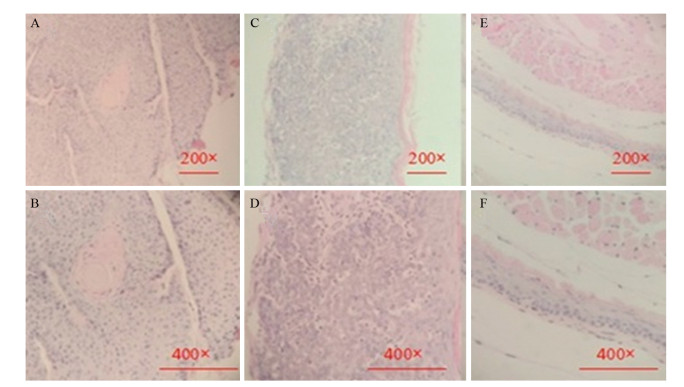
两组实验组小鼠食管组织显微镜下可见病理学变化:癌变细胞出现角质化,并有明显的角化珠,与正常细胞相比异型性明显,体积偏大,形状、排列均不规则;癌细胞内胞质增多,细胞核分裂增多且不规则,癌变细胞间存在细胞间桥,并向肌层浸润。阴性对照组小鼠食管组织镜下表现正常,未见病理学变化,见图 3。
3 讨论
近年来我国食管癌发病率居高不下,且食管癌早期症状不明显,确诊时多为晚期,是一种死亡率较高的恶性肿瘤,给患者带来了极大的疾病负担[20]。因此,迫切需要相关研究阐明食管癌的发病机制,为食管癌的治疗及预防提供依据。
近年来,利用各种诱癌剂诱导食管癌的研究日益增多,旨在建立诱发性食管癌模型,对食管的病因及相关基因的功能进行进一步探索。食管癌诱发模型所用诱癌剂主要为亚硝胺类致癌物,如甲基苄基亚硝胺(methyl-benzyl-nitrosamine, MBNA),MBNA诱导的动物食管癌模型在组织学上与人食管癌相似,所以对研究食管癌的癌变机制及化学预防非常有价值[21]。但由于相关法律的规定,亚硝胺类化学药物不再用于动物实验,此后多项实验利用4-硝基喹啉-N-氧化物(4-NQO)进行小鼠食管癌的诱导。4-NQO是一种水溶性的喹啉衍生物,在体内,4-NQO主要在还原酶的刺激下发挥作用,通过损伤DNA而产生癌变。因4-NQO还原酶在食管分布较多,故食管成为4-NQO的主要靶器官之一[22],由此构建动物食管癌模型。据报道,2004年Tang等利用4-NQO建立的小鼠舌癌与食管癌模型,研究结果显示,应用4-NQO饮水法建立食管鳞癌模型方法简单、结果稳定[23]。除此之外,食管癌模型的建立还可利用移植的方法进行,主要包括异位移植与同位移植[24],且移植性模型的制备方法简单、成瘤快、成瘤率高、成本低,是目前常用的食管癌动物模型[25]。经研究报道,小鼠的遗传学背景资料最为充分,基因组的测定证实小鼠与人类在基因水平上高度同源[26]。因此,与食管癌移植性模型相比,诱发性模型模拟了人食管癌发生发展的过程,能很好地进行分子生物学水平癌变机制及其形态学的研究[27],且移植性肿瘤细胞在接种后由于缺乏肿瘤微环境,形成的肿瘤与接种母体具有同质性,丢失了原代肿瘤的分子特性,不能客观地反映原代肿瘤的情况[26]。
基因敲除技术是20世纪80年代发展起来的一门新技术,其中基因敲除小鼠模型的建立与应用阐明了许多与人类疾病相关基因的功能,使现代生物学及医学研究取得了突破性的进展[28]。因此,许多研究在此基础上联合基因敲除技术进行癌症方面的研究。研究发现,Tp53基因作为肿瘤抑制基因,在多种癌症中灭活或发生突变,因此认为p53基因的改变对癌症的发生发展起到了重要的作用[29]。结合基因敲除技术,Fong教授利用p-53基因敲除小鼠与野生型小鼠诱发上消化道癌症,结果发现诱癌21周后不同实验组小鼠均出现不典型增生或癌变,但与野生型小鼠相比,p-53基因敲除小鼠形成癌变的速率更快[30]。Zhang等利用p-53基因敲除小鼠进行了包括口腔在内的上消化道癌症的研究,结果同样发现,不同部位的p-53基因敲除小鼠的诱癌成功率均高于野生型小鼠[31]。崔智等利用二乙基亚硝胺(diethylnitrosamine, DEN)进行PLCE基因敲除小鼠肝癌模型的建立,研究结果发现,相同诱癌时间和条件下,PLCE基因敲除小鼠比野生型小鼠的成癌率高[32]。Nishikaw等发现同样的结果也出现在食管癌和膀胱癌中[33]。因此,与移植性模型相比,这些研究结果均直观明了地解释了相关基因在各种癌症中发挥的作用,对癌症发病机制的探索更为直接有效。
锌是人体内生长发育必需的微量元素之一,能参与多种体内代谢过程,其中包括DNA合成、细胞分裂等活动[34]。研究结果显示,锌不能自由穿过细胞膜,需要锌离子转运体的帮助[35]。锌离子转运家族主要包括两类成员,一个是ZnT蛋白家族,即溶质结合转运体(solute-linked carrier, SLC30)蛋白家族;另一个是ZIP(Zrt-and Irt-like proteins)家族,即溶质结合转运体(solute-linked carrier, SLC39)蛋白家族,主要功能是负责将细胞外和细胞器中的锌及其他金属元素转运到胞质内,以便维持胞内外锌离子的稳态[36]。近年来,锌离子转运体与癌症的关联研究得到了越来越多的关注。Chen等利用前列腺癌组织研究锌离子转运体ZIP4的表达情况,结果发现,ZIP4在前列腺癌组织中表达下调,并且有降低癌细胞增殖和侵袭能力的作用[37]。Wu等研究发现,ZIP11基因的变异使肾癌的发病危险增加(OR=1.28, 95%CI: 1.13~1.45),提示ZIP11基因可能在肾癌的发生发展机制中起一定作用[38]。以上研究结果均提示,人体内锌转运体的异常表达或与癌症的发生发展存在一定联系。
本实验结果显示SLC39A5基因敲除小鼠的诱癌成功率要低于野生型实验组,提示SLC39A5基因对食管癌的发生发展有一定的影响。该结果与我们的前期细胞、裸鼠移植瘤研究结果一致。由此,据该模型结合前期研究结果可以得出,与食管正常组织相比,食管癌组织中SLC39A5表达降低,同时发现,食管癌细胞中的COX-2、CyclinD1的表达下调,E-cadherin的表达上调,此时,食管癌细胞的增殖、侵袭和迁移能力均有所下降[16]。裸鼠移植瘤实验结果与上述结果一致[17],当机体内SLC39A5基因水平发生改变时,4-NQO对食管的致癌程度不同,并通过上述机制改变了不同通路中基因的表达水平,从而导致癌症细胞的增殖和迁移侵袭能力发生变化,因此食管癌的诱癌成功率在两组小鼠中不同。
本模型中所用基因敲除小鼠因本身缺陷导致体质下降,实验中伤亡率高,故而采用杂交的方法增强小鼠体质,虽方法繁琐,但效果显著。本模型实验时间为28周,由于实验时间及致癌剂本身的致癌效率所限,实验结束时诱癌成功率不高,在此我们提议,在保证存活率的基础上可适当延长实验时间,以便4-NQO在体内不断诱导DNA的损伤,累积到一定程度后发生癌变,从而获得更高的成癌率,对敲除基因与食管癌的关联做更为深入的研究。
-
表 1 野生型与SLC39A5基因敲除小鼠诱癌成功率的比较
Table 1 Comparison of tumor formation rates between two experimental groups

-
[1] Allemani C, Weir HK, Carreira H, et al. Global surveillance of cancer survival 1995-2009: analysis of individual data for 25, 676, 887 patients from 279 population-based registries in 67 countries (CONCORD-2)[J]. Lancet, 2015, 385(9972): 977-1010. doi: 10.1016/S0140-6736(14)62038-9
[2] Torre LA, Siegel RL, Ward EM, et al. Global Cancer Incidence and Mortality Rates and Trends-An Update[J]. Cancer Epidemiol Biomarkers Prev, 2016, 25(1): 16-27. doi: 10.1158/1055-9965.EPI-15-0578
[3] 李玉林. 肿瘤[M]//李玉林. 病理学. 6版. 北京: 人民卫生出版社, 2004: 213-4. Li YL. Tumor[M]//Li YL. Pathology. 6th. Beijing: People's Medical Publishing House, 2004: 213-4.
[4] Chen W, Zheng R, Zeng H, et al. The incidence and mortality of major cancers in China, 2012[J]. Chin J Cancer, 2016, 35(1): 73. doi: 10.1186/s40880-016-0137-8
[5] He YT, Hou J, Chen ZF, et al. Trends in incidence of esophageal and gastric cardia cancer in high-risk areas in China[J]. Eur J Cancer Prev, 2008, 17(2): 71-6. doi: 10.1097/CEJ.0b013e3282b6fd97
[6] Li M, Li ZS, Chen ZF, et al. Mortality report of malignant tumors in SheXian, Hebei Province, China, from the 1970's to the present[J]. Asian Pac J Cancer Prev, 2004, 5(4): 414-8. https://www.wjgnet.com/1007-9327/full/v12/i1/17.htm
[7] 宋国慧, 李东方, 孟凡书, 等.磁县2003—2012年上消化道癌发病率分析[J].肿瘤防治研究, 2016, 43(10): 887-93. doi: 10.3971/j.issn.1000-8578.2016.10.012 Song GH, Li DF, Meng FS, et al. Upper gastrointestinal carcinomas incidence from 2003 to 2012 in cixian, hebei province[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(10): 887-93. doi: 10.3971/j.issn.1000-8578.2016.10.012
[8] He Y, Liang D, Li D, et al. Estimated cancer incidence and mortality in Hebei province, 2012[J]. Chin J Cancer Res, 2016, 28(3): 286-300. doi: 10.21147/j.issn.1000-9604.2016.03.03
[9] 钟钏.食管癌流行病学病因学研究进展[J].河南预防医学杂志, 2011, 22(1): 1-10, 17. http://d.wanfangdata.com.cn/Periodical_hnyfyxzz201101001.aspx Zhang C. The research progress of esophageal cancer epidemiology and etiology[J]. HenanYu Fang Yi Xue Za Zhi, 2011, 22(1): 1-10, 17. http://d.wanfangdata.com.cn/Periodical_hnyfyxzz201101001.aspx
[10] Rasool S, A Ganai B, Syed Sameer A, et al. Esophageal cancer: associated factors with special reference to the Kashmir Valley[J]. Tumori, 2012, 98(2): 191-203. doi: 10.1177/030089161209800203
[11] Wu M, Liu AM, Kampman E, et al. Green tea drinking, high tea temperature and esophageal cancer in high-and low-risk areas of Jiangsu Province, China: a population-based case-control study[J]. Int J Cancer, 2009, 124(8): 1907-13. doi: 10.1002/ijc.v124:8
[12] He Y, Jin J, Wang L, et al. Evaluation of miR-21 and miR-375 as prognostic biomarkers in oesophageal cancer in high-risk areas in China[J]. Clin Exp Metastasis, 2017, 34(1): 73-84. doi: 10.1007/s10585-016-9828-4
[13] Yong F, Xudong N, Lijie T. Human papillomavirus types 16 and 18 in esophagus squamous cell carcinoma: a meta-analysis[J]. Ann Epidemiol, 2013, 23(11): 726-34. doi: 10.1016/j.annepidem.2013.07.002
[14] Zheng H, Wang Y, Tang C, et al. TP53, PIK3CA, FBXW7 and KRAS Mutations in Esophageal Cancer Identified by Targeted Sequencing[J]. Cancer Genomics Proteomics, 2016, 13(3): 231-8. http://www.ncbi.nlm.nih.gov/pubmed/27107065
[15] Ping FM, Liu GJ, Liu ZJ, et al. Expression of RKIP, E-cadherin and NF-kB p65 in esophageal squamous cell carcinoma and their correlations[J]. Int J Clin Exp Pathol, 2015, 8(9): 10164-70. http://www.ijcep.com/files/ijcep0013203.pdf
[16] Jin J, Li Z, Liu J, et al. Knockdown of zinc transporter ZIP5(SLC39A5) expression significantly inhibits human esophageal cancer progression[J]. Oncol Rep, 2015, 34(3): 1431-9. doi: 10.3892/or.2015.4097
[17] Li Q, Jin J, Liu J, et al. Knockdown of Zinc Transporter ZIP5 by RNA Interference Inhibits Esophageal Cancer Growth in vivo[J]. Oncol Res, 2016, 24(3): 205-14. doi: 10.3727/096504016X14648701447896
[18] Fong LY, Ishii H, Nguyen VT, et al. p53 deficiency accelerates induction and progression of esophageal and forestomach tumors in zinc-deficient mice[J]. Cancer Res, 2003, 63(1): 186-95. https://sapienza.pure.elsevier.com/it/publications/p53-deficiency-accelerates-induction-and-progression-of-esophagea-4
[19] Feith DJ, Pegg AE, Fong LY. Targeted expression of ornithine decarboxylase antizyme prevents upper aerodigestive tract carcinogenesis in p53-deficient mice[J]. Carcinogenesis, 2013, 34(3): 570-6. doi: 10.1093/carcin/bgs377
[20] Di Pardo BJ, Bronson NW, Diggs BS, et al. The Global Burden of Esophageal Cancer: A Disability-Adjusted Life-Year Approach[J]. World J Surg, 2016, 40(2): 395-401. doi: 10.1007/s00268-015-3356-2
[21] 张林西, 齐凤英, 左连富.食管癌动物模型的研究和应用进展[J].临床与实验病理学杂志, 2002, 18(4): 421-3. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=lsbl200204028&dbname=CJFD&dbcode=CJFQ Zhang LX, Qi FY, Zuo LF. Advances in Research and Application of Animal Models of Esophageal Carcinoma[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi, 2002, 18(4): 421-3. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=lsbl200204028&dbname=CJFD&dbcode=CJFQ
[22] Booth DR. A relationship found between intra-oral sites of 4NQO reductase activity and chemical carcinogenesis[J]. Cell Tissue Kinet, 1990, 23(4): 331-40. https://www.researchgate.net/publication/21038029_A_relationship_found_between_intra-oral_site_of_4NQO_reductase_activity_and_chemical_carcinogenesis
[23] Tang XH, Knudsen B, Bemis D, et al. Oral cavity and esophageal carcinogenesis modeled in carcinogen-treated mice[J]. Clin Cancer Res, 2004, 10(1 Pt 1): 301-13. https://www.researchgate.net/publication/8911397_Oral_Cavity_and_Esophageal_Carcinogenesis_Modeled_in_Carcinogen-Treated_Mice
[24] 谢仰民, 谢良喜, 李德锐, 等.食管癌SCID小鼠异位移植模型建立的初步探讨[J].实验动物与比较医学, 2007, 27(1): 41-4. http://d.wanfangdata.com.cn/Thesis/Y1243408 Xie YM, Xie LX, Li DR, et al. Preliminary Study on Establishment of Ectopic Transplantation Model of Esophageal Carcinoma in SCID Mice[J]. Shi Yan Dong Wu Yu Bi Jiao Yi Xue, 2007, 27(1): 41-4. http://d.wanfangdata.com.cn/Thesis/Y1243408
[25] 郭凯, 孟志宏, 胡哲一, 等.食管癌原位模型的建立[J].肿瘤基础与临床, 2014, 27(5): 380-2. http://www.cnki.com.cn/Article/CJFDTOTAL-HLZL201405005.htm Guo K, Meng ZH, Hu ZY, et al. Establishment of a Mouse Model with Orthotopic Esophageal Cancer[J]. Journal of Basic and Clinical Oncology, 2014, 27(5): 380-2. http://www.cnki.com.cn/Article/CJFDTOTAL-HLZL201405005.htm
[26] 陈金东.肾癌敲基因小鼠模型建立及应用的研究进展[J].遵义医学院学报, 2017, 40(4): 347-57. http://www.doc88.com/p-9252886809574.html Chen JD. Advances in development and application of knockout mouse models of kidney cancer[J]. Zunyi Yi Xue Yuan Xue Bao, 2017, 40(4): 347-57. http://www.doc88.com/p-9252886809574.html
[27] 马伟, 王凯, 程玉峰.食管癌小鼠模型研究进展[J].国际肿瘤学杂志, 2013, 40(12): 915-8. doi: 10.3760/cma.j.issn.1673-422X.2013.12.011 Ma W, Wang W, Cheng YF. Research progress of esophageal cancer mouse models[J]. Guo Ji Zhong Liu Xue Za Zhi, 2013, 40(12): 915-8. doi: 10.3760/cma.j.issn.1673-422X.2013.12.011
[28] 刘雪静, 王欢, 严放, 等.大中型动物基因敲除技术的研究进展[J].生理科学进展, 2015, 46(1): 11-6. https://www.wenkuxiazai.com/doc/5dc80176f121dd36a22d82b3.html Liu XJ, Wang H, Yan F, et al. The Development of Gene Knockout Technologies in Large and Medium Animal Models[J]. Sheng Li Ke Xue Jin Zhan, 2015, 46(1): 11-6. https://www.wenkuxiazai.com/doc/5dc80176f121dd36a22d82b3.html
[29] Ali A, Bhatti MZ, Shah AS, et al. Tumor-suppressive p53 Signaling Empowers Metastatic Inhibitor KLF17-dependent Transcription to Overcome Tumorigenesis in Non-small Cell Lung Cancer[J]. J Biol Chem, 2015, 290(35): 21336-51. doi: 10.1074/jbc.M114.635730
[30] Fong LY, Jiang Y, Farber JL. Zinc deficiency potentiates induction and progression of lingual and esophageal tumors in p53-deficient mice[J]. Carcinogenesis, 2006, 27(7): 1489-96. doi: 10.1093/carcin/bgl012
[31] Zhang Z, Wang Y, Yao R, et al. p53 Transgenic mice are highly susceptible to 4-nitroquinoline-1-oxide-induced oral cancer[J]. Mol Cancer Res, 2006, 4(6): 401-10. doi: 10.1158/1541-7786.MCR-06-0028
[32] 崔智, 李瑞生, 李晓娟, 等. DEN诱发PLCε基因敲除小鼠肝癌模型的建立[J].中国比较医学杂志, 2013, 23(3): 17-20. http://www.wenkuxiazai.com/doc/86049e2c31b765ce0508146f.html Cui Z, Li RS, Li XJ, et al. Establishment of DEN induced PLCε knock-out mouse liver cancer model[J]. Zhongguo Bi Jiao Yi Xue, 2013, 23(3): 17-20. http://www.wenkuxiazai.com/doc/86049e2c31b765ce0508146f.html
[33] Nishikawa T, Salim EI, Morimura K, et al. High susceptibility of p53 knockout mice to esophageal and urinary bladder carcinogenesis induced by N, N-dibutylnitrosamine[J]. Cancer Lett, 2003, 194(1): 45-54. doi: 10.1016/S0304-3835(03)00057-0
[34] Wu X, Tang J, Xie M. Serum and hair zinc levels in breast cancer: a meta-analysis[J]. Sci Rep, 2015, 5: 12249. doi: 10.1038/srep12249
[35] Pan Z, Choi S, Ouadid-Ahidouch H, et al. Zinc transporters and dysregulated channels in cancers[J]. Front Biosci (Landmark Ed), 2017, 22: 623-43. doi: 10.2741/4507
[36] Guerinot ML. The ZIP family of metal transporters[J]. Biochim Biophys Acta, 2000, 1465(1-2): 190-8. doi: 10.1016/S0005-2736(00)00138-3
[37] Chen QG, Zhang Z, Yang Q, et al. The role of zinc transporter ZIP4 in prostate carcinoma[J]. Urol Oncol, 2012, 30(6): 906-11. doi: 10.1016/j.urolonc.2010.11.010
[38] Wu L, Chaffee KG, Parker AS, et al. Zinc transporter genes and urological cancers: integrated analysis suggests a role for ZIP11 in bladder cancer[J]. Tumour Biol, 2015, 36(10): 7431-7. doi: 10.1007/s13277-015-3459-2



 下载:
下载: