Relationship Between High-Density Lipoprotein Cholesterol and Colorectal Cancer—A Mendelian Randomization Study
-
摘要:目的
通过孟德尔随机化方法阐明高密度脂蛋白胆固醇(HDL-C)与结直肠癌(CRC)之间的因果关系。
方法使用全基因组关联研究数据集筛选遗传工具变量进行孟德尔随机化分析。主要包括五种方法:逆方差加权法、孟德尔随机化Egger法、加权中位数法、简单模式法以及加权模式法,其中逆方差加权法作为主要分析方法。敏感性分析验证结果的稳健性。
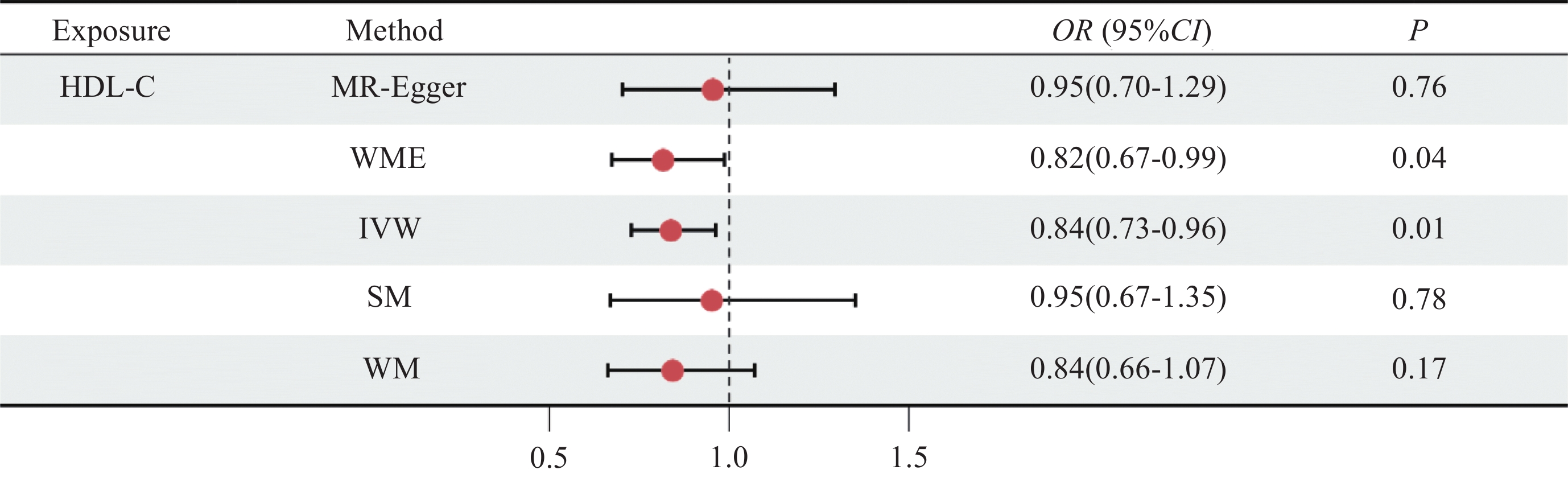
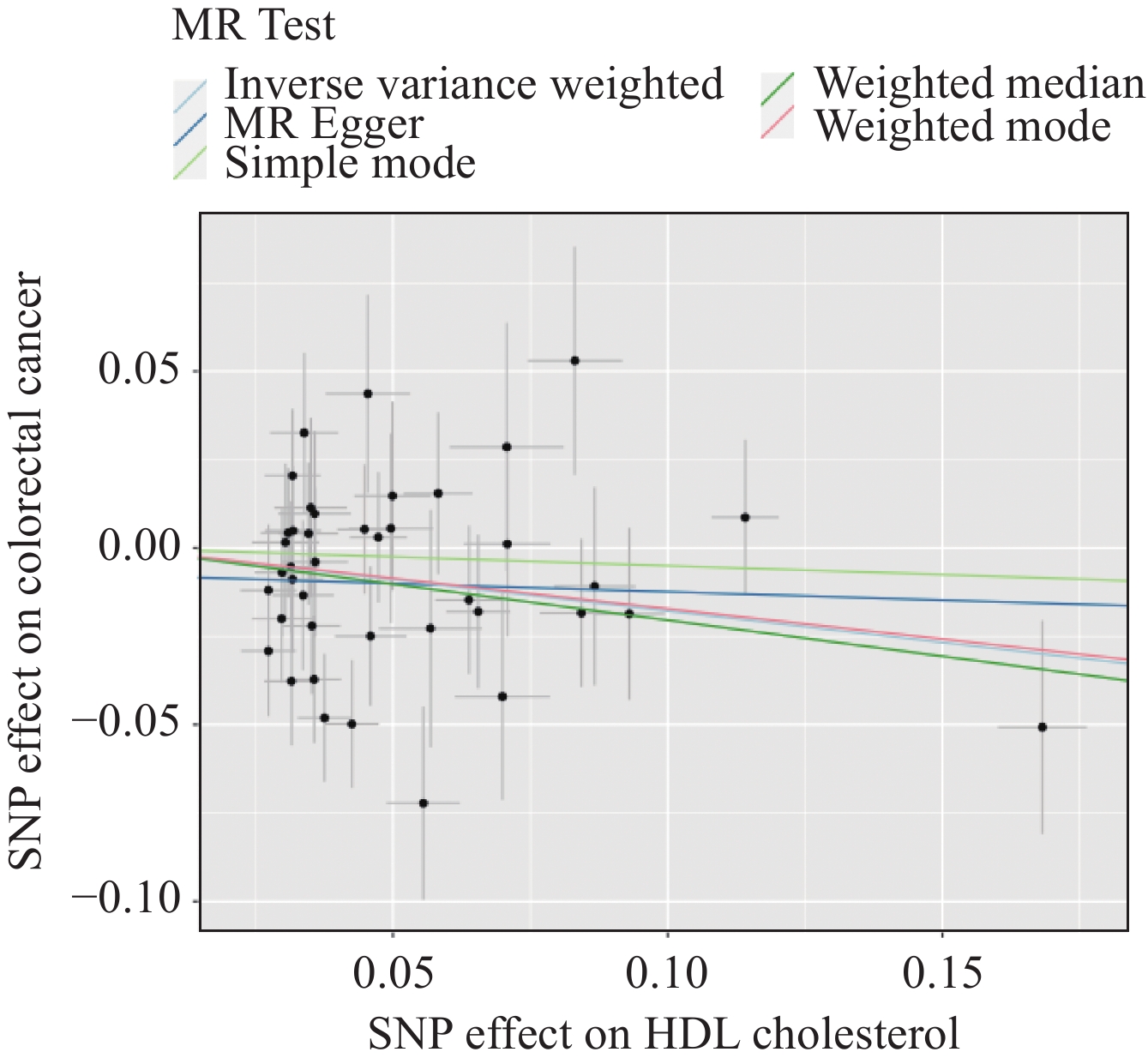
结果最终确定了41个与HDL-C相关的遗传工具变量。逆方差加权法(OR=0.84,95%CI:0.73~0.96,P=0.01)与加权中位数法(OR=0.82,95%CI:0.67~0.99,P=0.04)结果均表明遗传决定的HDL-C与CRC风险呈负相关。敏感性分析证明结果不存在异质性和水平多效性(P>0.05)。
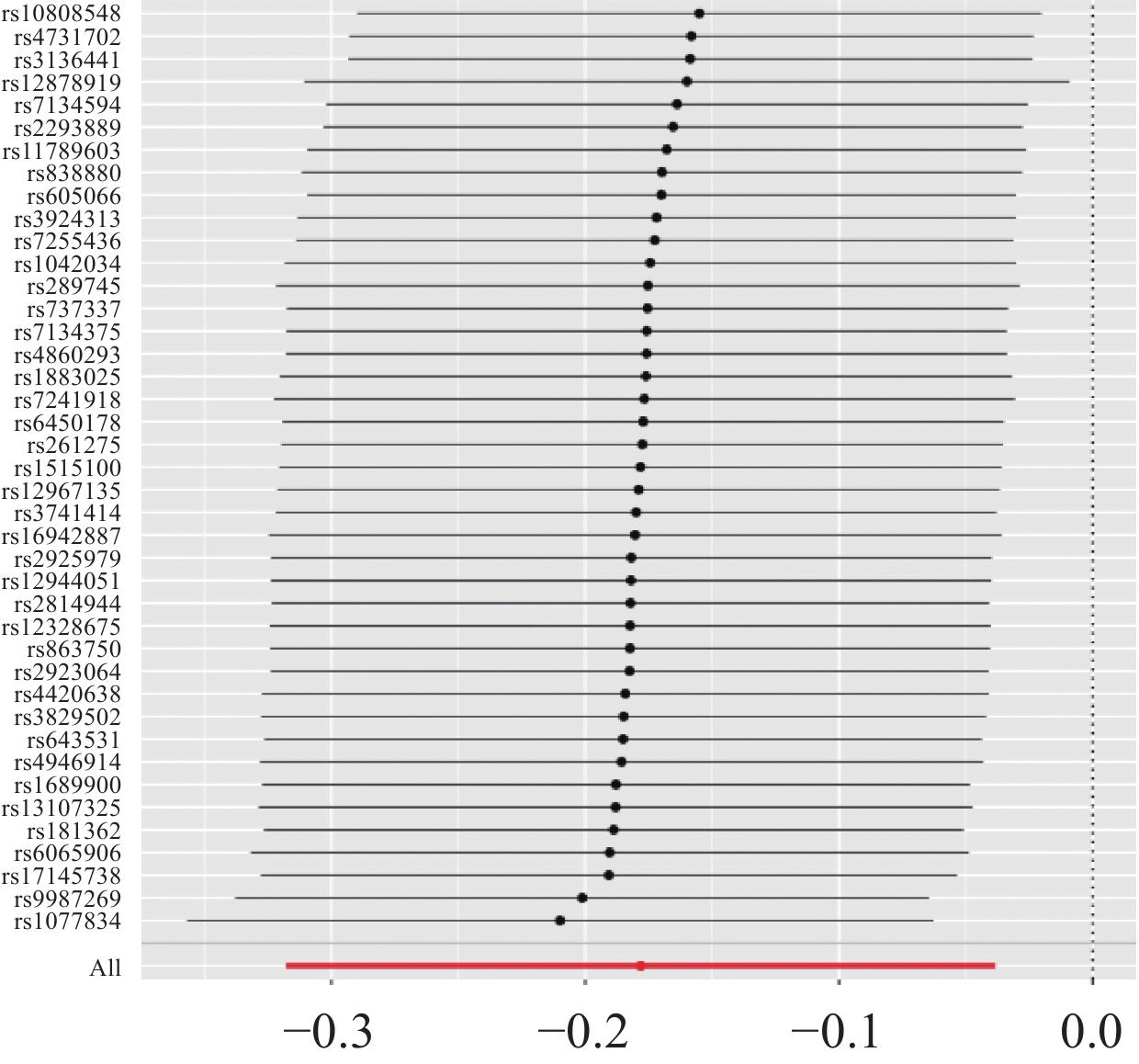
结论HDL-C与CRC风险存在因果关系,rs1077834可能是HDL-C影响CRC风险的关键所在。
Abstract:ObjectiveTo elucidate the causal relationship between high-density lipoprotein cholesterol (HDL-C) and colorectal cancer (CRC) through Mendelian randomization.
MethodsMendelian randomization analysis was conducted using genetic instrumental variables selected from a genome-wide association study dataset. The main methods included inverse variance weighted, MR-Egger, weighted median, simple mode, and weighted mode method; among which, inverse variance weighted method served as the primary analytical approach. Sensitivity analyses were performed to verify the robustness of results.
ResultsA total of 41 genetic instrumental variables associated with HDL-C were identified. Inverse variance weighted method (OR=0.84, 95%CI: 0.73-0.96, P=0.01) and weighted median method (OR=0.82, 95%CI: 0.67-0.99, P=0.04) indicated a negative correlation between genetically-determined HDL-C and CRC risk. Sensitivity analyses confirmed the absence of heterogeneity and horizontal pleiotropy (P>0.05).
ConclusionA causal relationship exists between HDL-C and CRC risk, with rs1077834 as a potential key determinant in the influence of HDL-C on CRC risk.
-
0 引言
肺癌是我国常见恶性肿瘤之一,严重威胁着人民群众的生命健康,其中85%为非小细胞肺癌(non-small cell lung cancer, NSCLC)[1]。尽管手术切除、局部消融、血管介入及分子靶向治疗在肺癌的治疗中已取得飞速发展,但总体上肺癌患者仍然预后不良。因此研究NSCLC发生及发展的分子机制,为临床寻找新的治疗方法有着重要的意义。
FUN14结构域包含体蛋白(FUN14 domain-containing protein 1, FUNDC1)作为线粒体受体家族中的最重要成员之一[2],由155个氨基酸组成,隶属于FUN14家族,在人类染色体上定位于X染色体1区1亚区3带,FUNDC1的蛋白质序列从果蝇到人类高度保守[3-4]。有学者认为,FUNDC1作为一个完整的线粒体膜蛋白,在线粒体自噬的过程中扮演了受体的角色[5]。FUNDC1的异常表达能够影响到线粒体正常的自噬调节,从而影响肿瘤细胞的能量代谢,最终调控肿瘤的发生[6]。
目前,关于FUNDC1的蛋白表达在线粒体自噬以及肿瘤方面的基础研究较多,而其与患者临床病理特征以及预后的相关性研究报道较少。本研究旨在探讨其与NSCLC的相关性,明确其对NSCLC的预后分析是否有一定的指导价值。
1 资料与方法
1.1 生物信息学分析
使用TCGA(The Cancer Genome Atlas Program, TCGA)数据库的所有肺腺癌和肺鳞状细胞癌样本的RNA-seq v2数据,共纳入肺腺癌579例和肺鳞状细胞癌553例。
1.2 临床资料
收集2012年6月—2017年9月在江苏省靖江市人民医院行根治手术并经病理确诊为NSCLC患者的石蜡切片样本(癌旁正常组织和癌组织),共68例,其中男49例,女19例, > 60岁43例,≤60岁25例,患者平均年龄(64.3±10.9)岁。
纳入标准:(1)经病理学证实为非小细胞肺癌;(2)所有患者化疗前未接受过任何抗肿瘤治疗;(3)年龄18~70岁,Karnofsky评分≥70分,预计生存期 > 3月;(4)至少有一个经影像学证实的可测量病灶;(5)血常规、肝肾功能、心电图均正常,无化疗禁忌证。患者的死亡原因均与非小细胞肺癌密切相关。所有患者均签署知情同意书。并经江苏省靖江市人民医院伦理委员会批准。
排除标准:(1)年龄 > 85岁、或合并有严重心脑血管并发症不能手术患者;(2)合并其他器官恶性肿瘤患者;(3)术前接受放疗、化疗或其他针对肿瘤治疗的患者;(4)依存性差不能配合随访的患者。
1.3 免疫组织化学检测
标本经过福尔马林固定、脱水、包埋,4 μm连续切片,应用MaxVision法进行免疫组织化学分析。兔抗人FUNDC1单克隆抗体购自美国Epitomics公司,通用免疫组织化学MaxVision试剂盒和DAB显色试剂购自福州迈新生物技术开发有限公司。FUNDC1抗体工作浓度为1:50,具体染色步骤严格按照试剂盒说明书进行操作。
1.4 免疫组织化学结果判定
参考近期国外文献[7-8]方法,观察FUNDC1蛋白的分布、阳性强度和阳性表达情况。免疫组织化学结果判断采用双盲法,由两位资深病理科医师对组织芯片上每个芯片的染色结果进行评价。在高倍显微镜下(×400)分别对每个位点计数100个细胞,每个组织选取400个,按操作规范分别记录染色阳性细胞密度及抗体染色的强度。如果遇到各代表位点染色差异较大,则另取该例标本的常规切片观察。FUNDC1蛋白定位于细胞胞质,呈棕黄色颗粒状为阳性。根据染色阳性非小细胞肺癌细胞数目所占百分比来统计:没有发现肿瘤细胞为0分,1%~25%为1分, > 25%~50%为2分, > 50%~75%为3分, > 75%~100%为4分。染色强度按肿瘤细胞着色的深浅计分:阴性为0分,弱阳性为1分,强阳性为2分。最后依据染色强度和阳性细胞数目百分比的乘积(4分以上为高表达),得出每例标本的得分,0~3分为阴性,4~8分为阳性。
1.5 统计学方法
统计分析使用SPSS22.0软件,NSCLC患者的存活时间与线粒体受体(DRP1、BNIP3、FUNDC1、NIX、RHEB、LC3、OPA1、MFN1)的分析采用Kaplan-Meier曲线法,用Log rank检验生存率,P < 0.05为差异有统计学意义。对于连续型的变量采用双侧t检验来确定差异是否具有统计学意义。肺癌患者的临床特征相关的指标分析采用χ2检验;P < 0.05为差异有统计学意义。多因素回归分析来确定非小细胞肺癌的独立危险因子。
2 结果
2.1 基于TCGA数据库分析正常组织与非小细胞肺癌组织中线粒体受体表达差异
与正常组织相比,非小细胞肺癌组织FUNDC1的表达明显上调(P < 0.05),差异有统计学意义,见图 1,而其余线粒体受体(DRP1、BNIP3、NIX、RHEB、LC3、OPA1、MFN1)的表达在两组之间未见明显差异(图请扫描本文OSID码)。
非小细胞肺癌组织中FUNDC1表达与患者的总生存期(OS)和无复发生存期(RFS)均相关(P=0.047, P=0.048);FUNDC1低表达者OS和RFS均优于高表达者,见图 2。而其他线粒体受体蛋白表达与预后之间无明显相关性(均P>0.05)(图请扫描本文OSID码)。
2.2 FUNDC1在非小细胞肺癌患者组织中的表达
免疫组织化学染色结果显示,FUNDC1在非小细胞肺癌组织中广泛表达,主要定位于细胞质;再利用Image-Pro Plus软件对免疫组织化学结果进行相对定量,结果显示FUNDC1表达在非小细胞肺癌组织中明显高于正常组织,两组比较差异有统计学意义(P < 0.05),见图 3。
2.3 FUNDC1的表达与NSCLC患者临床病理特征的关系
根据免疫组织化学结果分为FUNDC1低表达组28例(41.2%)和高表达组40例(58.8%)。非小细胞肺癌组织中FUNDC1表达与患者区域淋巴结转移和分化程度明显相关(均P < 0.05),与患者的年龄、性别、病理分型、远处转移、TNM分期均无相关性(均P > 0.05),见表 1。
表 1 68例非小细胞肺癌患者组织中FUNDC1的表达与患者临床病理特征的关系Table 1 Relation between FUNDC1 expression and clinicopathological characteristics of 68 NSCLC patients
Cox回归分析显示,年龄、性别、病理分型、远处转移、TNM分期不能作为预测患者预后的独立危险因子,FUNDC1蛋白表达、区域淋巴结转移、病理分化程度是非小细胞肺癌患者的独立预后因子,见表 2。
表 2 非小细胞肺癌中潜在预后因素的Cox回归分析Table 2 Cox regression analysis of potential prognostic factors for NSCLC
2.4 68例非小细胞肺癌患者组织中FUNDC1的表达与患者预后的关系
Kaplan-Meier生存分析显示,40例FUNDC1高表达组中的非小细胞肺癌患者有16例发生疾病进展,中位PFS为4.5月;而28例低表达组中仅有5例出现了疾病进展,中位PFS为19月;FUNDC1低表达者PFS均优于高表达者,差异有统计学意义(P < 0.01)。40例FUNDC1高表达组中的非小细胞肺癌患者有33例疾病死亡,中位OS为23.5月;而28例低表达组中仅有13例出现了疾病死亡,中位OS为41.5月;FUNDC1低表达者OS均优于高表达者,差异有统计学意义(P < 0.01),见图 4。
3 讨论
线粒体的受体蛋白作为新近发现的影响线粒体自噬过程的家族蛋白[9],在肿瘤进展过程中发挥着不可或缺的作用。目前共发现DRP1、BNIP3、FUNDC1、NIX、RHEB、LC3、OPA1和MFN1等8个成员,而FUNDC1作为线粒体受体家族中成员之一,可重编程肿瘤细胞的线粒体动力学、氧化生物能学和氧化还原平衡,从而在肿瘤细胞增殖以及侵袭中扮演着重要的角色[10]。FUNDC1是一种高度保守的线粒体外膜蛋白,被鉴定为一种线粒体自噬受体,可在缺氧条件下直接与自噬微管相关蛋白LC3结合[11]。而在肿瘤细胞中,FUNDC1和LC3的结合会直接影响线粒体功能的稳定,从而影响肿瘤细胞的能量代谢以及对葡萄糖的摄取能力,从而在肿瘤细胞恶性程度中起一定作用[12]。然而长期吸烟作为NSCLC最主要的独立危险因素之一,缺氧是NSCLC患者常有的状态,那么FUNDC1在其中是否有一定的作用?本研究依据FUNDC1的生物学特性,基于TCGA数据库以及临床病理学特征深入探究了FUNDC1在非小细胞肺癌临床特性以及预后中的影响。
线粒体膜结合的FUNDC1蛋白作为一种线粒体自噬的调节因子,可以激活肿瘤细胞的自噬,起到促癌基因的作用[13],并且Hou等[14]于2017年发现FUNDC1在宫颈癌中表达明显上调,且其高表达与宫颈癌患者预后呈负相关,可作为总生存期和无病生存期的独立预后影响因素。Hui等[15]在喉癌细胞以及组织中均发现FUNDC1高表达,且过氧化氢通过激活ERK1/2信号上调FUNDC1的表达,从而触发线粒体自噬反应,使喉癌细胞适应生存。同时在神经母细胞瘤中,同样发现FUNDC1过表达并诱导线粒体自噬的发生[16]。基于以上研究结果,我们明确了FUNDC1蛋白在非小细胞肺癌高表达,也许是通过触发线粒体自噬反应促进非小细胞肺癌细胞的生存适应以及增殖而增强其侵袭性以及远处转移。
本研究进一步探索了FUNDC1表达上调与非小细胞患者临床病理学特征之间的相关性,结果显示FUNDC1的表达上调与患者区域淋巴结转移和分化程度有明显相关性。另外,Cox回归分析显示,FUNDC1蛋白表达、区域淋巴结转移、病理分化程度均是非小细胞肺癌患者的独立预后危险因子,FUNDC1表达的上调与患者总体生存率以及无进展生存率的下降存在明显相关性。FUNDC1表达上调影响患者预后的研究,同样在其他肿瘤类型中也有研究,例如喉癌[15]和宫颈癌[14]等。结合本研究结果,FUNDC1表达上调促进非小细胞肺癌患者肿瘤侵袭以及降低患者预后的作用明确,但具体作用机制目前尚不明确,据推测,FUNDC1依赖的自噬可能是由缺氧触发的,其方式严重依赖于缺氧诱导因子-1α(hypoxia inducible factor 1a, HIF-1α),其可被认为是一种清除剂,以中和ROS,这对癌症的发展至关重要;除了抗氧化特性外,FUNDC1相关的自噬还可以在转录和翻译后水平上感知并传递许多应激信号,如炎性反应、营养底物转换或免疫调节等,最终影响肿瘤代谢、增殖、突变、免疫动员分化和转移[17-19]。有学者提出,基于FUNDC1在线粒体自噬中的独立作用,可通过FUNDC1-LonP1轴的线粒体重组过程在肿瘤的增殖和侵袭状态之间切换来控制肿瘤细胞的可塑性[10]。FUNDC1的异常表达促进了线粒体膜电位的缺失以及线粒体片段的自噬,影响了凋亡信号通路的相关分子BCL-xL,从而抑制了肿瘤细胞的凋亡[20]。FUNDC1的异常表达是否通过诱导线粒体自噬的发生将是我们下一步研究的方向。
本研究首次检测了非小细胞肺癌患者肿瘤组织中FUNDC1的表达谱,发现高FUNDC1表达可作为患者不良预后的独立预测因子,具有潜在的癌基因特征,因此,FUNDC1可能成为非小细胞肺癌等肿瘤新的治疗靶点。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:袁晨东:研究设计、数据整理与分析、论文撰写舒旭峰、王小强、揭志刚:论文校对、数据收集 -
[1] Rawla P, Sunkara T, Barsouk A. Epidemiology of colorectal cancer: incidence, mortality, survival, and risk factors[J]. Prz Gastroenterol, 2019, 14(2): 89-103.
[2] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[3] Pedersen KM, Çolak Y, Bojesen SE, et al. Low high-density lipoprotein and increased risk of several cancers: 2 population-based cohort studies including 116, 728 individuals[J]. J Hematol Oncol, 2020, 13(1): 129. doi: 10.1186/s13045-020-00963-6
[4] Zeljkovic A, Vekic J, Mihajlovic M, et al. Revealing the Role of High-Density Lipoprotein in Colorectal Cancer[J]. Int J Mol Sci, 2021, 22(7): 3352. doi: 10.3390/ijms22073352
[5] Fang Z, He M, Song M. Serum lipid profiles and risk of colorectal cancer: a prospective cohort study in the UK Biobank[J]. Br J Cancer, 2021, 124(3): 663-670. doi: 10.1038/s41416-020-01143-6
[6] Richmond RC, Davey Smith G. Mendelian Randomization: Concepts and Scope[J]. Cold Spring Harb Perspect Med, 2022, 12(1): a040501. doi: 10.1101/cshperspect.a040501
[7] Boef AG, Dekkers OM, Le Cessie S. Mendelian randomization studies: a review of the approaches used and the quality of reporting[J]. Int J Epidemiol, 2015, 44(2): 496-511. doi: 10.1093/ije/dyv071
[8] Teslovich TM, Musunuru K, Smith AV, et al. Biological, clinical and population relevance of 95 loci for blood lipids[J]. Nature, 2010, 466(7307): 707-713. doi: 10.1038/nature09270
[9] Huyghe JR, Bien SA, Harrison TA, et al. Discovery of common and rare genetic risk variants for colorectal cancer[J]. Nat Genet, 2019, 51(1): 76-87. doi: 10.1038/s41588-018-0286-6
[10] Bowden J, Del Greco MF, Minelli C, et al. Improving the accuracy of two-sample summary-data Mendelian randomization: moving beyond the NOME assumption[J]. Int J Epidemiol, 2019, 48(3): 728-742. doi: 10.1093/ije/dyy258
[11] Sanderson E, Spiller W, Bowden J. Testing and correcting for weak and pleiotropic instruments in two-sample multivariable Mendelian randomization[J]. Stat Med, 2021, 40(25): 5434-5452. doi: 10.1002/sim.9133
[12] Slob E AW, Burgess S. A comparison of robust Mendelian randomization methods using summary data[J]. Genet Epidemiol, 2020, 44(4): 313-329. doi: 10.1002/gepi.22295
[13] Jafri H, Alsheikh-Ali AA, Karas RH. Baseline and on-treatment high-density lipoprotein cholesterol and the risk of cancer in randomized controlled trials of lipid-altering therapy[J]. J Am Coll Cardiol, 2010, 55(25): 2846-2854. doi: 10.1016/j.jacc.2009.12.069
[14] Yang Z, Tang H, Lu S, et al. Relationship between serum lipid level and colorectal cancer: a systemic review and meta-analysis[J]. BMJ Open, 2022, 12(6): e052373. doi: 10.1136/bmjopen-2021-052373
[15] Ganjali S, Banach M, Pirro M, et al. HDL and cancer-causality still needs to be confirmed? Update 2020[J]. Semin Cancer Biol, 2021, 73: 169-177. doi: 10.1016/j.semcancer.2020.10.007
[16] Tian Y, Wang K, Li J, et al. The association between serum lipids and colorectal neoplasm: a systemic review and meta-analysis[J]. Public Health Nutr, 2015, 18(18): 3355-3370. doi: 10.1017/S1368980015000646
[17] Tverdal A, Høiseth G, Magnus P, et al. Alcohol Consumption, HDL-Cholesterol and Incidence of Colon and Rectal Cancer: A Prospective Cohort Study Including 250, 010 Participants[J]. Alcohol Alcohol, 2021, 56(6): 718-725. doi: 10.1093/alcalc/agab007
[18] El-Mikkawy DME, El-Sadek MA, El-Badawy MA, et al. Circulating level of interleukin-6 in relation to body mass indices and lipid profile in Egyptian adults with overweight and obesity[J]. Egypt Rheumatol Rehabil, 2020, 47: 7. doi: 10.1186/s43166-020-00003-8
[19] Mladenov M, Lubomirov L, Grisk O, et al. Oxidative Stress, Reductive Stress and Antioxidants in Vascular Pathogenesis and Aging[J]. Antioxidants (Basel), 2023, 12(5): 1126. doi: 10.3390/antiox12051126
[20] Zhang C, Zhai T, Zhu J, et al. Research Progress of Antioxidants in Oxidative Stress Therapy after Spinal Cord Injury[J]. Neurochem Res, 2023, 48(12): 3473-3484. doi: 10.1007/s11064-023-03993-x
[21] Iqbal MJ, Kabeer A, Abbas Z, et al. Interplay of oxidative stress, cellular communication and signaling pathways in cancer[J]. Cell Commun Signal, 2024, 22(1): 7. doi: 10.1186/s12964-023-01398-5
[22] Lee JS, Won HS, Sun DS, et al. Prognostic role of tumor-infiltrating lymphocytes in gastric cancer: A systematic review and meta-analysis[J]. Medicine (Baltimore), 2018, 97(32): e11769. doi: 10.1097/MD.0000000000011769
[23] Zamanian-Daryoush M, Lindner D, Tallant TC, et al. The cardioprotective protein apolipoprotein A1 promotes potent anti-tumorigenic effects[J]. J Biol Chem, 2013, 288(29): 21237-21252. doi: 10.1074/jbc.M113.468967
[24] Thompson B, Katsanis N, Apostolopoulos N, et al. Genetics and functions of the retinoic acid pathway, with special emphasis on the eye[J]. Hum Genomics, 2019, 13(1): 61. doi: 10.1186/s40246-019-0248-9
[25] Luo H, Fang YJ, Lu MS, et al. Dietary and serum vitamins A and E and colorectal cancer risk in Chinese population: a case-control study[J]. Eur J Cancer Prev, 2019, 28(4): 268-277. doi: 10.1097/CEJ.0000000000000452
[26] Han X, Zhao R, Wang Y, et al. Dietary Vitamin A Intake and Circulating Vitamin A Concentrations and the Risk of Three Common Cancers in Women: A Meta-Analysis[J]. Oxid Med Cell Longev, 2022, 2022: 7686405.
[27] Imajo M. Analysis of Retinoic Acid Receptor Signaling in Colorectal Cancer[J]. Methods Mol Biol, 2019, 2019: 85-93.
[28] Castiello L, Zevini A, Vulpis E, et al. An optimized retinoic acid-inducible gene I agonist M8 induces immunogenic cell death markers in human cancer cells and dendritic cell activation[J]. Cancer Immunol Immunother, 2019, 68(9): 1479-1492. doi: 10.1007/s00262-019-02380-2
[29] Bi G, Liang J, Bian Y, et al. The immunomodulatory role of all-trans retinoic acid in tumor microenvironment[J]. Clin Exp Med, 2023, 23(3): 591-606.
[30] Lavudi K, Nuguri SM, Olverson Z, et al. Targeting the retinoic acid signaling pathway as a modern precision therapy against cancers[J]. Front Cell Dev Biol, 2023, 11: 1254612. doi: 10.3389/fcell.2023.1254612
[31] Villéger R, Chulkina M, Mifflin RC, et al. Disruption of retinol-mediated IL-6 expression in colon cancer-associated fibroblasts: new perspectives on the role of vitamin A metabolism[J]. Oncotarget, 2023, 14: 377-381. doi: 10.18632/oncotarget.28399
-
期刊类型引用(2)
1. 莫艳秀,姚飞虹,刘峻彤,胡紫昂,李木兰. SP600125对人宫颈癌HeLa细胞增殖和侵袭的影响. 肿瘤防治研究. 2022(04): 304-313 .  本站查看
本站查看
2. 赵永,黄萍,郭子文,汪琼. 基于加权基因共表达网络分析慢性阻塞性肺疾病的差异基因及信号通路. 华南国防医学杂志. 2022(12): 959-966 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: